
- •Введение
- •Глобины
- •Миоглобин
- •Гемоглобин
- •Четвертичная структура гемоглобина
- •Присоединение кислорода к гемоглобину и сопровождающие его изменения третичной структуры
- •Функциональная роль четвертичной структуры гемоглобина
- •Участие гемоглобина в транспорте со2 и ионов водорода
- •Список литературы
- •1.Степанов в.М. Молекулярная биология. Структура и функции белков. Москва, Высшая школа 2002 г.
Функциональная роль четвертичной структуры гемоглобина
В общей сложности при переходе от дезоксигемоглобина к полностью оксигенированной, насыщенной кислородом молекуле утрачивается восемь ионных связей как внутри субъединиц, так и между ними, причем затрагиваются относительно слабые контакты a1— a2 и в1—в2. Ослабление последних приводит к релаксации молекулы гемоглобина и дает возможность ее половинам a—в-димерам — изменить свою ориентацию друг относительно друга. Это смещение достигает 7 А; при этом наиболее прочный контакт a1—в1 практически не затрагивается.
Перемещение димеров а— в происходит как бы скачком, так как существует два способа организации нековалёнтных взаимодействий на контакте а1—в2. Его поверхность можно огрубление представить в виде ласточкина хвоста , причем в одной (дезокси- или Т) (форме относительное расположение субъединиц стабилизируется, в частности водородной связью между ТугС7 а1 -субъединицы и карбоксилом AspGl субъединицы в2. При переходе в оксиформу эта связь утрачивается, зато карбоксильная группа AspGl а1-субъединицы, оказавшись в стерически благоприятном положении после перемещения димеров друг относительно друга, дает водородную связь с AsnG4 субъединицы в2. Таким образом, контакт а1— в2 работает как своеобразный переключатель, способный принимать одно из двух состояний в зависимости от того, присоединился или нет кислород к соответствующим субъединицам.
Итак, присоединение молекулы кислорода к субъединице гемоглобина вызывает целую последовательность структурных изменений, распространяющихся от тема к периферии глобулы и смещающих ионизованные группы на ее поверхности. Речь идет о типичном для третичной структуры белка явлении — передаче эффекта на значительные расстояния. Если бы такой эффект оставался только в рамках третичной структуры, его вклад был бы не столь значительным. Однако в гемоглобине он приводит к изменению ионных взаимодействий в слабом контакте между субъединицами, изменяя его и способствуя кооперативному переходу четвертичной структуры в иное состояние.
Следовательно, изменения, происшедшие в одной из субъединиц при присоединении кислорода, могут быть переданы на остальные субъединицы, которым будет выгодно изменить конформацию так, чтобы их третичная структура соответствовала переминовавшейся четвертичной, а значит, стала бы благоприятной для присоединения молекул кислорода. Понятно, что такая перестройка четвертичной структуры, ее переход из свойственной дезоксигемоглобину Т формы в характерную для оксигемоглобина релаксированную R-форму маловероятны (хотя в какой-то мере и возможны), если молекула кислорода присоединилась только к одной того, необходимость описанных противоречащих Т-структуре из четырех субъединиц. Более изменений третичной структуры гемоглобина, препятствует, присоединению первой молекулы кислорода и благоприятствует ее отщеплению.
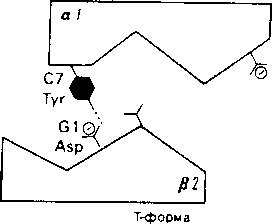
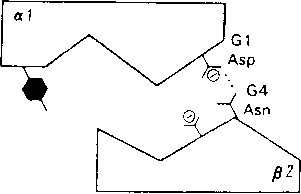
Рис. Переход а1/в2-контакта при оксигенировании гемоглобина
Контакт; имеющий форму «ласточкина хвоста», при оксигенировании и переходе молекулы из Т- в R- состояние может также находиться в одном из двух состояний. Утрата водородной связи Туг C7—Asp G1 между а1- и в2-субъединищми компенсируется установлением связи между Asp Gl и Asр G4
Следовательно, присоединение первой и в меньшей мере второй молекулы кислорода будет протекать с трудом. Для него потребуется заметно большее парциальное давление кислорода, чем для насыщения миоглобина, где таких задержек нет. Действительно, этот процесс — начало насыщения гемоглобина кислородом — происходит в альвеолах легких, где парциальное давление кислорода велико.
Очень важно, что после присоединения двух молекул кислорода к гемоглобину четвертичная структура с примерно с равной вероятностью может оказаться как в Т-, так и в R-форме. Последняя способствует присоединению третьей молекулы кислорода, после которого вероятность перехода всей структуры, в том числе и четвертой субъединицы, пока не «заряженной» кислородом, в структуру, облегчающую присоединение к ней кислорода, становится весьма высокой. Это ведет к вострому завершению процесса насыщения всей тетрамерной молекулы кислородом. Таким образом, присоединение кислорода к гемоглобину, будучи кооперативным процессом, как бы следует принципу «отдай имеющему», что обеспечивает полноту «нагрузки» молекул-переносчиков кислородом в легких.
В тканях первая молекула кислорода отщепляется с определенными затруднениями, так как это требует изменений в контакте субъединиц, противоречащих свойственной оксигемоглобину четвертичной структуре. Однако эти затруднения преодолеваются благодаря низкому парциальному давлению кислорода, которое делает обратную реакцию маловероятной.
Отщепление последующих молекул кислорода облегчается с каждым шагом, что приводит к полной «разгрузке» транспортной молекулы. Так, кооперативность обеспечивает эффективный перенос кислорода от легких к тканям. Как полагают физиологи, в отсутствие кооперативных эффектов, например, если бы эритроциты содержали миоглобин вместо гемоглобина, животные погибали бы от кислородной недостаточности в тканях.
2,3-Дифосфоглицерат—эффектор, регулирующий функцию гемоглобина
Очевидно, что кооперативность присоединения и отщепления кислорода гемоглобином зависит от того, насколько легок или, наоборот, труден координированный переход четвертичной структуры из Т- в R-состояние. Оказалось, что 2,3- дифосфоглицерат, содержащийся в эритроцитах, способен избирательно взаимодействовать с дезоксигемоглобином, стабилизируя его четвертичную структуру (Т- форму). 2,3-Дифосфоглицерат несет пять отрицательных зарядов, которые могут быть распределены между восемью атомами кислорода. Его молекула связывается во впадине, образованной обеими Р-субъединицами, где она взаимодействует сразу с семью катионными группами этих цепей. Это а-аминогруппы N-концевых Val- 1, имидазольные кольца His-2 и His-143 обеих а-субъединиц, а также аминогруппа остатка Lys-82 какой-либо одной из них .
Стабилизация дезоксиформы понижает сродство к кислороду гемоглобина, образовавшего комплекс с 2,3-дифосфоглицератом. В отсутствие эффектора 2,3-дифосфоглицерата — гемоглобин А взрослого человека насыщается кислородом на 50% при 12 мм рт.ст., в присутствии же дифосфоглицерата для 50%-ного насыщения гемоглобина кислородом необходимо уже его парциальное давление, равное 50 мм. рт.ст. 2,3-Дифосфоглицерат — соединение, структурно ничего общего не имеющее с кислородом и связывающееся участком гемоглобина, далеким от места присоединения кислорода. Тем не менее ,оно существенно влияет на взаимодействие кислорода и гемоглобина. Обладающие такой способностью соединения, которым принадлежит большая роль в регули ровании функции белков в организме, получили название аллостерических структурно далеких эффекторов. Важно отметить, что сама возможность такого воздействия эффектора на структурно удаленный функциональный центр белка основана на способности четвертичной структуры отвечать на относительно слабые воздействия.
Изменения зоны связывания 2,3-дифосфоглицерата способны значительно влиять на сродство гемоглобина к кислороду. Так, в в-цепях гемоглобина южноамериканской ламы, живущей на больших высотах и нуждающейся в адаптации к пониженному парциальному давлению кислорода, остатки His-2 заменены остатками аспарагина, которые не несут катионной группы и не могут участвовать в связывании 2,3-дифосфоглицерата. Как следствие, дезоксиформа гемоглобина ламы оказывается менее стабилизированной и сродство к кислороду повышается. 50%-ное насыщение гемоглобина ламы наступает уже при парциальном давлении кислорода, равном 24 мм рт.ст. Функциональный смысл такой замены вполне очевиден, тем более что у одногорбого верблюда (эволюционного предка ламы), живущего на равнине, место связывания 2,3-дифосфоглицерата представлено семью катионными группами, включая и остатки His-2 в-цепей.
Гемоглобин F плода человека (феталъный) синтезируется только во время беременности и должен обеспечивать перенос кислорода от плаценты, где его парциальное давление составляет всего около 12 мм рт.ст., к тканям плода (по выражению физиологов, «плод дышит на высоте Эвереста»). Понятно, что гемоглобин F должен обладать большим сродством к кислороду, чем гемоглобин взрослого человека. Это также достигается за счет замены His-143 в P-цепи гемоглобина F на серин, что ослабляет связывание 2,3-дифосфоглицерата и уменьшает стабилизацию дезоксиформы гемоглобина.
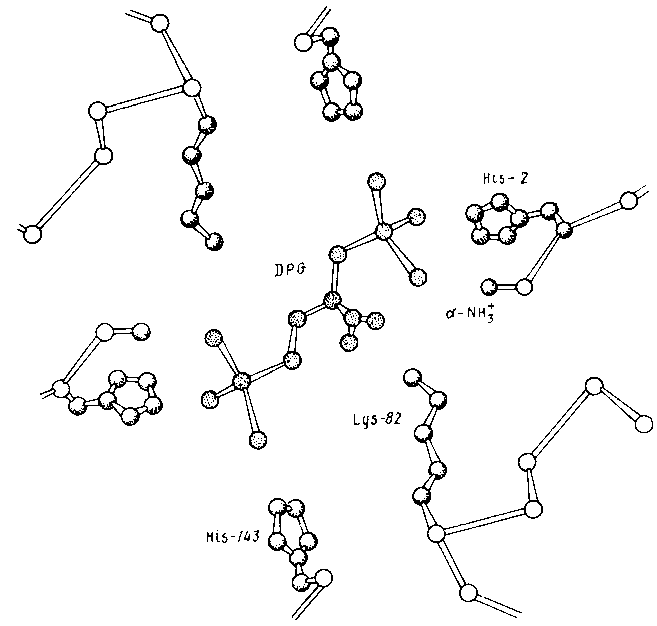
Рис. Связывание дифосфоглицерата (DPG) с катионными группами Р-субъединиц гемоглобина
Электростатические взаимодействия анионных групп 2,3-дифосфоглицерата с катионными группами дезоксигемоглобина (заштрихованы) существенно усиливают контакт между субъединицами, прежде всего очень слабый в1в2 контакт. Стабилизация дезоксиформы эквивалентна понижению сродства к кислороду. Сродство может быть повышено у гемоглобинов, способных связывать кислород при низком парциальном давлении, за счет ослабления взаимодействия с эффектором. Так, в гемоглобине ламы связывание ослаблено заменой His-2 на Asр-2, в гемоглобине F (плода), заменой His-143 на Ser-143, что уменьшает число катионных групп белка, взаимодействующих с анионными группировками эффектора
