
- •Введение
- •Глобины
- •Миоглобин
- •Гемоглобин
- •Четвертичная структура гемоглобина
- •Присоединение кислорода к гемоглобину и сопровождающие его изменения третичной структуры
- •Функциональная роль четвертичной структуры гемоглобина
- •Участие гемоглобина в транспорте со2 и ионов водорода
- •Список литературы
- •1.Степанов в.М. Молекулярная биология. Структура и функции белков. Москва, Высшая школа 2002 г.
Гемоглобин
Все гемоглобины млекопитающих имеют четвертичную структуру и состоит из четырех субъединиц. Практически всегда это две пары одинаковых субъединиц, так что гемоглобины стехиометрически могут быть представлены формулами вида а2 b2 , a2 g2 , a2 d2 и т.д. Пептидные цепи, соответствующие субъединицам гемоглобинов, обнаруживают сходство первичных структур, являются гомологичными. Так, при сравнении первичных структур а- и в-цепей гемоглобина А человека, которые состоят соответственно из 141 и 147 аминокислот, совпадает около половины остатков. Гомология выявляется и при сравнении последовательностей гемоглобинов и миоглобинов, хотя она менее выражена.
В то же время третичная структура и способ укладывания полипептидных цепей в пространстве у миоглобинов и субъединиц гемоглобинов весьма близки, что отражает их эволюционное родство, происхождение от одного предшественника:. Таким образом, субъединицы гемоглобина построены почти так же, как описанная выше молекула миоглобина: а-субъединица образована семью, в — восемью а-спиралями. Присоединение молекулы кислорода к субъединицам гемоглобина, каждая из которых содержит гем, в первом приближении протекает так же, как и при насыщении миоглобина.
Главное различие функциональных свойств миоглобина и гемоглобина состоит в том, что четвертичная структура сообщает молекуле гемоглобина способность регулировать присоединение и отщепление кислорода, придает ей кооперативные свойства, которых лишен миоглобин. С учетом этого дальнейшее рассмотрение свойств гемоглобина будет посвящено анализу четвертичной структуры этого белка и ее функциональной роли.
Четвертичная структура гемоглобина
В четвертичной структуре гемоглобина субъединицы образуют тетраэдр, стабилизированный межсубъединичными контактами—системой нековалентных связей. Эти контакты, на которые приходится в общей сложности примерно 1/5 для всей поверхности четырех субъединиц, весьма различны по числу нековалентных взаимодействий и, следовательно, по прочности . Наиболее развит и наиболее устойчив контакт между а-субъединицей и одной из в-субъединиц — так называемый контакт а1 — в1. В его образовании участвует 34 аминокислотных остатка, 110 атомов сближены в нем на расстояние, меньшее 4 А. Если принять общую площадь межсубъединичных контактов за 100%, то на контакт а1 — в1 и идентичный ему а2 — в2 придется 60%, что отвечает весьма сложной сети по преимуществу гидрофобных взаимодействий и нескольких водородных связей. Контакт той же а1 -субъединицы с другой а-субъединицей, так называемый контакт а1 — в2, выглядит иначе, так как его образуют другие участники поверхности глобул.
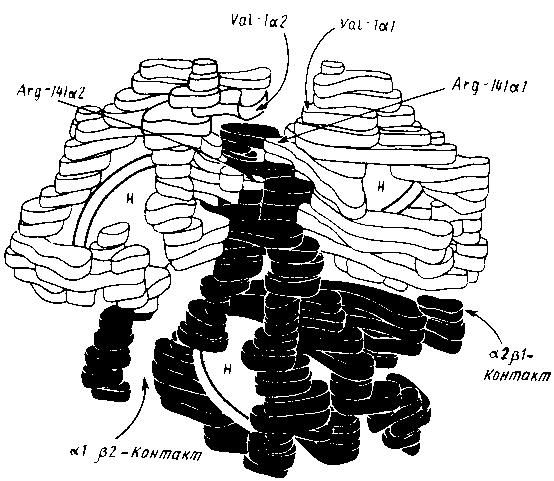
Рис. Модель четвертичной структуры гемоглобина
Диски, помеченные буквой Н, - гемы. Видны контакты а1/в2 и а2/в1 Показано, что слабый контакт а1в2 зависит от взаимодействия N-концевых остатков валина и С-концевых—аргинина
В его формировании участвует 19 остатков аминокислот, образующих гидрофобные контакты и водородные связи. На его долю (вместе с таким же контактом а2—в1) приходится 33% общей поверхности межсубъединичных контактов. Как следствие, он значительно слабее контакта а1 —в1.
Еще слабее контакты между одноименными субъединицами а1— а2 и в1— в2, которые, представлены немногими, преимущественно ионными, взаимодействиями. На них приходится около 7% общей поверхности контактов, стабилизирующих четвертичную структуру. Таким образом, два контакта, т.е. а1 —в1 и а2—в2, доминируют в структуре молекулы гемоглобина. В определенных условиях, например в 2М NaCl, гемоглобин диссоциирует на димеры а1—в1, сохраняющиеся благодаря прочному контакту а1—в1. Практически четвертичная структура гемоглобина как бы образована двумя относительно жестко связанными димерами а— в, которые удерживаются вместе более слабыми взаимодействия ( димер димеров)
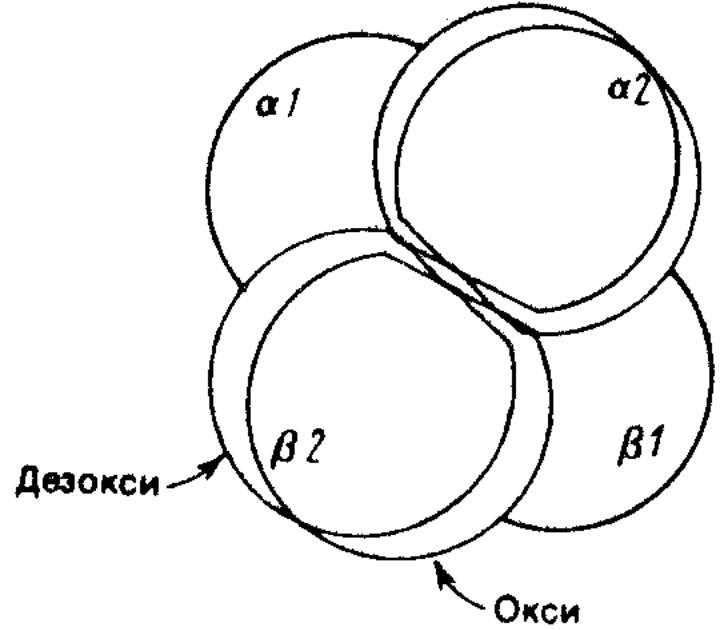
Рис. Поворот и смещение а /р-димеров в четвертичной структуре гемоглобина друг относительно друга при переводе белка из дезокси- в оксиформу
Поворот составляет примерно 15°, смещение - 0,8 А. Димеры фиксируются в новой позиции за счет изменений контакта а1в2
В определенных условиях взаиморасположение димеров может изменяться за счет изменения характера менее прочных контактов a1— в2 и особенно a1—a2 и в1—в2. Не следует думать, что слабые контакты между субъединицами, не слишком значимые для поддержания целостности молекулы, не важны функционально. Наоборот, именно сочетание слабых и сильных взаимодействий обусловливает кооперативностъ четвертичной структуры гемоглобина, что, по-видимому, характерно и для многих других белков, обладающих этим уровнем организации.
Как показал рентгеноструктурный анализ, четвертичная структура молекулы гемоглобина может находиться в одном из двух состояний, отличающихся поворотом димеров a— в друг относительно друга, Одно из них устойчиво, если субъединицы насыщены кислородом и молекула гемоглобина содержит четыре молекулы кислорода, — оксигемоглобин. Другое стабильно, если субъединицы кислорода не содержат, дезоксигемоглобин. Промежуточные формы неустойчивы, их содержание в любой момент времени невелико. Существованию двух взаимопревращающихся форм четвертичной структуры гемоглобин и обязан кооперативностью связывания и отщепления кислорода, а также рядом других функционально важных свойств.
