- •Министерство образования и науки российской федерации
- •1. Краткие сведения о геологии и нефтегазоносности территории западной сибири
- •Краткое геологическое строение Западно-Сибирской
- •Стратиграфия мезозойско-кайнозойских отложений.
- •1.2 Тектоническое строение платформенного мезозойско-кайнозойского чехла Западно-Сибирской нефтегазоносной провинции
- •1.3 Геолого – физические характеристики продуктивных пластов
- •1.4 Состав и физические свойства нефтей
- •1.5 Состав и свойства углеводородных газов
- •1.6 Пластовые воды нефтяных и газовых месторождений
- •1.6.3 Молекулярно - поверхностные свойства системы "нефть - газ - вода"
- •1.7 Строение залежей углеводородов месторождений Западной Сибири
- •1.8 Классификация ресурсов и запасов нефти и газа
- •2. Разработка нефтяных и газовых месторождений
- •2.1 Геолого - геофизические проблемы разработки нефтяных и
- •2.2 Изучение залежей в процессе геологоразведочных работ
- •2.3 Методы изучения залежей нефти и газа
- •2.4 Интегрированный анализ геолого-геофизической информации
- •2.5 Обработка и интерпретация геолого-геофизической информации
- •2.6 Изучение газожидкостных контактов
- •2.7 Гидродинамические характеристики залежей (текста нет!)
- •2.8 Подсчет запасов нефти и газа
- •2.9 Проектирование разработки нефтяных иесторождений
- •2..9.1 Силы, действующие в продуктивном пласте
- •2.9.2 Режимы работы залежей
- •2.10 Размещение нагнетательных скважин
- •2.11 Геолого - геофизические основы выделения эксплуатационных объектов на многопластовых нефтяных месторождениях
- •2.12 Принципиальные особенности проектирования
- •2.13 Системы разработки и принципы выбора метода
- •2.14 Системы разработки нефтяных месторождений
- •2.15 Физические основы вытеснения нефти водой
- •2.15.2 Анализ выработки запасов нефти
- •2.16 Построение геолого - технических моделей
- •2.16.7 Рекомендации по созданию и использованию постоянно действующих геолого-технических моделей
- •2.17 Повышение продуктивности скважин и нефтеотдача пластов
- •2.18 Методы повышения нефтеотдачи пластов
- •Уплотнение сеток скважин в процессе разработки месторождений. Плотность сетки скважин (пcc) - это отношение площади залежи f к числу скважин n.
- •2.18.2 Физико-химические методы увеличения нефтеотдачи пластов
- •Неионогенными пав
- •2.21.5 Техногенные факторы, влияющие на доизвлечение
- •3.1 Условия залегания углеводородов и типы газовых залежей
- •Фазовые состояния и превращения углеводородных систем
- •3.3 Расчет фазовых равновесий углеводородных смесей
- •3.4 Компонентоотдача газовых и газоконденсатных месторождений
- •3.5 Основные принципы проектирования разработки
- •3.5.1 Анализ разработки газовых и газоконденсатных месторождений на основе эволюционного моделирования
- •3.6 Особенности разработки газовых и газоконденсатных месторождений
- •3.6.1 Прогнозирование добычи газа и конденсата
- •3.7 Методы изучения газоконденсатной характеристики месторождения
- •3.7.1 Применение различных методов классификации
- •3.8 Повышение конденсатоотдачи нефтеконденсатных залежей
- •3.9 Оценка начальных и текущих запасов газа
- •3.9.1 Учет объемных и динамических характеристик залежи
- •3.10 Методы геолого - гидродинамического моделирования
- •3.10.1 Системный подход к стратегии эффективной разработки
- •3.10.3 Критерии оптимизации размещения кустов эксплуатационных скважин
- •3.11 Совершенствование методов газогидродинамического моделирования режимов работы газовых скважин
- •3.11.1 Теоретические аспекты моделирования газогидродинамических систем
- •3.12 Принципы построения и инициализации газогидродинамически
- •V. Промыслово-геофизический системный
- •5.1 Понятие системного контроля
- •5.2 Этапность и периодичность исследований и их комплексирование
- •5.3 Решение задач системного контроля
- •5.4 Обеспечение оценок выработки запасов и их подтверждаемость
- •5.5 Планирование и организация системы мониторинга
- •Vι. Системообразующая интерпретация и динамический анализ при геомониторинге и геомоделировании залежей углеводородов
- •6.1 Принципы интерпретации и динамического анализа
- •6.2 Задачи системообразующей интерпретации и динамического
- •Литература
Фазовые состояния и превращения углеводородных систем
Схемы фазовых превращений. Пластовая газоконденсатная смесь - это сложная гетерогенная система, состоящая из большого числа различных углеводородов (метана, этана, пропана, изобутана, н – бутана, пентана, гексана, гептана, октана, нонана, декана и более тяжёлых), азота, сероводорода, углекислого газа, гелия, паров воды [2,3 ,4,5,6,7,38, 39,40,41,42].
Для выявления типов залежей углеводородов, проектирования технологий их извлечения и утилизации необходимо знать закономерности фазовых состояний и превращений углеводородных систем.
Технология нефте – и конденсатоизвлечения связана с непрерывными процессами фазовых переходов при движении как в пласте, прискважинной зоне пласта, в стволе скважины, в системах сбора и подготовки нефти, так и при ее переработке. При повышении давления и неизменной температуре или понижении температуры и постоянном давлении происходят процессы конденсации пара в жидкость. Зависимость давления от температуры для чистого углеводорода характеризуется кривой испарения.
Углеводородные газы изменяют объем в зависимости от температуры и давления.
С приближением давления и температуры к их критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает и плотности их уравниваются. Фазовые превращения индивидуальных углеводородов можно представить и в системе координат Р – Т. Для однокомпонентной системы кривая давления насыщенного пара одновременно является кривой точек начала кипения и линией точек росы. При всех других Р и Т вещество находится в однофазном состоянии (жидком или газообразном).
С добавлением в систему другого углеводородного компонента в фазовых превращениях возникают свои особенности. Изотермическое сжатие системы приводит к конденсации сначала более тяжелого компонента, затем более легкого.
Приведенные исследования позволили выявить следующие закономерности:
- увеличение содержания в бинарной системе более тяжелого компонента сначала (до 50 % концентрации) повышает, а затем понижает критическое давление смеси;
- рост доли в системе тяжелого компонента сначала сдвигает критическую точку смеси слева до максимума (при равных долях л.у. и т.у.в смеси), затем - вправо от максимальных давлений в зоне двухфазного состояния;
- критические температуры в рассматриваемом интервале концентраций лежат в диапазоне критических температур составляющих смесь компонентов.
Эти принципиальные выводы можно перенести на основные типы залежей углеводородов (газоконденсатные, газонефтяные, нефтяные).
Результаты исследований позволили установить, что в системах с нафтеновыми углеводородами изотермы с одинаковой температурой находятся в области более высоких давлений, чем в системе с парафиновыми углеводородами. Изотерма систем с ароматическими углеводородами лежит в области более высоких давлений. Следовательно, при одинаковых давлениях и температурах парафиновые углеводороды растворяются в метане лучше нафтеновых и ароматических той же температуры кипения. Для перевода ароматических углеводородов в газовое состояние требуется значительно большее давление, чем для нафтеновых, и еще более значительное, чем для парафиновых.
Поведение многокомпонентных систем. Известно, что критическое давление смеси обычно выше, чем критическое давление чистых компонентов, кроме тех случаев, когда в смеси один из компонентов содержится в значительном количестве (т.е. правило аддитивности для вычисления Ркр смеси применять нельзя). Отклонение фактического Ркр от вычисленного возрастает с увеличиением разности между молекулярными массами чистых компонентов.
На рисунке 3.2 приведены диаграммы равновесных состояний газовой и жидкой фаз смесей метана с парафиновыми углеводородами нормального ряда при температуре 80°С. Левее и выше кривой точек начала кипения находится область жидкого состояния системы, а правее и ниже кривой точки росы - область парообразного состояния.
Кривые представляют собой изотермы, объединяющие точки, принадлежащие линиям начала кипения и конденсации, которые имеют одинаковые давления и температуру. Составы в этих точках аналогичны составам сосуществующих фаз (жидкой и газообразной). Например, для системы С1 - С7 при Р = 20 МПа и t = 80°С в составе жидкой фазы 0,63 молярной доли метана и 0,37 молярной доли С7, в сосуществующем с этой жидкой фазой газе будет 0,93 молярной доли С1 и 0,07 молярной доли С7. Установлено, что с увеличением молекулярной массы углеводородов (с повышением температуры кипения) требуется большее давление для перевода его в газообразное состояние в смеси с метаном.

Рисунок
3.2 - Изотермы фазового равновесия метана
с углеводородами различных групп:
метан
- н-гексан; метан - циклогексан;
метан - бензол.
Поведение многокомпонентных систем в критической области. Температура, при которой средняя молекулярная кинетическая энергия смеси становится равной потенциальной энергии притяжения молекул, называется критической, т.к. при более высокой температуре невозможно существование жидкой фазы.
Математически критерий критического состояния описывается уравнением:
|
(dP/dV)Tкр. = (d2P / dV2)Ткр. |
(3.1) |
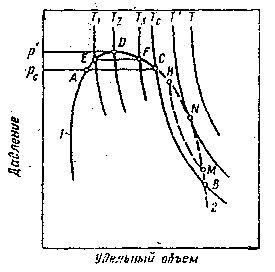
В области критических давлений и температур протекают специфические процессы, сущность которых можно проследить по схеме на рисунке 3.3. При давлениях Рс<Р<Рmax в части двухфазного состояния АДСА в равновесном состоянии находятся жидкая и газовая фазы. Аналогичное явление наблюдается в области СNВС. В этих областях с изменением давлений и температур происходят с многокомпонентными системами специфические превращения.
Из диаграммы на рисунке 3.3 следует, что при Рс<Р<Рmax нагревание системы вызывает в точке Е вскипание, а при дальнейшем повышении температуры объем газовой фазы в системе увеличивается. Но с приближением по изобаре к точке F газовая фаза растворяется в жидкости, поэтому в точке F имеем снова жидкую фазу. Обратное изобарическое охлаждение системы приводит к обратному эффекту. По этой причине всю область АДСА называют областью ретроградного испарения.
При изотермическом повышении давления в системе в области Тс<Т<Тmax сначала в точке М газовая фаза начинает конденсироваться и дальнейшее сжатие при той же температуре увеличивает содержание жидкой фазы в системе. Но в точке Н система вновь становится газовой. Обратное изотермическое расширение системы приводит к обратному эффекту.
Всю область СNВС называют областью ретроградной конденсации. Рассмотренные фазовые превращения в области критических параметров многокомпонентных смесей сопровождаются непрерывным изменением состава и объемных соотношений жидкой и паровой фаз. Эти закономерности особенно важны для прогнозирования процессов в газоконденсатных залежах, так как выпадение конденсата в них сначала будет максимальным вблизи стенок добывающих скважин, затем зона выделения его растет по мере падения давления в залежи (при условии, что разработка ГКЗ ведется без ППД).
|
|
Рисунок 3.3 Схематические изотермы многокомпонентных углеводородных смесей вблизи критических давлений и температур |