
- •Содержание
- •ВВедение
- •Техника безопасности
- •Работа 1 Техника лабораторных работ
- •Работа 2 методы очистки веществ
- •Перекристаллизация
- •Возгонка
- •Перегонка
- •Очистка газов
- •Экспериментальная часть
- •Вопросы к допуску
- •Работа 3 Определение эквивалента простых и сложных веществ
- •Вопросы к защите
- •Работа 4 определение атомных и молярных масс
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 5 классы неорганических соединений и периодическая система элементов. Типы химических реакций
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 6 Комплексные соединения
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 7
- •Теплоты химических процессов
- •Рассчитывают стандартную теплоту реакции на основе следствий из закона Гесса.
- •Опыт1. Определение теплоты гидратации карбоната натрия
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 8 скорость химических реакций. Химическое равновесие. Катализ
- •Опыт1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Зависимость скорости реакции от температуры
- •Опыт 3. Гомогенный катализ
- •Опыт 4. Скорость гетерогенных химических реакций
- •Опыт 5. Смещение химического равновесия при изменении концентрации реагирующих веществ
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 9 Приготовление растворов заданной концентрации
- •Способы выражения количественного состава растворов
- •Приготовление растворов с заданной массовой долей вещества а) из твердого вещества и воды
- •Б) из концентрированного раствора и воды
- •В) Смешивание двух растворов с различной массовой долей вещества
- •2. Приготовление растворов определенной молярной и молярной концентраций эквивалента. А) из твердого вещества и воды.
- •Б) из концентрированного раствора и воды
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 10 Реакции в растворах электролитов
- •Вопросы допуска
- •Вопросы к защите
- •Вопросы допуска
- •Вопросы к защите
- •Вопросы допуска
- •Вопросы к защите
- •Литература
Перегонка
Перегонка или дистилляция основана на превращении жидкости в пар с последующей конденсацией пара в жидкость. Этим методом отделяют жидкость от растворённых в ней твёрдых веществ или менее летучих жидкостей. Так, например, с помощью перегонки очищают воду от солей, которые в ней содержатся. В результате получается дистиллированная вода.
Для перегонки небольших количеств жидкости в лабораторных условиях применяют прибор для перегонки (рис. 2.2).
Жидкость закипает тогда, когда давление её пара становится равным внешнему давлению (обычно атмосферному). Чистое вещество при постоянном давлении кипит при строго определённой температуре. Смеси кипят при различных температурах, зависящих от состава. Поэтому температура кипения является характеристикой чистоты вещества. Чем чище вещество, тем меньше разница между температурой кипения вещества и температурой перегонки, при которой оно перегоняется.
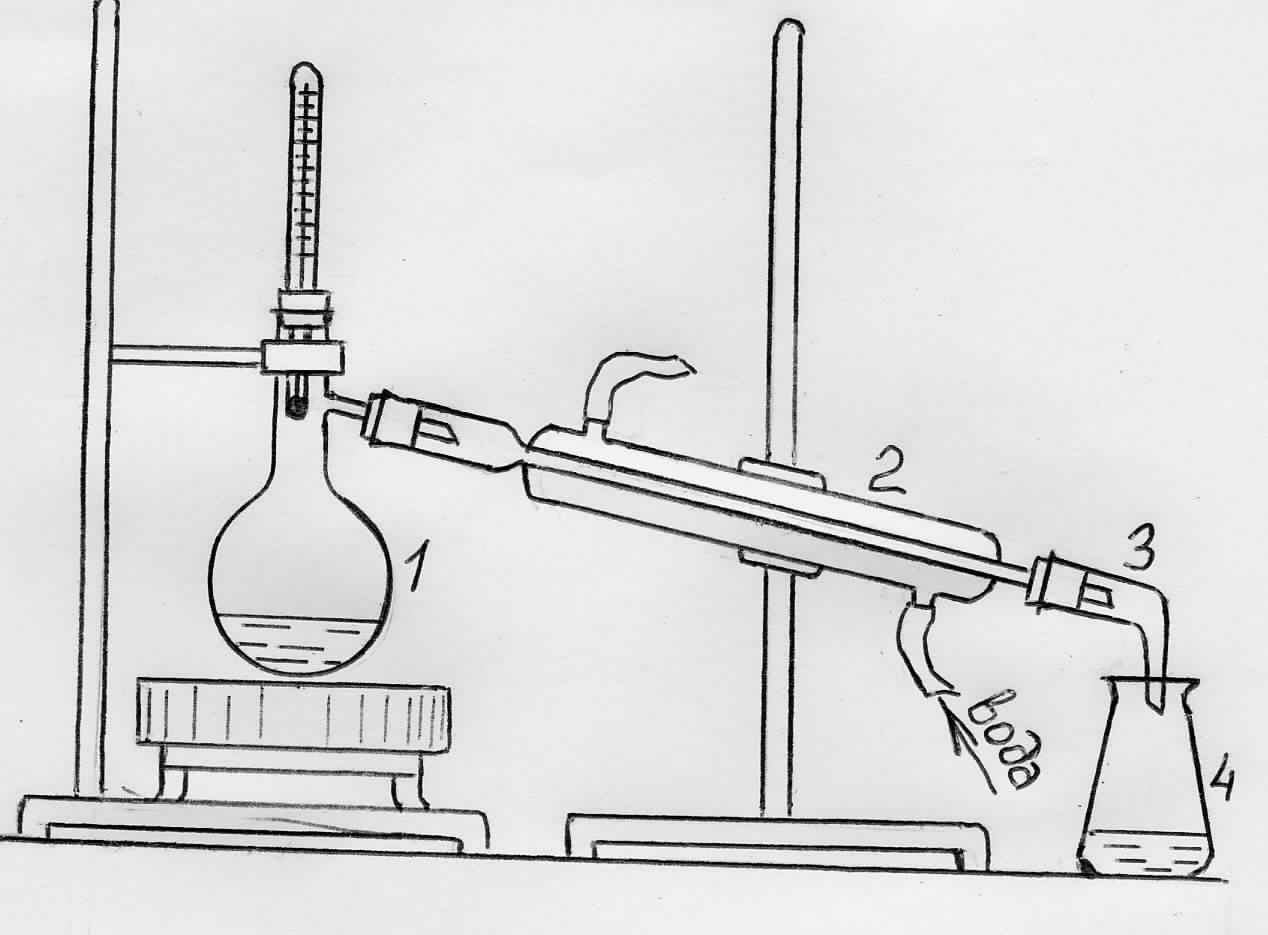
Рис. 2.2. Установка для перегонки:
1 – колба Вюрца, 2 – холодильник Либиха, 3 – аллонж, 4 – приёмник
Перегонка, когда дистиллят отбирается при различных интервалах температур и в различных приёмниках, называется дробной или фракционной перегонкой. Жидкости в приёмниках, отобранные в определённых интервалах температур, называются фракциями. Повторяя несколько раз дробную перегонку, можно почти полностью разделить смесь жидкостей и получить компоненты смеси в чистом виде.
Более полному и быстрому разделению смеси жидкостей путём фракционной перегонки благоприятствует применение дефлегматоров или ректификационных колонок. Перегонка с дефлегматором, а также другие приёмы перегонки, как-то: перегонка под уменьшенным давлением – рассматриваются в руководствах и практикумах по органической химии.
Очистка газов
Очистка газов от примесей достигается путём пропускания его через такие вещества, которые поглощают эти примеси. Например, для получения в приборе Киппа углекислого газа наряду с CO2 выходят примеси: хлористый водород (от соляной кислоты) и пары воды. Если углекислый газ с примесями пропустить сначала через промывалку с водой (для поглощения хлористого водорода), а затем через серную кислоту (для поглощения паров воды), то он получится практически чистым.
Для определения степени чистоты вещества применяются физические и химические методы исследования. К первым относятся: для жидких веществ – определение плотности, температуры кипения, показателя преломления; для твёрдых веществ – определение температуры плавления и ряд других, к вторым методам относятся химические качественные и количественные анализы на содержание примесей.
Абсолютно чистых веществ нет. Применяемые в лабораторных практикумах вещества имеют различную степень чистоты. Максимально допустимое количество примесей в веществе устанавливается государственным стандартом (ГОСТ).
Для лабораторных работ по общей химии и качественному анализу пригодны вещества с маркировкой х.ч. и ч.д.а.
Экспериментальная часть
Опыт 2.1. Очистка медного купороса перекристаллизацией
Насыщенный при 80С раствор содержит 34,9% сульфата меди. Рассчитайте количества кристаллогидрата и воды, необходимые для приготовления 30г насыщенного при 80С раствора.
Отмерьте цилиндром вычисленное количество дистиллированной воды, перелейте в стакан ёмкостью 50 мл, нагрейте до начала кипения и растворите при помешивании стеклянной палочкой навеску медного купороса.
Для проверки содержится ли в приготовленном растворе ионы хлора, налейте в коническую пробирку 3 капли раствора, добавьте 1 каплю раствора нитрата серебра и 2 капли азотной кислоты. Опишите наблюдения, напишите уравнения реакций.
Охладите раствор при помешивании палочкой. Осадок отфильтруйте под вакуумом (рис. 2.3).

Рис. 2.3. Фильтрование под вакуумом
1 – колба Бунзена, 2 – воронка Бюхнера, 3 – водоструйный насос
Промойте кристаллы 5 мл холодной дистиллированной воды (зачем?). Затем снимите кристаллы соли с воронки и отожмите их между листами фильтровальной бумаги до тех пор, пока они не перестанут прилипать к сухой стеклянной палочке. Полученную соль взвесьте, определите в процентах выход соли, принимая вычисленное количество CuSO45H2O, которое теоретически должно было выделиться, за 100% (при 20С насыщенный раствор соли содержит 17,2% CuSO4).
Раствор очищенной соли и маточный раствор испытайте на присутствие хлорид-аниона.
Опыт 2.2. Очистка йода возгонкой (Работать под тягой!)
Взвесьте на технохимических весах 0,3г йода и 0,1г йодистого калия, поместите их на дно стаканчика для возгонки и перемешайте стеклянной палочкой. Йодистый калий добавляется для связывания (удаления) возможных примесей хлора и брома, содержащихся в йоде. Стаканчик накройте круглодонной колбочкой с холодной водой, как показано на рис.2. 4, и осторожно нагрейте через асбестовую сетку на электрической плитке. Наблюдается ли образование жидкости при возгонке?
Соберите кристаллы йода, взвесьте их и определите процент выхода.
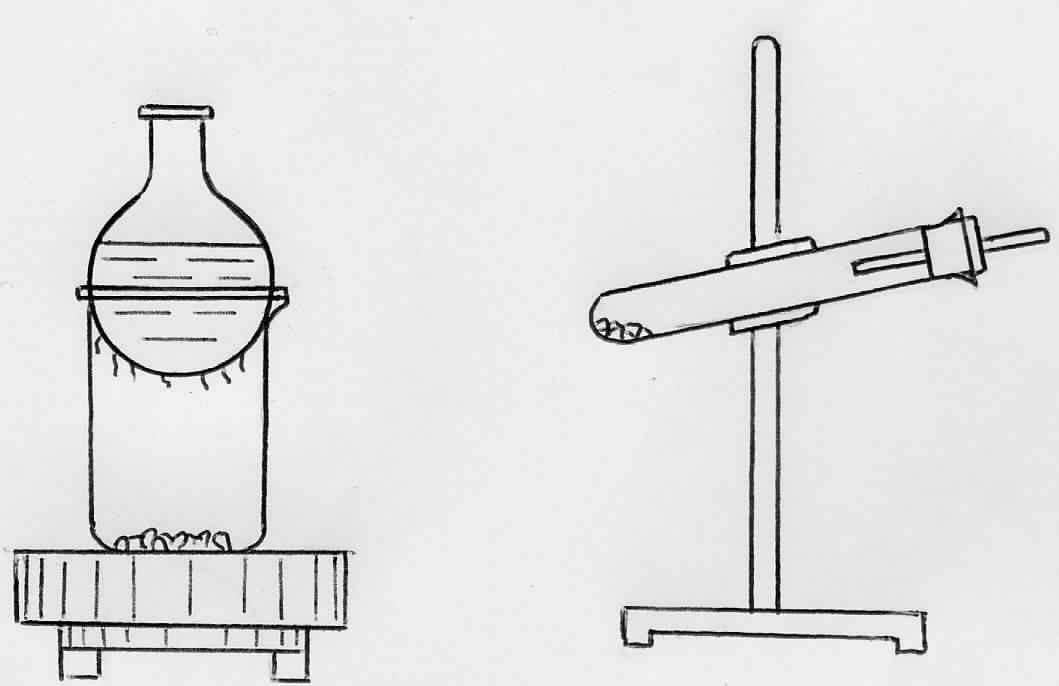
Рис. 2.4. Возгонка йода Рис. 2.5. Плавление йода
Опыт 2.4. Очистка воды перегонкой
В колбу Вюрца (рис. 2.2) налейте до половины водопроводной воды. К воде для очистки её от органических веществ добавьте 3 - 4 капли раствора марганцовокислого калия и 4 - 5 капель серной кислоты. На дне колбы поместите заранее приготовленные стеклянные капилляры (необходимые для равномерного кипения жидкости). Отверстие колбы закройте пробкой с термометром. Шарик термометра должен быть опущен ниже уровня отводной трубки колбы. Отводную трубку колбы через пробку соедините с холодильником. Нижнюю каучуковую трубку холодильника присоедините к водопроводному крану и пустите не очень сильную струю воды. На конец холодильника наденьте аллонж и опустите в приёмник. Закончив сборку прибора, нагрейте воду в колбе до кипения. Отбросьте первую небольшую порцию дистиллята (зачем?), после чего соберите его 20 - 30 мл. На часовое стекло налейте несколько капель полученной воды и выпарьте над пламенем сухого горючего. На другом часовом стекле проделайте то же самое с водопроводной водой. Сравните результаты выпаривания. Чистая вода не должна давать осадка после выпаривания.
Опыт 2.5. Очистка углекислого газа
Для получения углекислого газа используйте аппарат Киппа (рис. 2.6), который состоит из сосуда 1 с сужением посредине и большой шарообразной воронки 2. В верхнюю часть сосуда 1 помещают применяемое для получения газа твёрдое вещество. В воронку наливают жидкость, откуда она по трубке воронки поступает в нижнюю часть сосуда, который имеет в верхней части газоотводную трубку 3, внизу - тубус 4, служащий для выливания отработанной жидкости. Когда кран газоотводной трубки открыт, жидкость заполняет нижнюю часть сосуда, входит в соприкосновение с твёрдым веществом, при этом начинает выделяться газ. При закрытом кране давление газа вытесняет жидкость в воронку и реакция прекращается.
Зарядите прибор для получения углекислого газа, используя куски мрамора и 20%-ый раствор соляной кислоты.
Напишите уравнения реакции получения углекислого газа. Какими примесями он может быть загрязнён?

Рис. 2.6. Получение углекислого газа
