
§ 3. Электролиз
Электролизом называется процесс разложения вещества электрическим током с выделением продуктов разложения на электродах. Процессы электролиза подчиняются законам Фарадея:
1. Масса вещества, выделившаяся на электродах при электролизе, прямо пропорциональна количеству прошедшего через раствор электричества, т. е. силе тока и времени его прохождения:

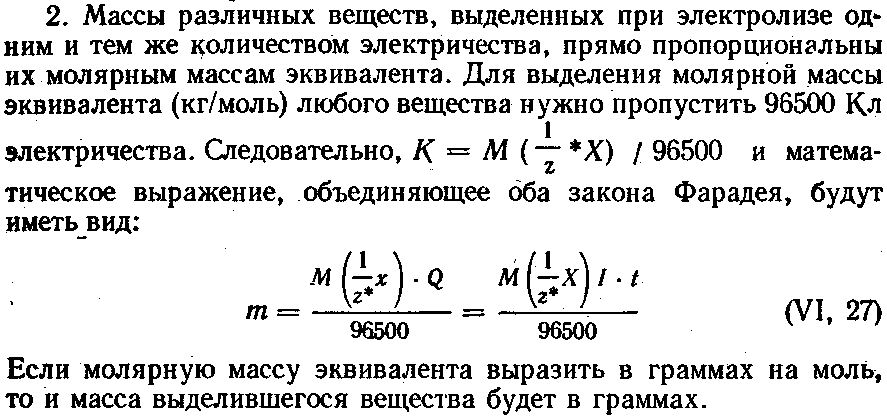
При проведении электролиза часть общего количества электричества может затрачиваться на побочные процессы и данного вещества выделится меньше, чем это соответствует всему количеству электричества, прошедшего через раствор. На практике приходится вычислять выход по току. Выходом по току называется отношение массы фактически выделенного при электролизе вещества к массе вещества, которое должно было бы выделиться согласно законам Фарадея. Выход по току η (эта) обычно выражается в процентах.
При электролизе происходит изменение концентрации раствора электролита у анода и катода не одинаково. Как указывалось в § 1, гл. VI, это обусловлено тем, что ионы движутся с различной скоростью. Измерение убыли вещества у катода и анода дает возможность определить числа переноса (уравнения VI, 14).
Примеры
1. При прохождении электрического тока через разбавленный раствор серной кислоты в течение 10 мин выделился водород объемом 100 см3 при 18 °С и давлении 100,6 кПа. Вычислить силу тока.

2. Ток силой в 2,1 А проходит через раствор хлорида меди (II) в течение 20 мин. Вычислить массу разложившегося хлорида меди.

3. При электролитическом получении магния в качестве электролита может служить расплавленный хлорид магния. Вычислить выход по току, если в ванне, работающей при силе тока 40 кА, в течение 5 ч выделился магний массой 72,6 кг.

4. При электролитическом восстановлении нитробензола в слабокислой среде со свинцовыми электродами получаем анилин. В процессе электролиза на свинцовом катоде образуется атомарный водород, являющийся активным восстановителем, и реакция выражается уравнением:
![]()
При получении анилина массой 1 кг средний выход по току составил 90%. Каков объем выделившегося водорода при 17 °С и давлении 100 кПа? Вычислить также, сколько энергии затрачивается нэ получение анилина массой 4 кг, если разность потенциалов между электродами равна 1,1 В?


§ 2. Электродные процессы. Гальванические элементы
Гальванический элемент, например элемент Якоби, схематически может быть изображен следующим образом:
Вертикальными линиями обозначены поверхности раздела, где возникают скачки потенциала. Электродвижущая сила (э. д. с.) гальванического элемента равна алгебраической сумме скачков потенциала:
Элемент будем записывать так, чтобы слева был отрицательный электрод; не будем записывать металл, на границе с которым возникает только контактный потенциал; если устранен диффузионный потенциал, между растворами ставить две черты:
Скачки потенциала отдельных электродов неопределенны. Можно определить лишь э. д. с. элемента. За электрод сравнения принят стандартный водородный электрод, потенциал которого считается равным нулю. Величину э. д. с. элемента, составленного из данного электрода и стандартного водородного электрода, называют электродным потенциалом этого электрода.
В процессе работы элемента Якоби на катоде будет растворяться цинк, а на аноде выделяться медь из раствора:
Примеры.
Так как диффузионный потенциал устранен, то э. д. с. элемента определяем из формулы (VI, 21а). Из таблицы 6 находим стандартные электродные потенциалы кобальта и серебра. Они равны соответственно — 0,277 В и 0,799В. Принимаем во внимание, что
серебро является положительным электродом, а кобальт — отрицательным и что активность ионов серебра:
3. Вычислить стандартный электродный потенциал брома, если э. д. с. Элемента
Такое большое значение константы равновесия указывает на то, что реакция между перманганатом калия и хлоридом олова (II) в кислой среде практически идет до конца.
Вопросы и упражнения
14. Что такое гальванический элемент? В каких местах и какие скачки потенциалов возникают в гальваническом элементе?
15. Как объяснить возникновение скачка потенциалов на границе металл/раствор?
16. Что такое электродный потенциал металла? От каких факторов зависит его величина? Напишите математическое выражение для величины электродного потенциала и поясните его.
17. Что такое диффузионный потенциал? Как объясняется его возникновение? Напишите математическое выражение для величины диффузионного потенциала и поясните его.
18. Что такое мембранный потенциал? Как он возникает и каково его биологическое значение?
19. Как вычисляется электродвижущая сила гальванического элемента? Почему при расчете часто пренебрегают диффузионным потенциалом? В каких случаях нельзя им пренебрегать? Как собирается гальванический элемент, чтобы диффузионный потенциал был устранен?
20. Напишите уравнения реакций, протекающих на электродах и в цепи в целом, для следующих гальванических элементов:
21. Составьте цепи, в которых идут следующие реакции:
Запишите уравнения процессов, протекающих на электродах.
22. Начертите схему прибора, применяемого для определения электродвижущей силы гальванического элемента, и поставьте стрелками направление тока. Выведите формулу, которая применяется для определения электродвижущей силы элемента.
23. Как устроен нормальный элемент? Какие реакции идут на электродах и во всей цепи? Для какой цели он применяется?
24. Что такое стандартный водородный электрод? Напишите, какая идет на нем реакция, если он является: а) положительным и б) отрицательным электродом в элементе. Для какой цели он применяется?
25. Что такое каломельный электрод? Напишите, какая идет на нем реакция, если он является: а) положительным и б) отрицательным электродом в элементе. Для какой цели он применяется?
26. Каковы устройство и работа хлоросеребряного электрода? Для какой цели он применяется?
27. Как на опыте определяются потенциалы отдельных электродов? Разберите на примерах.
28. Что такое электрохимический ряд напряжения металлов? Как он составляется?
29. Что такое концентрационная цепь? Разберите на примере. Какие процессы протекают на электродах? За счет какого процесса возникает ток в этом элементе? Для какой цели используются концентрационные элементы?
30. В чем сущность электрометрического метода определения рН?
31. Какие электроды применяются при определении рН электрометрическим методом? Напишите и поясните формулы, применяемые для определения величины рН.
32. Что такое хингидронный электрод? Какие процессы протекают в этом электроде? Почему он может применяться для определения рН?
33. Как устроен и работает стеклянный электрод? Для какой щели он применяется?
34. Какие электроды называются окислительно-восстановительными? Приведите примеры. Напишите и поясните математические выражения для потенциала окислительно-восстановительного электрода. I
35. Напишите уравнения реакций, протекающих на электродах и во всей цепи в следующих гальванических элементах:
36. Что такое коррозии металлов? В чем состоит сущность Электрохимической коррозии металлов? Поясните на примере.
37. Изложите основные методы защиты металлов от коррозии.
Задачи.
26. Напишите уравнения и вычислите потенциалы следующих электродов:
27. Вычислите, насколько изменится электродный потенциал меди, погруженной в раствор СuSО4 моляльностью 1 моль/кг, если раcтвор разбавить в 10 раз, считая: а) что коэффициент активности Cu2+ не изменится при разбавлении, б) что в исходном и разбавлeнном растворах средние коэффициенты активности Сu2+ равны соответственно 0,423 и 0,150, I = 25 °С.
28. Потенциал кадмиевого электрода в растворе b (Сd(NО3)2 / H2O) = 0,1 моль/кг при 25 °С равен -0,441 В. Средний коэффициент активности Сd2+ равен 0,516. Вычислите стандартный электродный потенциал кадмия и найденную величину сравните с табличной.
29. При 25 °С электродный потенциал серебра, погруженного в раствор b (АgNO3/Н2О) = 0,2 моль/кг равен 0,747 В. Средний коэффициент активности Аg+γ = 0,657. Вычислите стандартный электродный потенциал серебряного электрода и полученную величину сравните с табличной.
30. Потенциал никелевого электрода в растворе сульфата, никеля при 25 °С равен -0,275 В. Вычислите активность ионов никеля в растворе.

