- •III. Сопряженные системы с замкнутой цепью
- •1. Строение бензола
- •Современная теория строения бензола
- •Понятие ароматичности
- •Изомерия производных бензола
- •Полизамещенные производные бензола
- •2. Общий механизм реакций электрофильного замещения в
- •3. Влияние природы заместителей на направление реакций электрофильного замещения в бензольном кольце Ориентация замещения
- •Электроноакцепторные заместители
- •4. Ароматичность гетероциклических соединений
- •5. Основные термины.
- •6. Эталонное решение задач
- •Решение
- •Эталонное решение задач второго типа
- •Решение
- •Решение
- •Пространственное строение органических
- •Виды изомерии
- •Классификация изомеров.
- •2. Конформационная изомерия
- •Конформации циклических соединений
- •2. Конфигурационная изомерия
- •Проекционные формулы э. Фишера
- •Правила пользования проекционными формулами Фишера
- •4. Пространственное строение молекул и их биологическая активность
- •5. Основные термины.
- •6. Эталонное решение задач эталонное решение задач первого типа
- •Решение.
- •Эталонное решение задач второго типа
- •V. Углеводороды
- •Классификация углеводородов Углеводороды
- •1. Алканы Химические свойства (Sr-реакции)
- •Радикальное замещение у sp3 -гибридизованного атома углерода (sr - реакции)
- •Галогенирование высших алканов
- •Реакции окисления
- •2. Химические свойства циклоалканов
- •3. Электрофильное присоединение к алкенам и циклоалкенам (ае - реакции)
- •Какие экспериментальные данные могут служить доказательством такого механизма?
- •Присоединение водородсодержащих соединений к несимметричным алкенам
- •Реакции электрофильного присоединения против правила Марковникова
- •4. Электрофильное присоединение к диеновым
- •Реакции присоединения к 1,3 – бутадиену
- •Радикальное присоединение и электрофильное
- •5.1 Реакции присоединения (аr - реакции)
- •5.2 Реакции электрофильного замещения (se - реакции)
- •Химические свойства толуола
- •Нафталин в живом организме
- •6. Основные термины
- •7. Эталонное решение задач
- •Решение
- •1. Напишите реакции взаимодействия хлора с пропеном:
- •Решение
- •2. Присоедините бромоводород к следующим алкенам:
- •Решение
- •Решение
- •Решение
- •Эталонное решение задач третьего типа
- •Решение
- •Решение
- •Решение
- •Решение
- •Литература
- •Дополнительная.
Реакции электрофильного присоединения против правила Марковникова
Подобное присоединение наблюдается в тех случаях, когда при двойной связи данного ненасыщенного соединения содержатся сильные электроноакцепторные группы. Например, реакции присоединения водородсодержащих соединений к α,β - ненасыщенным альдегидам и кислотам протекают согласно схеме:

Рассмотрим механизм этих реакций на примере реакции присоединения соляной кислоты к акролеину. За счёт сильного электроноакцепторного влияния карбонильной группы двойная связь смещается и некоторый отрицательный заряд появляется на втором атоме углерода, на третьем же атоме углерода образуется недостаток электронной плотности.

Ион Н+ в соответствии с таким распределением электронной плотности должен атаковать второй атом углерода, возникнет следующий карбокатион, (катион I)
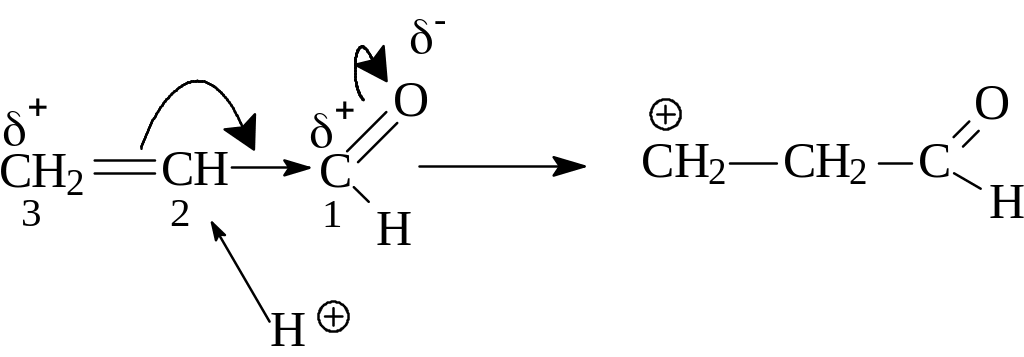
карбокатион I
Если ион Н+ присоединится к третьему атому углерода, несмотря на то, что там есть недостаток электронной плотности, возникнет карбокатион II

карбокатион II
Так как электроноакцепторная карбонильная группа находится рядом с атомом углерода, несущим положительный заряд, она будет дестабилизировать карбокатион II. Но карбонильная группа не влияет на дестабилизацию карбокатиона I, поскольку она удалена от положительного центра. Следовательно, карбокатион I более устойчив, и он подвергается атаке нуклеофилом.
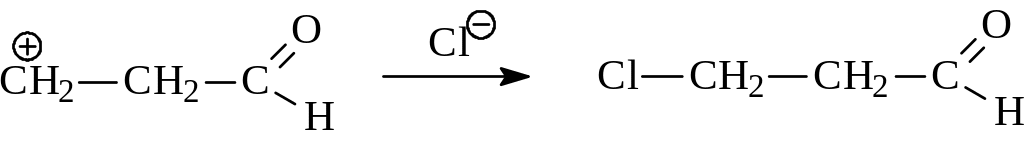
Таким образом, хотя присоединение формально идёт против правила Марковникова, фактически оно следует этому правилу в его обобщенной современной формулировке: присоединение протона приводит к образованию стабильного карбокатиона.
4. Электрофильное присоединение к диеновым
углеводородам с сопряжённой системой связей
Сопряжённые системы двойных связей - это системы, в которых чередуются двойные и одинарные связи.
Простейшая молекула, содержащая две сопряжённые двойные связи - бутадиен-1,3.
В молекуле бутадиена, как известно, имеется единое электронное облако, охватывающее все четыре атома углерода. Такое строение связей в молекуле бутадиена и определяет его химическую природу.
Реакции присоединения к 1,3 – бутадиену

1,4-дибромбутен-2 называют продуктом 1,4 - присоединения, а 3,4- дибромбутен-1 - продуктом 1,2 - присоединения.
Аналогично присоединяются и водородсодержащие соединения

Рассмотрим механизм этих реакций: электрофил не может присоединиться ко второму атому углерода, так как в этом случае получится карбокатион , в котором нет возможности делокализо-вать заряд, поскольку π-электроны двойной связи удалены от свободной р - орбитали первого атома углерода.
![]()
В результате присоединения протона к первому атому углерода образуется карбокатион аллильного типа.
![]()
Этот катион далее может быть стабилизирован за счёт взаимодействия электронов двойной связи со свободной р-орбиталью второго атома углерода.
![]()
В результате такого смещения электронной плотности образуется более устойчивая структура, в которой положительный заряд уже не локализован на одном атоме углерода, а рассредоточен между вторым и четвёртым атомами. На следующей стадии этого процесса нуклеофил может атаковать как второй, так и четвёртый атомы углерода. Атаковать четвёртый атом углерода пространственно удобнее.
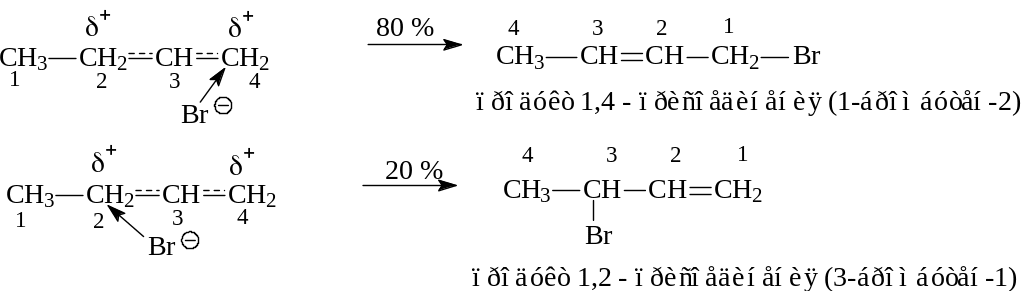
Однако, несмотря на то, что атака нуклеофилом, приводящая к образованию продукта 1,4-присоединения, пространственно выгоднее, соотношение продуктов 1,2- и 1,4 -присоединения в значительной степени зависит от условий процесса. При низких температурах (около - 800С) 1,2-продукта значительно больше.
Удовлетворительное объяснение такому соотношению продуктов 1,2- и 1,4- присоединения, в зависимости от условий реакций, может дать только детальное изучение кинетики, термодинамики и стереохимии этих процессов, что, естественно, не является целью нашего курса.
Электрофильное присоединение к несимметричным диеновым
углеводородам
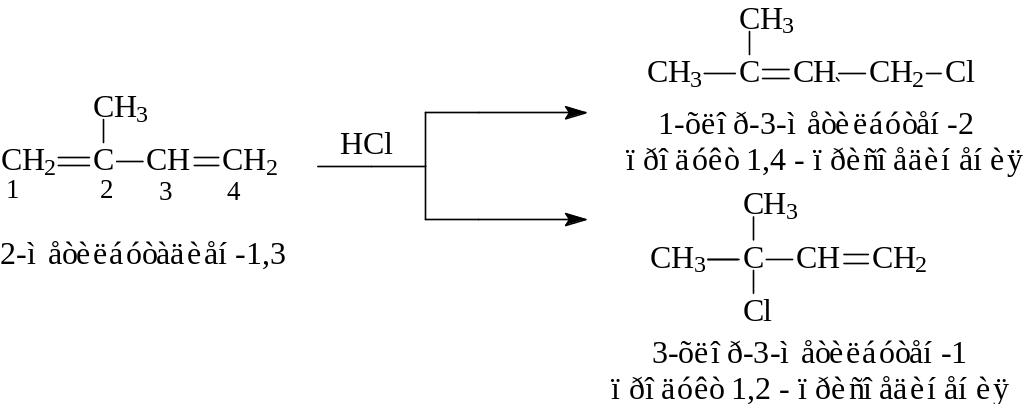
Если диеновый углеводород несимметричен, направление первоначальной электрофильной атаки определяется правилом Марковникова, т.е. первая стадия реакции должна приводить к наиболее стабильному карбокатиону. Рассмотрим, например, присоединение бромистого водорода к 2-метилбутадиену-1,3.
Начальная атака протона может протекать либо по С1, приводя к карбокатиону I, либо по С4, приводя к карбокатиону II.
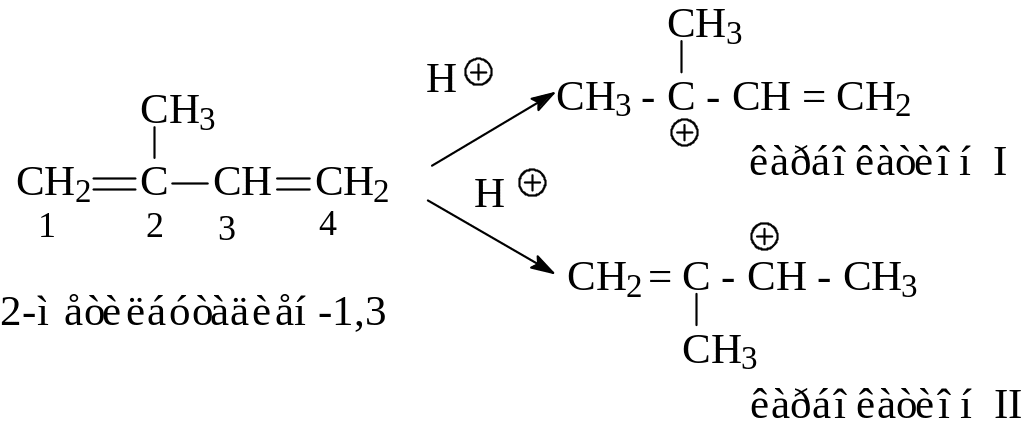
Карбокатион I стабильнее, чем карбокатион II, так как является третичным катионом. Поэтому 2-метилбутадиен-1,3 должен протонироваться по С1 быстрее, чем по С4