
- •III. Сопряженные системы с замкнутой цепью
- •1. Строение бензола
- •Современная теория строения бензола
- •Понятие ароматичности
- •Изомерия производных бензола
- •Полизамещенные производные бензола
- •2. Общий механизм реакций электрофильного замещения в
- •3. Влияние природы заместителей на направление реакций электрофильного замещения в бензольном кольце Ориентация замещения
- •Электроноакцепторные заместители
- •4. Ароматичность гетероциклических соединений
- •5. Основные термины.
- •6. Эталонное решение задач
- •Решение
- •Эталонное решение задач второго типа
- •Решение
- •Решение
- •Пространственное строение органических
- •Виды изомерии
- •Классификация изомеров.
- •2. Конформационная изомерия
- •Конформации циклических соединений
- •2. Конфигурационная изомерия
- •Проекционные формулы э. Фишера
- •Правила пользования проекционными формулами Фишера
- •4. Пространственное строение молекул и их биологическая активность
- •5. Основные термины.
- •6. Эталонное решение задач эталонное решение задач первого типа
- •Решение.
- •Эталонное решение задач второго типа
- •V. Углеводороды
- •Классификация углеводородов Углеводороды
- •1. Алканы Химические свойства (Sr-реакции)
- •Радикальное замещение у sp3 -гибридизованного атома углерода (sr - реакции)
- •Галогенирование высших алканов
- •Реакции окисления
- •2. Химические свойства циклоалканов
- •3. Электрофильное присоединение к алкенам и циклоалкенам (ае - реакции)
- •Какие экспериментальные данные могут служить доказательством такого механизма?
- •Присоединение водородсодержащих соединений к несимметричным алкенам
- •Реакции электрофильного присоединения против правила Марковникова
- •4. Электрофильное присоединение к диеновым
- •Реакции присоединения к 1,3 – бутадиену
- •Радикальное присоединение и электрофильное
- •5.1 Реакции присоединения (аr - реакции)
- •5.2 Реакции электрофильного замещения (se - реакции)
- •Химические свойства толуола
- •Нафталин в живом организме
- •6. Основные термины
- •7. Эталонное решение задач
- •Решение
- •1. Напишите реакции взаимодействия хлора с пропеном:
- •Решение
- •2. Присоедините бромоводород к следующим алкенам:
- •Решение
- •Решение
- •Решение
- •Эталонное решение задач третьего типа
- •Решение
- •Решение
- •Решение
- •Решение
- •Литература
- •Дополнительная.
4. Пространственное строение молекул и их биологическая активность
Прежде чем мы рассмотрим вопрос о связи пространственного строения молекул с их активностью в различных процессах, протекающих в живом организме, попытаемся ответить на другой вопрос: почему у энантиомеров одинаковые химические свойства?
Энантиомеры – это прежде всего изомеры, т.е. их качественный и количественный состав одинаковый, одинаковый порядок связей. Отличаются они только расположением в пространстве групп у асимметрического центра. Если реагент подходит к реакционному центру одного и другого энантиомера, то в обоих случаях он встречает одинаковое окружение, если только не учитывать того факта, что одно окружение является зеркальным отражением другого. Это не будет влиять на химический процесс в том случае, если реагент оптически недеятелен.
Когда атакующий реагент оптически активен, энантиомеры оказывают на него разное влияние, и скорость реакций с этими зеркальными антиподами иногда различна настолько, что реакция с одним из энантиомеров практически не осуществляется совсем.
В биологических системах такая стереоспецифичность является правилом, а не исключением, поскольку все важные
катализаторы биохимических процессов (ферменты) и большинство соединений, получаемых с их помощью, оптически активны.
Все ферменты имеют белковую природу и построены из L-аминокислот. Первые сведения о стереоспецифичности ферментов были получены в 1858 году Пастером при изучении действия зелёной плесени на рацемическую винную кислоту. Оказалось, что из двух изомеров этой кислоты расщепляется правовращающий изомер, а левовращающий накапливается.
Значительно позже (начиная с 1894 года) большую работу, связанную с вопросом специфичности действия ферментов, провел Фишер, который показал, что каталитическое действие ферментов строго стереоспецифично. Впоследствии строгую специфичность ферментов стали понимать так - каждый фермент соответствует строго определённому субстрату как «ключ к отпираемому замку».
В отличие от классических химических синтезов, где всегда получаются оптически недеятельные продукты- рацематы, реакции ферментативного синтеза приводят к образованию строго определённых стереоизомеров.
Так, например, из углекислого газа и воды (при фотосинтезе) образуется D-глюкоза.
Из молочной кислоты в организме животных образуется тоже только D-глюкоза. L-глюкоза не является продуктом метаболизма.
В растениях синтезируются аминокислоты L-ряда. В животных организмах из α-кетокислот и аммиака синтезируются также аминокислоты только L- ряда .
Всё это позволяет говорить о том, что ферментативные синтезы относятся к стереоспецифическим и приводят к образованию определённых стереоизомеров.
Важным аспектом стереоспецифичности биологических процессов является вопрос о взаимодействии лекарственных препаратов с рецепторами клетки. Это взаимодействие протекает наиболее полно в том случае, когда молекула лекарственного вещества имеет такую конфигурацию, которая позволяет ей наиболее полно связываться с рецепторами клетки.
4. ЦИС-ТРАНС-ИЗОМЕРИЯ (π-ДИАСТЕРЕОМЕРЫ)
Это вид стереоизомерии, связанный с различным расположением одинаковых заместителей у соседних sp2–гибридизованных атомов углерода.
Если два одинаковых заместителя (или два атома водорода) расположены по одну сторону двойной связи - это цис-изомер, если по разные стороны – транс-изомер, например:

цис-пентен- 2 транс-пентен-2
Отсутствие вращения вокруг двойных связей – главная причина появления такого вида изомерии, так как конфигурация алкена становится устойчиво плоской. Цис-транс-изомеры не содержат асимметрического атома углерода, следовательно их молекулы ахиральны. Однако эти изомеры в пространстве несовместимы, значит они стереоизомеры, но т.к. они не являются зеркальным отражением друг друга, то это не энантиомеры, а диастереомеры.
Цис-изомеры (вследствие пространственной близости заместителей) более богаты энергией и имеют более низкие температуры кипения и плавления. Цис-изомеры менее устойчивы, поэтому в природе более распространены транс-изомеры. Например, в растениях содержится транс-бутен-2-диовая кислота (фумаровая), цис-изомер – малеиновая кислота в природных соединениях не встречается.

транс- изомер цис-изомер
фумаровая кислота малеиновая кислота
Как все диастереомеры, цис – и транс-изомеры имеют разные химические свойства. Так, например, малеиновая кислота,
карбоксильные группы которой пространственно сближены, может отщеплять молекулу воды и образовывать малеиновый ангидрид.
Фумаровая кислота ангидрида не образует.
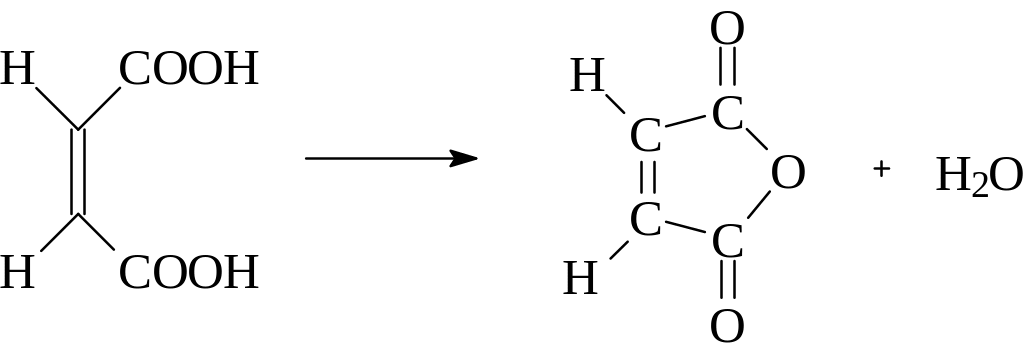
малеиновая кислота малеиновый ангидрид
Цис- и транс-изомеры могут переходить друг в друга. Более богатые энергией цис-изомеры переходят в транс-изомеры. Обычно это происходит при действии радикальных, а иногда и электрофильных реагентов. Например, олеиновая кислота (цис-изомер) под действием оксида азота (II), имеющего неспаренный электрон, переходит в элаидиновую кислоту (транс-изомер).
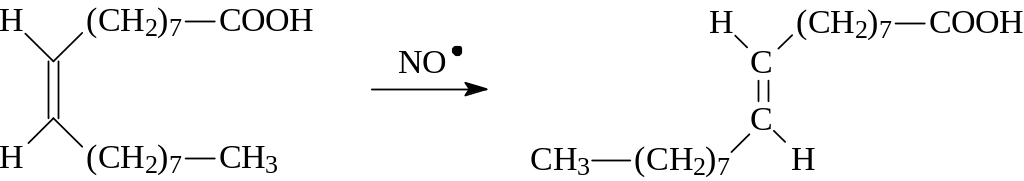
олеиновая кислота элаидиновая кислота.
цис- изомер транс- изомер
Транс-изомер может перейти в цис-форму, но для этого требуется дополнительная энергия (как правило, в виде облучения ультрафиолетом).
π-Диастереомерия встречается и в природных сопряжённых полиеновых соединениях, таких как, например, β-каротин и витамин А.
В молекуле витамина А содержится несколько двойных связей и относительно каждой из них метильные радикалы находятся в транс- положении.
