
ФІЗИКО-ХІМІЧНІ МЕХАНІЗМИ ВИНИКНЕННЯ
МЕМБРАННОГО ПОТЕНЦІАЛУ
Вибіркова іонна проникність клітинних мембран
Перед тим, як перейти до розгляду сучасних уявлень про природу електричної активності клітин, необхідно коротко зупинитися на особливостях взаємодії іонів з молекулами води. Через те, що молекула води є диполем, у розчинах електролітів на взаємодію її молекул з розчиненою речовиною накладається електричне поле. Якщо припустити, що діелектрична проникність води поблизу іона дорівнює 80, то напруженість поля на відстані 0,6 нм від центру одновалентного іона становить 0,5 • 106 В/см. За реальних умов напруженість поля, що діє на перший прошарок молекул води, є принаймні на порядок більшою, тому що при розрахунку енергії взаємодії іона з молекулами води, розташованими безпосередньо біля нього, не можна використовувати макроскопічну діелектричну проникність. На рис. 8.1 схематично зображено гідратований іон Rb+. Гідратовані іони лужних металів обмінюють молекули води приблизно 109 разів за секунду.
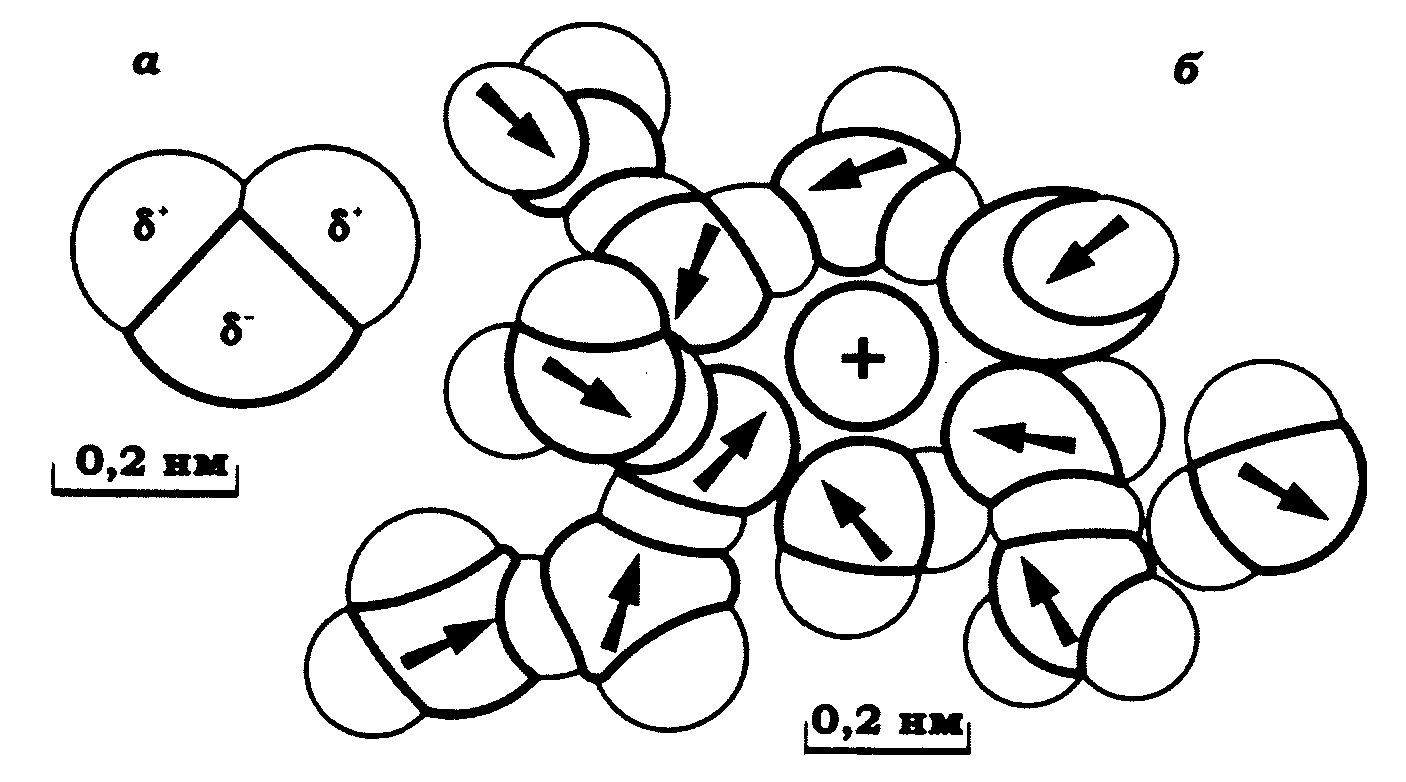
Рис. 8.1. Молекули води й гідратація іона (Б. Хілле, 1984):
а – молекула води з позначеними зарядами атомів водню δ+ і зарядом кисню δ–;
б – гіпотетична структура гідратованого іона Rb+.
Стрілки показують напрямок дипольного моменту молекул води; показано водневі зв'язки між сусідніми молекулами води
Енергія гідратації за однакового заряду іонів залежить від їхніх кристалічних радіусів. Кристалічні радіуси іонів було визначено за методом дифракції рентгенівських променів на кристалах. У різних авторів вони дещо відрізняються. При розгляді гідратації часто використовують радіуси Полінга.
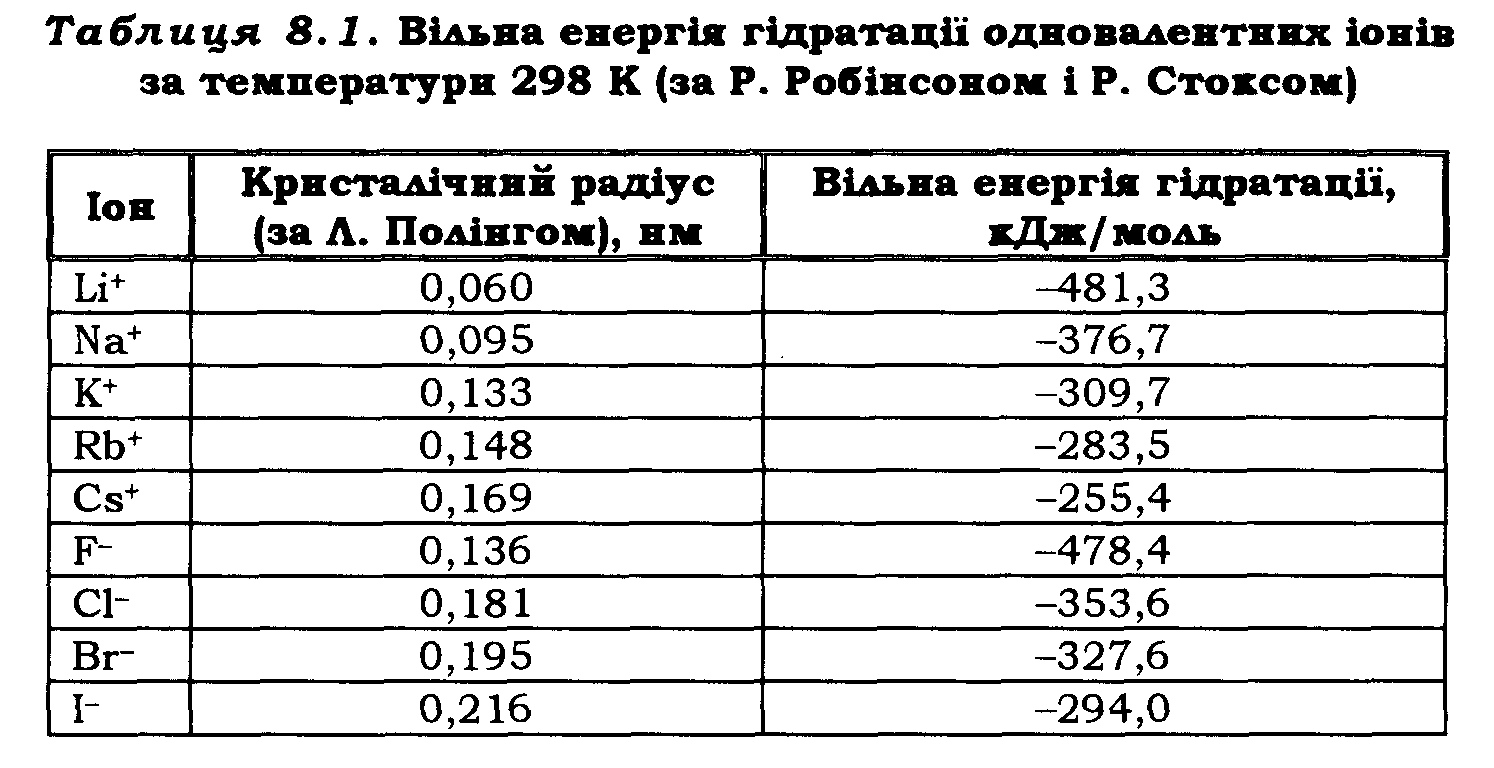
У табл. 8.1 наведено радіуси одновалентних іонів за Полінгом і вільну енергію гідратації. Енергія гідратації для галогенів є значнішою, ніж для катіонів приблизно такого самого радіуса. Рухомість іонів у водних розчинах залежить від їхніх ефективних радіусів у гідратованому стані. Іон з меншим радіусом у гідратованому стані є більше рухомим. Оцінюючи ефективні радіуси гідратованих іонів, нерідко використовують розрахунки за формулою Стокса – Ейнштейна:
kT
r = ——— , (8.1)
6πDη
де r – радіус; k – стала Больцмана; Т – абсолютна температура; D – коефіцієнт дифузії; η – в'язкість води. Результати розрахунків за цією формулою є приблизними.
Нині, вивчаючи іонну вибірковість, нерідко використовують електростатичну теорію Ейзенмана. Для пояснення фізико-хімічних механізмів, що лежать в основі вибірковості катіонселективних скляних електродів, Ейзенман розглянув енергетику іонного обміну. У цій моделі для розрахунку зміни вільної енергії застосовувалися електростатична енергія взаємодії катіона з негативно зарядженою (аніонною) групою у склі та енергія гідратації катіонів. Аніонна група розглядалася як сферична. Енергія взаємодії U негідратованого катіона з аніонною групою є обернено пропорційною сумі радіусів аніонної групи rA і катіона rC:
zA zCe2N0
U = —————— , (8.2)
4πεε0(rA + rC)
де zA і zC – валентність аніонної групи й катіона, відповідно; е – елементарний заряд; N0 – число Авогадро; ε – діелектрична проникність скла; ε0 = 8,85 • 10–12 Кл • В–1 • м–1.
Якщо значення rA є досить великим, то аніонні групи створюють слабке електричне поле й величина U буде малою для всіх катіонів. У процесі іонообміну домінуватиме енергія, необхідна для дегідратації. З п'яти іонів лужних металів "великий" іон цезію має найбільшу перевагу, тому що він дегідратується легше порівняно з іншими. Послідовність вибірковості реакції іонообміну відповідатиме першому ряду Ейзенмана і, по суті, – послідовності рухомість гідратованих іонів у водному розчині. Інший випадок, коли значення rA є малим. Аніонне угруповання в цьому разі створює сильне електричне поле, й катіони з меншим кристалічним радіусом мають перевагу. Послідовність вибірковості реакції іонообміну відповідає 11-му ряду Ейзенмана. Для проміжних випадків є дев'ять послідовностей вибірковості.
Таким чином, теорія Ейзенмана передбачає 11 послідовностей вибірковості для п'яти іонів лужних металів:
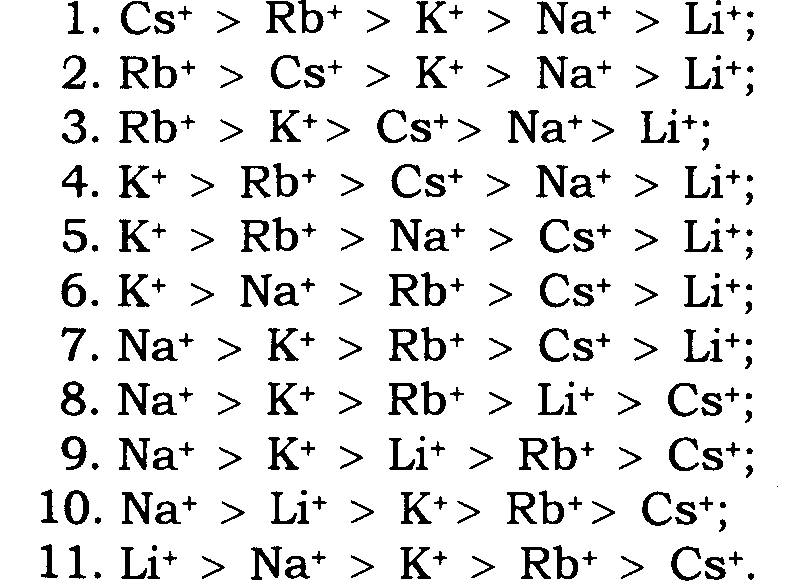
Для характеристики іонної вибірковості плазматичних мембран нерідко використовують коефіцієнти проникності, отримані при розрахунках, що ґрунтуються на теорії постійного поля Гольдмана – Ходжкіна – Катца, а також розрахунки провідності мембрани для різних іонів.
Певні припущення відносно молекулярної структури селективного фільтру потенціалкерованих натрієвих каналів зробив Б. Хілле. Встановлення тривимірної структури калієвого каналу бактеріалної клітини на підставі рентгеноструктурного аналізу (Р. Мак-Кіннон, 1998) дозволило дійти висновку щодо молекулярних основ його провідності й вибірковості.
Мембранний потенціал
Між обома поверхнями плазматичної мембрани клітини підтримується різниця електричних потенціалів – мембранний потенціал. У стані спокою електричний потенціал цитоплазми φі, є негативним відносно електричного потенціалу зовнішнього середовища клітини φо. Мембранний потенціал вимірюють як φі – φо. У стані спокою мембранний потенціал (потенціал спокою) є негативною величиною, що становить у різних клітинах від -30 до -100 мВ. Так, потенціал спокою мієлінізованого нервового волокна дорівнює -70 мВ.
У 1902 р. Ю. Бернштейн висунув першу обґрунтовану гіпотезу щодо походження потенціалу спокою в нервових і м'язових волокнах. З результатів хімічного аналізу було відомо, що протоплазма нервових і м'язових волокон має високу концентрацію калію й що у клітині є аніони, для яких клітинна мембрана у стані спокою є непроникною. Наявні на той час дані надали можливість вважати, що у стані спокою мембрана є проникною для іонів калію. Тому Бернштейн припустив, що мембранний потенціал виникає внаслідок нерівномірного розподілу іонів калію й може бути розрахований при використанні рівняння Нернста:
RT [К+]о
ЕК = —— ln ——— , (8.3)
F [К+]і
де ЕК – калієвий рівноважний потенціал, тобто така трансмембранна різниця потенціалів, за якої немає домінуючого переходу іонів калію через мембрану в тому або іншому напрямку й система перебуває в рівновазі; [К+]о і [К+]і – концентрація калію зовні та всередині клітини, відповідно; R – газова стала; Т – абсолютна температура; F – число Фарадея.
За фізіологічних значень [К+]о і [К+]і ЕК<0. Бернштейн не мав змоги експериментальне перевірити власну гіпотезу, тому що на той час не було методів точного визначення трансмембранного потенціалу. Для прямого вимірювання мембранного потенціалу потрібно було помістити електроди з обох боків мембрани – один всередині клітини, а другий – зовні. Пряме вимірювання мембранного потенціалу було вперше здійснено на гігантському аксоні кальмара (А. Ходжкін, Е. Хакслі, 1939; X. Кертіс, К. Коул, 1942).
Пізніше Дж. Грем і Р. Джерард (1946) розробили метод виготовлення скляних капілярних мікроелектродів з діаметром кінчика менше 1 мкм. Кінчик такого електрода є настільки тонким, що його можна вводити в різноманітні клітини без суттєвого їх ушкодження. Скляний капіляр заповнюють концентрованим сольовим розчином (частіше за все хлоридом калію концентрацією 3 моль/л), що забезпечує електропровідність, і з'єднують з підсилювачем за допомогою металевих електродів (зазвичай із хлорованого срібного дроту), які не поляризуються. На рис. 8.2. наведено схему вимірювання мембранного потенціалу за допомогою скляних електродів.

Рис. 8.2. Схема вимірювання мембранного потенціалу скляним електродом:
1 – сольові містки на агарі; 2 – скляний електрод; 3 – розчин Рінгера; 4 – досліджувана клітина
Для перевірки гіпотези Бернштейна слід було з'ясувати, яким чином впливає на мембранний потенціал співвідношення концентрацій калію зовні й усередині клітини. За рівнянням Нернста, при збільшенні чи зменшенні зовнішньої або внутрішньої концентрації калію в 10 разів мембранний потенціал змішується на 58 мВ за температур, близьких до 20 °С. На рис. 8.3 наведено графік залежності мембранного потенціалу аксона кальмара від логарифма зовнішньої концентрації калію. Точки, отримані в експерименті, збігаються з результатами розрахунків тільки за умови досить високих зовнішніх концентрацій калію.
Якщо потенціал спокою дійсно зумовлено трансмембранним градієнтом концентрації калію, то доцільна перевірка могла б полягати й у зміні внутрішньоклітинної концентрації калію. Такий експеримент було успішно здійснено на гігантському аксоні кальмара П. Бейкером, А. Ходжкіним і Т. Шоу. Товщина гігантського аксона є достатньою для того, щоб можна було видавити з нього аксоплазму й за допомогою канюлі заповнити його потрібним штучним розчином, істотно не порушуючи властивостей поверхневої мембрани (рис. 8.4).
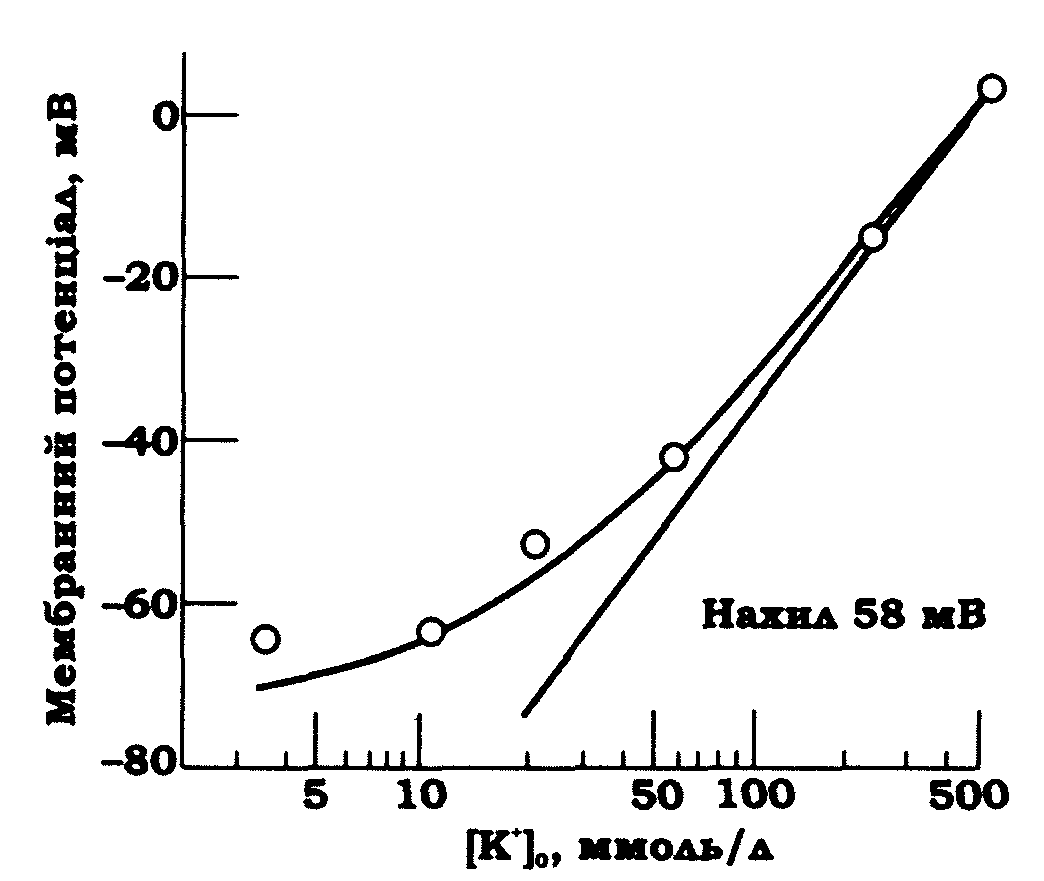
Рис. 8.3. Залежність мембранного потенціалу аксона кальмара від позаклітинної концентрації іонів калію (вісь абсцис – концентрація калію в логарифмічному масштабі); точками позначено результати вимірювання; наведено залежність, розраховану за рівнянням Нернста
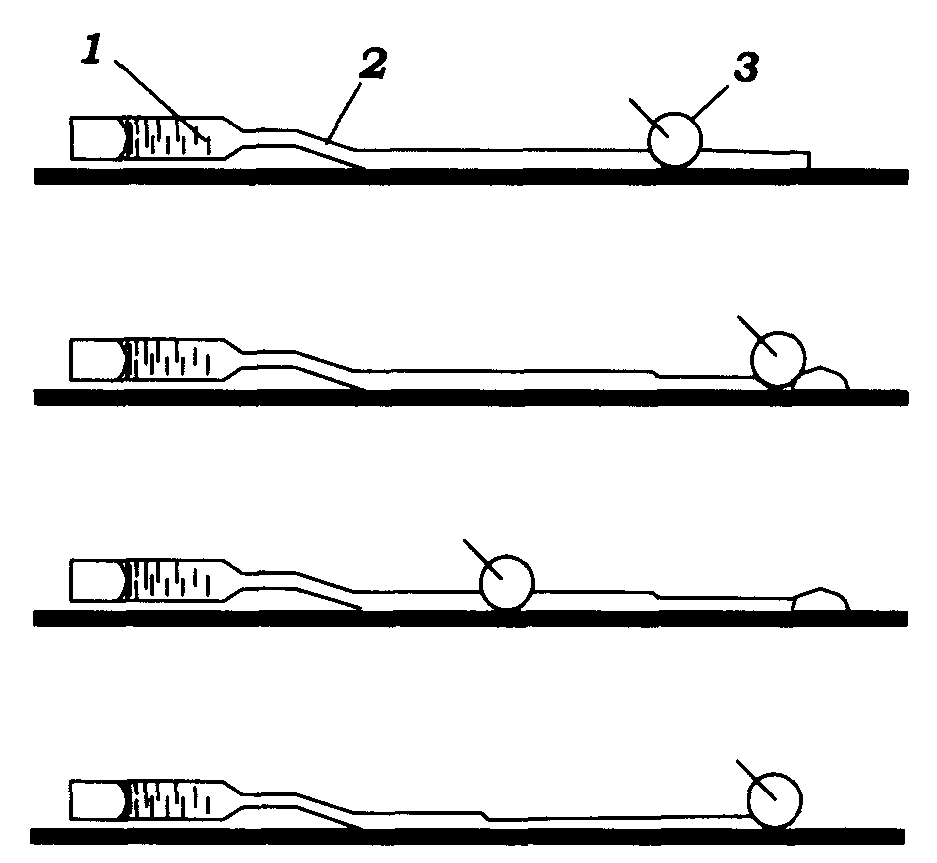
Рис. 8.4. Схема видалення аксоплазми з гігантського аксона кальмара для наступного його заповнення піпетковим розчином (А. Ходжкін, 1964):
1 – піпетка, заповнена відповідним розчином; 2 – аксон; 3 – гумовий валик
За умови нормальної концентрації калію у внутрішньоклітинному розчині такі аксони в разі подразнення продовжували генерувати багато тисяч нервових імпульсів, якщо мембрана не була ушкодженою.
На таких перфузованих аксонах було вивчено вплив різноманітних внутрішньоклітинних концентрацій калію, й отримані результати відповідали рівнянню Нернста в певних межах змін концентрації. Наприклад, за високої зовнішньої концентрації калію (540 ммоль/л) і низької внутрішньої (100 ммоль/л) (інакше кажучи, коли співвідношення [К+]о/[К+]і дорівнює 5,4 : 1 замість 1 : 20) мембранний потенціал змінює свій знак – зовнішній поверхня мембрани стає електронегативним відносно внутрішнього. Рівняння Нернста передбачає, що за однакових зовнішньої та внутрішньої концентрації калію мембранний потенціал дорівнюватиме нулю. Дослідами доведено, що мембранний потенціал спокою дійсно зникає за цих умов (в діапазоні від 10 до 540 ммоль/л).
