
- •Введение
- •3. Метод реакционной или изотермической микро- калориметрии.
- •4. Дифференциальная сканирующая микрокалори-метрия
- •Энтропию перехода рассчитывают по уравнению
- •5. Дифференциальные адиабатные сканирующие микрокалориметры
- •6. Калориметрические измерения
- •Вопросы и задания к практической работе.
- •Библиографический список
3. Метод реакционной или изотермической микро- калориметрии.
Метод реакционной микрокалориметрии используют главным образом для определения тепловых эффектов взаимодействия различных соединений при постоянной температуре и для изучения кинетики реакций или процессов. В связи с этим техника реакционной микрокалориметрии отличается целым рядом специфических особенностей. Кроме необходимости обеспечения высокой чувствительности большие сложности обусловлены проблемой старта - началом химической реакции или процесса. Как правило старт осуществляют путем смешивания компонентов реакций. Схематично процесс представляют следующим образом:
термостатирование реагентов;
приведение реагентов в прямой контакт и
перемешивание системы.
Обычно смесители работают по трем основным принципам:
1) механическое разрушение перегородки (обычно стеклянной); 2)пространственное перемещение перегородки и 3) изменение положения компонентов в системе (переворачивание).
Основные сложности при смешивании в калориметрах состоят в том, что любая работа по смешиванию переходит в теплоту. Кроме того, значительные тепловые эффекты могут возникать за счет испарения растворителя, обусловленного небольшими изменениями суммарного объема жидкой фазы и давления в калориметрической кювете. В последнее время в биологических исследованиях находят все большее применение смесители (кюветы) проточного типа. Принцип действия проточных калориметров состоит в непрерывном перемешивании двух потоков содержащих реагенты, и измерении разницы температур растворов до и после перемешивания. Растворы попадают в микрокалориметр прецизионными насосами, чрезвычайно высокая стабильность работы которых обеспечивает высокую чувствительность приборов, работающих обычно в дифференциальном режиме.
Для нахождения термодинамических параметров исследуемой реакции предложено множество способов разной степени сложности. Один из наиболее простых и широко применяемых способов используют для расчета реакции образования комплекса с участием водородных связей между белком Е и произвольным агентом А, образующим с белком комп-лекс в соотношении 1:1 :
![]()
Измерение тепловых эффектов процесса при постоянной концентрации белка и изменяющейся концентрации агента позволяет получить концентрационную зависимость теплового эффекта реакции (смотри рис.1)

Рис. 1. Зависимость теплового эффекта реакции ( Q) от концентрации произвольного реагента (А), образующего с белком комплекс в соотношении 1:1.
Пренебрегая
изменением концентрации А
за счет образования комплекса (![]() значительно
превышает [E]),
концентрацию белка в системе представляют
как:
значительно
превышает [E]),
концентрацию белка в системе представляют
как:
[е] = [Е A] / (k [A] + [ЕA]),
где
k
-
константа равновесия. Полагают, что
тепловой эффект
Q
взаимодействия прямо связан с
концентрацией образующегося
комплекса:
Q
=
![]() ,
где
Н°-
стандартная энтальпия реакции.
Разделив первое уравнение на второе,
получают уравнение
,
где
Н°-
стандартная энтальпия реакции.
Разделив первое уравнение на второе,
получают уравнение
![]() (
1 )
(
1 )
Из уравнения (1) определяют k и Н° графическим путем, если экспериментальную зависимость Q от [А] представить в координатах ([E]/ Q) ; ( 1/[А]) (см. Рис. 2)
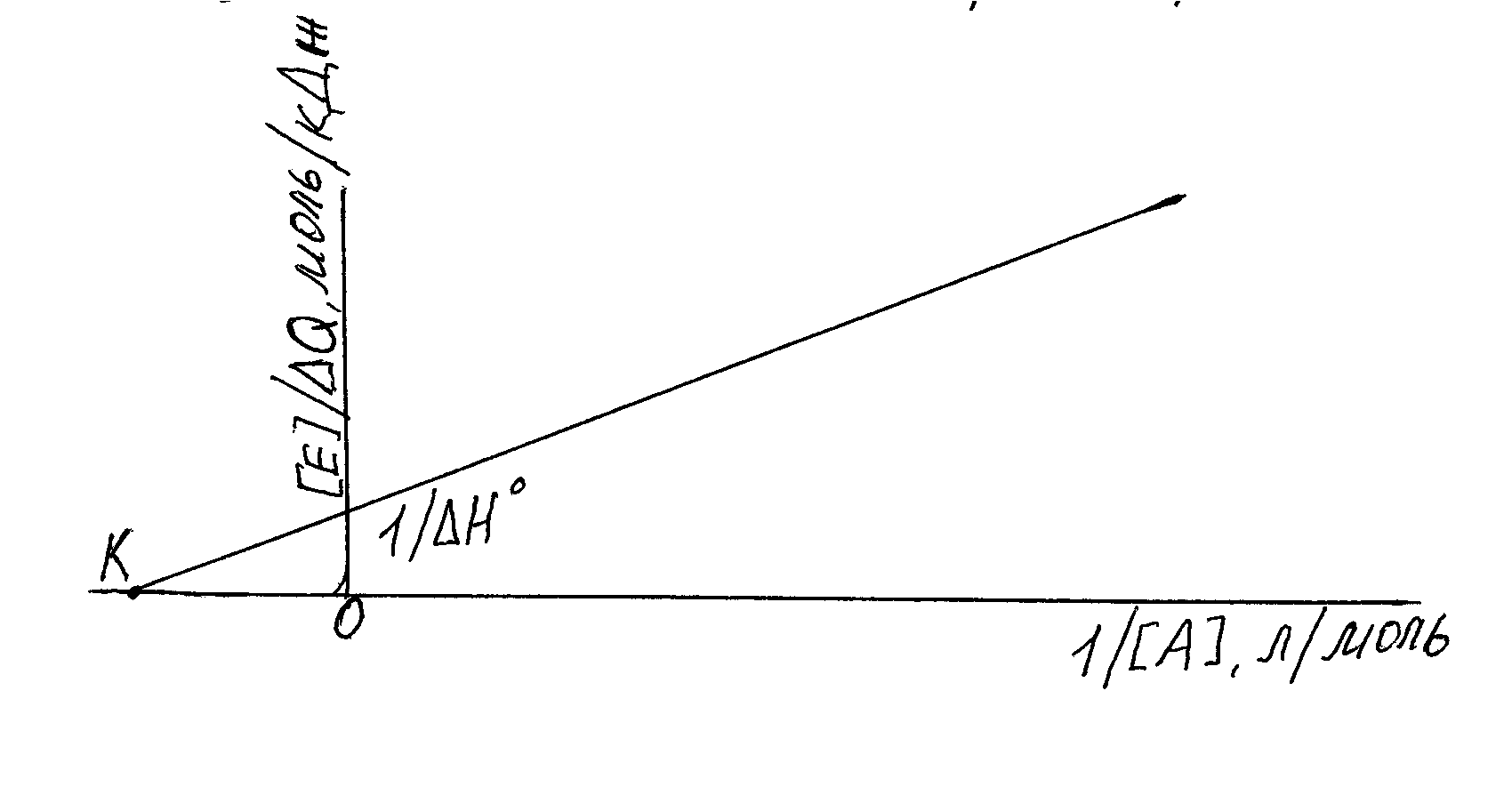
Рис.2
Изменение
свободной энергии
G![]() и
энтропии
S
реакции
рассчитывают из уравнений
и
энтропии
S
реакции
рассчитывают из уравнений
![]()
![]() (
2 )
(
2 )
Даже в самом простом случае строгая интерпретация полученных данных требует осторожности.Как правило, неизвестно, происходит ли самая простая реакция комплексообразования в одну стадию. Суммирование тепловых эффектов разных стадий может привести к явлению частичной тепловой компенсации. Более того, в образовании теплового эффекта кроме непосредственно реакций образования комплекса, т.е. суммы тепловых эффектов образования всех связей в комплексе, могут участвовать тепловые эффекты конформационных перестроек белка и сопутствующих гидратационных изменений в системе. В ряде случаев перечисленные эффекты удается учесть с помощью независимых данных и расчетов; работы в этом направлении развиваются, так как реакционная калориметрия представляет собой фактически единственный экспериментальный метод исследования термодинамики при постоянной температуре.
