
- •Отличительные особенности эукариотической и прокариотической клеток.
- •Одномембранные органоиды Эндоплазматическая сеть
- •Аппарат Гольджи.
- •Лизосомы.
- •Пероксисомы.
- •Вакуоли.
- •Митохондрии.
- •Пластиды.
- •Немембранные органоиды Клеточный центр.
- •Рибосомы.
- •Органоиды, образующие цитоскелет.
- •Ядерный аппарат эукариотической клетки.
Рибосомы.
Рибосомы были открыты с помощью электронного микроскопа Дж.Паладе в 1955 году. Это общий органоид, встречающийся в клетках про- и эукариот, имеет округлую форму диаметром 15 - 35 нм. Рибосома - это немембранный органоид, состоящий из двух субъединиц - большой и малой. Эти субъединицы образуются в ядрышках ядра и соединяются только в цитоплазме во время синтеза белка на информационной РНК в присутствие ионов магния. Несколько рибосом, нанизанных на одну матричную РНК, называют полисомой. Рибосомы бывают:
1. Свободные - рибосомы, свободно располагающиеся в гиалоплазме и синтезирующие необходимые для клетки белки.
2.Связанные - прикрепленные к гранулярной ЭПС рибосомы. Синтезируемые ими белки транспортируются за пределы клетки и используются для нужд всего организма, например в процессе переваривания пищи.
По своему происхождению рибосомы подразделяются на:
1. Прокариотические рибосомы - это мелкие органоиды с коэффициентом седиментации 70S, зависящим от конфигурации и молекулярной массы частиц, осаждаемых при центрифугировании. При центрифугировании они отделяются на большую (50S) и малую (30S) субчастицы, которые в свою очередь диссоциируют на белки и р-РНК. 30S- субчастица состоит из 21 молекулы белка и одной молекулы 16-S-РНК. 50-S-cубчастица содержит 34 молекулы белка и 2 молекулы р-РНК (5S и 23S). В митохондриях и хлоропластах эукариотических клеток содержатся точно такие же прокариотические рибосомы, что свидетельствует об их происхождении от прокариот. Рибосомы митохондрий и пластид синтезируют белок для своих нужд.
2.Эукариотические рибосомы крупнее прокариотических и имеют коэффициент седиментации 80S.При центрифугировании они распадаются на большую (60S) и малую (40S) субчастицы. Малая субчастица состоит из одной молекулы 18S-РНК, большая - из 3 молекул РНК (5S, 7S и 28S).
Протеасомы .
Впервые пртеасомы были описаны в 1977 году А.Гольдбергом. Протеасома (от англ. «protease» - протеиназа и лат. «some» - тело) - комплекс протеаз, существующий в про- и эукариотической клетках, имеющий немембранное строение и осуществляющий избирательную деградацию белков в конце их жизненного цикла.
Давно известно, что переваривание и разрушение питательных веществ, в том числе и белков, происходит в лизосомах. Считается, что в них разрушаются внеклеточные и мембранные белки, поступившие в клетку посредством эндоцитоза. Внутриклеточные белки, в основном, деградируются в протеасомах (около 90%).
Протеасомы вызывают особый интерес, так как, осуществляя внутриклеточный пртеолиз важнейших белков, регулируют основные процессы жизнедеятельности клетки.
Протеолиз - это физиологический процесс, осуществляемый клеткой для инактивации белков, участвующих в регуляции клеточных процессов: транскрипции, редупликации и репарации ДНК, клеточного цикла и деления, трансмембранной передачи сигналов, старении и гибели клетки (апоптоз).
Протеолизу внутри клетки подвергаются следующие белки:
1.регуляторные белки;
2.поврежденные или развернутые;
3.неправильно свернувшиеся;
4.белки, не включившиеся в белковый комплекс;
5.мутантные белки;
6.пептиды, которые узнаются иммунной системой.
Протеасомы обнаружены в цитоплазме и ядре. Внутриклеточная дифференцировка протеасом зависит от типа клеток. В пролифирирующих клетках протеасомная активность выше, чем в старых клетках. Кроме того, отмечено, что в старых клетках протеасомы больше накапливаются в цитоплазме, чем в ядре.
Каждая протеосома состоит из полого цилиндра, образованного 4 кольцами, каждое из которых состоит из 7 субъединиц - белковых молекул. Периферические кольца состоят из альфа субъединиц. С двух сторон периферические кольца соединены регуляторной частицей, которая не только распознает и присоединяет, но денатурирует белок и переносит его в протеолитическую полость протеасомы. Два внутренних кольца состоят из бетта субъединиц (3 конституционных и 4 имунных), внутренняя часть которых обладает каталитической активностью по отношению к денатурированному белку. Такой протеолиз происходит в протеасомах (20S) прокариот.
В эукариотических протеосомах (26S) белковая деградация происходит при участии АТФ, убиквитина и специальных ферментов. АТФ - зависимый протеолиз происходит только после предварительного присоединения специального белка - убиквитина к расщепляющемуся белку посредством сшивающего фермента- убиквитина-лигазы. Присоединеие к дегрдационному белку убиквитиновой цепочки из 4 -х и более молекул служит сигналом для начала протеолиза. Постепенное присоединение цепочки убиквитиновых молекул дает эукариотической клетке время «подумать» и отменить дегрдацию. Поэтому протеолиз у эукариотических клеток является обратимым.
СХЕМАТИЧЕСКОЕ СТРОЕНИЕ ПРОТЕАСОМЫ
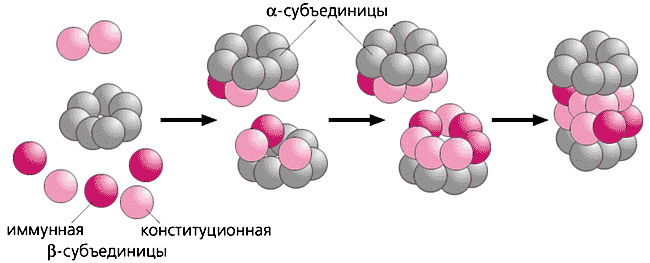
Рис.5.
![]()
РАЗЛИЧНЫЕ ФОРМЫ ПРОТЕАСОМ
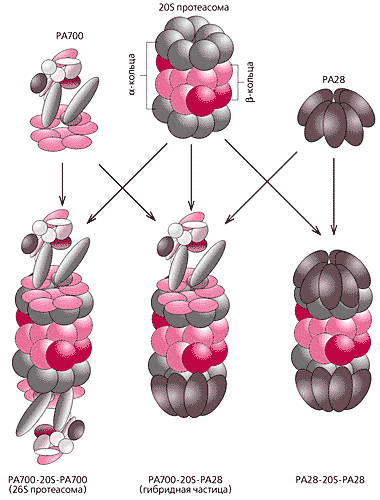
Рис.6.
Нарушение протеасомной деградации белков может привести к возникновению патологических состояний, преждевременному старению и апоптозу - гибели клеток.
Снижение протеасомной активности приводит к накоплению ненужных белков - мусора, который нарушает нормальную жизнедеятельность клетки. Так, накопление окисленных белков в клетке ведет преждевременному ее старению. Повышение активности протеасом может привести к перерождению в злокачественные клетки.
