
Дослід №2 виявлення карбону й гідрогену окиснюванням речовини купрум(ІІ) оксидом
Реактиви: цукор (попередньо просушений), купрум(ІІ) оксид – порошок, вапняна (або баритова) вода – насичений розчин кальцій гідроксиду або барій гідроксиду, безводний купрум(ІІ) сульфат – свіже прожарений.
Обладнання: вигнуті газовідвідні трубки із пробками для пробірок, вата.
Найбільш загальним, універсальним методом виявлення в органічній речовині карбону й одночасно з ним гідрогену є окиснювання його купрум(ІІ) оксидом. При цьому карбон перетворюється в карбону(IV) оксид, а гідроген – у воду.
В суху пробірку з газовідвідною трубкою поміщають 0,2-0,3 г сахарози й 1-2 г порошку купрум(ІІ) оксиду. Вміст пробірки ретельно перемішують, зверху суміш засипають шаром купрум(ІІ) оксиду – приблизно 1 г. У верхню частину пробірки (під пробку) поміщають маленьку грудочку вати, на яку насипають небагато безводного купрум(ІІ) сульфату. Пробірку закривають пробкою з газовідвідною трубкою й закріплюють її в лапці штатива з невеликим нахилом убік пробки. Вільний кінець газовідвідної трубки опускають у пробірку з вапняною (або баритовою) водою, так щоб трубка майже торкалася поверхні рідини. Спочатку прогрівають всю трубку, потім сильно нагрівають ту частину, де знаходиться реакційна суміш.
Відзначте, що відбувається з вапняною водою. Чому змінюється кольор купрум(ІІ) сульфату?
Напишіть рівняння наступних реакцій:
а) окиснювання сахарози C12H22O11 оксидом міді в надлишку;
б) взаємодія продуктів, що утворюються при окиснюванні сахарози, з вапняною водою й з безводним купрум(ІІ) сульфатом.
Дослід №3 Виявлення нітрогену сплавкою речовини з металевим натрієм. (Тяга! Захисні окуляри!)
Реактиви: сечовина, металевий натрій, 5% розчин ферум(ІІ) сульфату, 1% розчин ферум(ІІ) хлориду, 10% розчин соляної кислоти, етиловий спирт, лакмусовий папір.
Обладнання: фільтрувальний папір, скальпель, пінцет.
Принцип методу полягає в тому, що при сплавлянні з металевим натрієм органічна речовина розкладається, а нітроген, що міститься в ній, утворює із карбоном і натрієм ціанід натрію:
N -органічна
речовина + Na сплавка
Na СN+ … ...
-органічна
речовина + Na сплавка
Na СN+ … ...
Ціанід натрію, що утворився, виявляють, переводячи його в берлінську лазур.
У суху пробірку поміщають кілька кристалів сечовини Н2N–СО–NН2 і шматочок (з половину горошини) очищеного від кірки й віджатого у фільтрувальному папері металевого натрію. (Замість сечовини можна взяти інші органічні речовини, що містять Нітроген: анілін, ацетамід, яєчний білок тощо). Обережно нагрівають пробірку в полум'ї пальника. (витяжна шафа! Захисні окуляри!) Через якийсь час відбувається спалах, пробірку нагрівають до червоного розжарювання ще 1-2 хвилини. Необхідно простежити, щоб натрій плавився разом із сечовиною, тому що інакше ціанід натрію не зможе утворитися й дослід виявиться невдалим. Після сплавки пробірку охолоджують і додають до сплаву 3-4 краплі етилового спирту для видалення залишків натрію. У пробірку доливають 2 мл води й нагрівають її до розчинення плаву при помішуванні скляною паличкою. Безбарвний розчин переливають в іншу пробірку (при необхідності його фільтрують через маленький складчастий фільтр). Якщо органічна речовина зруйнована не повністю, рідина має буре або чорне забарвлення. У такому випадку сплавка досліджуваної речовини з натрієм повторюють.
До фільтрату додають 2-3 краплі 5% розчину сульфату феруму(ІІ) і 1 краплю 1% розчину хлориду феруму(ІІІ). Випадають осади гідроксиду феруму(ІІ) брудно-зеленого й гідроксиду заліза (ІІІ) бурого кольорів.
Напишіть рівняння реакцій їхнього утворення в лужному розчині. Якщо в гексаціаноферат натрію. Напишіть рівняння наступних реакцій:
ціанід натрію + Fe(ОН)2 → ціанід феруму(ІІ) + NаОН
ціанід феруму(ІІ) + ціанід натрію → гексаціаноферат натрію.
Вміст пробірки перемішують, а потім підкислюють 10% розчином соляної кислоти. Осад суміші гідроксидів феруму(ІІ) і (ІІІ) розчиняється, і з'являється синє забарвлення (берлінська лазур). Через якийсь час у пробірці випадає синій осад. Якщо берлінської лазурі утвориться дуже мало, розчин забарвлюється в зелені кольори, що поступово переходить у синій. Берлінська лазур утвориться при взаємодії гексаціаноферату натрію з іонами тривалентного феруму. У лужному середовищі міститься недисоційований гідроксид феруму(ІІІ), а іони з'являються лише в кислому середовищі, тому берлінська лазур може утворитися тільки в кислому середовищі.
Напишіть рівняння наступних реакцій:
гідроксид феруму(ІІІ) + соляна кислота →
гексаціаноферат натрію + хлорид ферум(ІІІ) →
Дослід №4. Виявлення Сульфуру сплавкою органічної речовини з металевим натрієм. (Тяга ! Захисні окуляри!)
Реактиви: тіосечовина (або сульфанілова кислота, сухий білок, білий стрептоцид і інші), металевий натрій, 2% розчин ацетату свинцю, 2% розчин нітропрусиду натрію (свіжоприготовлений) 10% розчин соляної кислоти, оцтова кислота, етиловий спирт.
Обладнання: фільтрувальний папір, скальпель, пінцет.
Сульфур виявляють в органічній речовині подібно Нітрогену спочатку руйнують органічну речовину сплавкою з металевим натрієм, сульфур утворює із натрієм сульфід натрію. Далі відкривають сульфід-іон (S2-) звичайними якісними реакціями.
У суху пробірку вносять кілька крупинок тіосечовини (або іншу сульфуровмісну речовину) і шматочок металевого натрію із блискучою поверхнею розміром з половину горошини. Далі проводять сплавку так, як це описано в досліді №3 (відкриття нітрогену). (Витяжна шафа! Захисні окуляри!)
Розчин, що містить сульфід натрію, ділять на 3 частині.
а) першу частину підкислюють оцтовою кислотою, потім додають 0,5 мл 2% розчину ацетату свинцю. Рідина забарвлюється в бурий або чорний колір, іноді з'являється чорний осад. Утворення осаду прискорюється при нагріванні.
Напишіть рівняння реакції сульфіду натрію й ацетату свинцю. Яка речовина випадає у вигляді чорного осаду?
б) до другої частини розчину доливають 0,5 мл 2% розчину нітропрусиду натрію. Проявляється інтенсивне червоно-фіолетове забарвлення, що поступово переходить у буре. Ця проба значно чутливіша до іонів плюмбуму.
Напишіть рівняння реакції утворення комплексної солі сполуки Na4[Fe(CN)5NO2] при взаємодії сульфіду натрію й нітропрусиду натрію Na4[Fe(CN)5NO].
в) до третьої частини розчину додають 10% соляну кислоту, при цьому з'являється запах сірководню. Напишіть рівняння реакції сульфіду натрію із соляною кислотою.
Дослід №6. Проба Бейльштейна на галогени.
Реактиви: хлороформ (або дихлоретан, хлорбензен, бромбензен і йодоформ і ін.), вода (або спирт, бензен і ін.), хлоридна кислота.
Обладнання: мідний дріт дожиноюї близько 10 см з петлею на кінці, закріплений у коркову пробку.
При прожарюванні органічної речовини з оксидом купруму(ІІ) відбувається його окиснювання. Вуглець перетворюється в оксид карбону(IV), водень – у воду, а галогени (крім фтору) утворюють із міддю летучі галогеніди, які забарвлюють полум'я в яскраво-зелений колір. Реакція дуже чутлива. Однак варто мати на увазі, що й деякі інші солі міді, наприклад ціаніди, що утворюються при прожарюванні нітрогенвмісних органічних сполук (сечовини, похідних піридина, хінуліна й ін.), також забарвлюють полум'я.
Мідний дріт тримають за пробку й прожарюють інший кінець її (петлю) у полум'ї пальника до припинення забарвлення полум'я й утворення на поверхні чорного нальоту оксиду купруму(ІІ). Петлю, що вихолонула, змочують хлороформом, наливають у пробірку, і знову вводять у полум'я пальника. Спочатку полум'я стає яскравим (згоряє вуглець), потім з'являється інтенсивне зелене забарвлення.
Напишіть рівняння реакції: а) утворення оксиду купруму(ІІ); б) окиснювання хлороформу оксидом купруму(ІІ), маючи на увазі, що утворюються хлориди купруму(І) і (ІІ).
Варто зробити контрольний дослід, використовуючи замість хлороформу речовину, що не містить галоген (бензен, воду, спирт).
Для очищення дріт змочують соляною кислотою й прожарюють.
Дослід №9. Реакції з рідкими насиченими вуглеводнями.
Реактиви: рідкі насичені вуглеводні, 5% розчин Na2CO3, -% розчин KMnО4, концентрована сульфатна кислота, концентрована нітратна кислота, 5% розчин брому в чотирихлористому карбоні, 25% розчин амоніаку, синій лакмусовий папірець.
Посуд: порцелянова чашка.
а) Відношення алканів до водяного розчину перманганату калію.
У пробірку наливають 1 мл насичених вуглеводнів, 1 мл 5% розчину Na2CO3, потім по краплях при струшуванні додають розчин KMnО4. Чи змінюється фіолетове забарвлення перманганату калію?
Зробіть висновок відношення алканів до водного розчину перманганату калію.
б) Відношення алканів до концентрованої сульфатної кислоти.
У суху пробірку наливають 1 мл насичених вуглеводнів і 1 мл концентрованої сульфатної кислоти. Вміст пробірки збовтують протягом 2-3 хвилин.
Чи відбуваються будь-які зміни? Чи розігрівається суміш? Зробіть висновок на підставі досліду.
в) Відношення насичених вуглеводнів до концентрованої нітратної кислоти.
До 1 мл насичених вуглеводнів (у сухій пробірці) додають 1 мл концентрованої нітратної кислоти, суміш струшують протягом 2-3 хвилини.
Зробіть висновок про відношення алканів до концентрованої нітратної кислоти при кімнатній температурі.
г) Бромування алканів. (Тяга!)
У суху пробірку наливають 1 мл насичених вуглеводнів і додають декілька краплин 5% розчину брому в чотирихлористому карбоні. Вміст пробірки перемішують на холоді. (Чи зникає забарвлення брому?) Потім суміш нагрівають на водяній бані. Забарвлення брому поступово зникає, одночасно утворюється газоподібний бромоводень. Його виявляють, по-перше, по зміні кольору вологого синього лакмусового паперу, внесеного пінцетом у верхню частину пробірки; по-друге, по утворенню туману, що утворюється при внесенні скляної палички, змоченої в 25% розчині амоніаку, у пари, що виділяються із пробірки.
Написати рівняння реакції за яким механізмом здійснюється взаємодія алканів із бромом? Напишіть рівняння реакції й розглянете її механізм на прикладі бромування 2-метилпентану (одержання монобромпохідного).
д) Горіння рідких алканів. (Тяга!)
У порцелянову чашку наливають 1 мл рідких алканів і підпалюють.
Пояснити, чому на відміну від метану рідкі алкани горять полум'ям, що коптить. Обчислити процентний вміст карбону й гідрогену в метані, у гексані. Написати рівняння реакції горіння пентану, гексану, октану.
НАСИЧЕНІ ВУГЛЕВОДНІ РЯДУ ЕТИЛЕНУ
(АЛКЕНИ)
Дослід 10. Одержання етилену і його властивості.
Реактиви: суміш для одержання етилену ( 96% етилового спирту й концентрованої сульфатної кислоти в об'ємному відношенні 1:2), бромна вода (насичена), 2% розчин КМnО4, 10% розчин карбонату натрію, 1% розчин КМnО4, концентрована сульфатна кислота.
Обладнання: прилад для одержання етилену (рис. 41), кип'ятильники (шматочки битої порцеляни, пористої глини, пемзи, кварцовий пісок і ін.), газовідвідні трубки із хлоркальцієвими трубками, заповненими шматочками натронного вапна, кришки від тиглів.
а) Реакція етилену із бромною водою.
В суху пробірку наливають 5 мл суміші для одержання етилену (етиловий спирт і концентрована сульфатна кислота в об'ємному відношенні 1:2). При змішуванні етанолу із сульфатною кислотою утвориться этилсульфатна кислота – кислий естер. Напишіть рівняння реакції утворення етилсульфатної кислоти. У реакційну суміш поміщають кілька кип'ятильників (шматочків битої порцеляни, кварцового піску й т.д.) – для рівномірного кипіння реакційної суміші, закривають пробірку пробкою з газовідвідною трубкою й закріплюють її в штативі. В середину газовідвідної трубки вставляють хлоркальцеву трубку з натронним вапном, поміщеної між двома нещільними ватними тампонами (рис. 41). Натронне вапно повинне бути у вигляді шматочків, газоподібні речовини повинні вільно проходити через неї (у противному випадку можуть бути нещасний випадок: якщо вихід для газів закритий, під їхнім тиском пробка може вискочити й кипляча реакційна суміш, що містить концентровану сірчану кислоту, буде викинута із пробірки). У штатив ставлять пробірку з 2 мл бромної роки. Пробірку із сумішшю для одержання етилену обережно нагрівають за тим, щоб рідину, що спінюється, не перекинуло в у хлоркальцієву трубку. Що виділяється етилен пропускають бромову воду, що швидко знебарвлюється (якісна реакція на кратні зв'язки) Написати рівняння реакції утворення етилену з етилсульфатної кислоти (реакція йде при температурі близько 170°С). Крім основної реакції – сульфатнокислої дегідратації етилового спирту, протікає кілька побічних реакцій. Одна з найбільш важливих – окислювально-відновна. Концентрована сульфатна кислота при високій температурі окиснює органічну речовину (у тому числі й етанол) до карбону й оксиду карбону(IV) – реакційна суміш чорніє. При цьому кислота відновлюється, до оксиду сульфуру(IV), що може реагувати із бромною водою (і з перманганатом калію) подібно етилену. Тому етилен відокремлюють від домішків оксиду сульфуру(IV). Кислотні оксиди (SО2, СО2) поглинають натронним вапном, поміщеного в хлоркальцієву трубку. Напишіть рівняння реакцій оксидів SО2 і СО2 з натронним вапном. Етилен реагує із бромною водою по електрофільному механізму (АЕ). Розгляньте його. Яку роль у цій реакції відіграє вода?
б) Реакція етилену з водяним розчином перманганату калію (реакція Е. Е. Вагнера).
У пробірку наливають 2 мл 2% розчину перманганату калію, додають 0,5 мл 10% розчину соди й пропускають етилен? Фіолетове забарвлення розчину перманганату калію зникає, утвориться пластівчастий осад бурих кольорів. Якщо етилен пропускати довго, осад може розчинитися. При окиснюванні етилену в умовах реакції Вагнера утворюється двохатомний спирт етиленглікол НО-СН2-СН2-ОН Напишіть рівняння реакції окиснювання етилену водним розчином перманганату калію. Реакція Вагнера – якісна реакція на кратні зв'язки.
г) Горіння етилену.
Підпалюють етилен біля кінця газовідвідної трубки (рис.1). етилен горить світним полум'ям. Вносять у полум'я етилену кришку від тигля. Пояснити, чому на кришці утвориться чорна пляма. Розрахуйте вміст карбону й гідрогену в молекулі етилену в масових частках (%). Напишіть рівняння реакції горіння етилену.
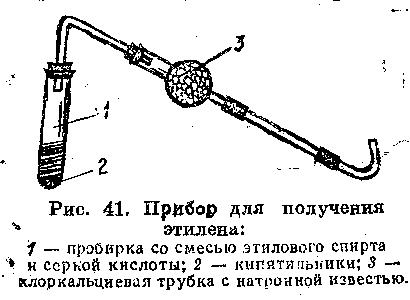
Рис.1. Прилад для одержання етилену: 1 - пробірка з сумішшю етилового спирту та сульфатної кислоти; 2 - кип'ятильники; 3 - хлоркальцієва трубка з натронним вапном
Дослід 11. Властивості рідких неграничних вуглеводнів ряду етилену (алкенів)
Реактиви: ненасичені рідкі вуглеводні 1, 3% брому в чотирихлористому карбоні, 2% розчин перманганату калію, 10% розчин карбонату натрію, концентрована сульфатна кислота, концентрована нітратна кислота, синій лакмусовий папі.
Матеріали: фільтрувальний папір.
а) Бромування ненасичених вуглеводнів. (Тяга!)
У суху пробірку наливають 1 мл ненасичених вуглеводнів і додають по краплях при струшуванні 3% розчин брому в чотирихлористому карбоні. Якщо жовте забарвлення зникає повільно, суміш обережно підігрівають на бані з гарячою водою. До отвору пробірки підносять вологий синій лакмусовий папір, переконуються, що забарвлення її не міняється. Напишіть рівняння реакції приєднання брому до 2-метилбутену-2 і розгляньте її механізм (АЕ). Розрахуйте, скільки грамів 3% розчину брому буде потрібно для бромування 1 г 2-метилбутена-2.
б) Окиснювання алкенів водним розчином перманганату калію (реакція Е.Е. Вагнера).
У пробірку наливають 1 мл ненасичених вуглеводнів, додають 1 мл 10% розчину соди, потім по краплях при струшуванні – 2% розчин перманганату калію. Фіолетове забарвлення розчину зникає, з'являється пластівчастий осад бурого кольору. Якщо зникнення фіолетового забарвлення помітити важко, у суміш опускають смужку фільтрувального паперу, що всмоктує лише розчин, але не осад. Забарвлення розчину на фільтрувальному папері видно чітко. Напишіть рівняння реакції окиснювання 2-метилбутена-2 водним розчином КМnO4 і підберіть коефіцієнти.
Реакції із бромною водою й з водним розчином перманганату калію – якісні реакції на сполуки із кратними зв'язками.
в) Реакція алкенів з концентрованою сульфатною кислотою.
У суху пробірку наливають 1 мл ненасичених вуглеводнів, додають 1 мл концентрованої сульфатної кислоти й збовтують суміш протягом декількох хвилин. (Спочатку обережно!) Якщо суміш сильно розігрівається пробірку охолоджують водою. Шар алкену зникає, суміш набуває буре забарвлення. Напишіть рівняння реакції утворення алкілсульфатної кислоти й розгляньте механізм (АЕ) цієї реакції (на прикладі 2-метилбутену-2). Реакцією з концентрованою сульфатною кислотою користуються для очищення насичених вуглеводнів від домішок ненасичених вуглеводнів.
г) Взаємодія алкенів з концентрованою нітратною кислотою.
У суху пробірку наливають 1 мл ненасичених вуглеводнів, додають 1 мл концентрованої й обережно перемішують суміш. Коли реакція нітратної кислоти реакційну суміш енергійно струшують протягом декількох хвилин. Суміш розігрівається й стає бурою. Відбувається утворення складної суміші продуктів смоління. Якими спектральними методами можна виявити подвійний зв'язок в алкенах?
АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ (АЛКІНИ).
АЦЕТИЛЕН.
Дослід 13. Отримання і властивості ацетилену.
Реактиви: карбід кальцію (шматочки), бромна вода (насичена), 1% розчин КMnО4, 10% розчин карбонату натрію, 1% розчин нітрату арґентуму, 5% розчин амоніаку, аміачний розчин хлориду купруму(I).
Обладнання: зігнуті газовідвідні трубки, короткі прямі газовідвідні трубки з відтягнутим кінцем, кришки від тиглів, фільтрувальний папір.
а) Отримання ацетилену та його горіння. (Тяга!)
У пробірку поміщають шматочок карбіду кальцію, приливають близько 1 мл води і відразу ж закривають її пробкою з газовідвідною трубкою, що має відтягнутий кінець. Підпалюють ацетилен, що виділяється, у кінця газовідвідної трубки. Спостерігають характер полум'я. Потім міняють газовідвідну трубку: закривають пробірку, з якої виділяється ацетилен, зігнутою газовідвідною трубкою з широким отвором і знову підпалюють ацетилен. Вносять до полум'я кришку тигля. На кришці утворюється чорна пляма сажі. Чи має ацетилен запах?
Напишіть рівняння реакцій: отримання ацетилену з карбіду кальцію і горіння ацетилену (повне і неповне згорання).
б) Реакція ацетилену з бромистою водою.
Закривають пробірку з карбідом кальцію і водою пробкою із зігнутою газовідвідною трубкою і пропускають ацетилен через бромну воду. Поясніть, чому знебарвлення бромної води відбувається значно повільніше, ніж при реакції з етиленом.
Напишіть рівняння реакції ацетилену з бромом.
в) Окиснення ацетилену перманганатом калію.
У пробірку наливають 1 мл розчину перманганату калію, додають такий же об'єм розчину карбонату натрію і потім пропускають через отриманий розчин ацетилен. Поступово фіолетове забарвлення розчину зникає, з'являється пластівчастий осад оксиду мангану(IV) бурого кольору. При окисненні ацетилену утворюється суміш речовин, частково відбувається повне окислення до оксиду карбону(IV).
Напишіть рівняння реакції окиснення ацетилену перманганатом калію до оксалатної кислоти НООС—СООН. Підберіть коефіцієнти методом електронного балансу.
ГАЛОГЕНПОХІДНІ АЛІФАТИЧНИХ ВУГЛЕВОДНІВ.
Дослід 16. Отримання етилхлориду.
Реактиви: суміш етилового спирту і концентрованої сульфатної кислоти у відношенні 2:1 (за об'ємом), хлорид натрію.
Обладнання: прямі газовідвідні трубки з відтягнутим кінцем.
У пробірку наливають 3 мл суміші етилового спирту і концентрованої сульфатної кислоти (2:1) і додають 0,1 г розтертого в порошок хлориду натрію. Пробірку закривають пробкою з прямою газовідвідною трубкою, що має відтягнутий кінець, і дуже обережно нагрівають (рідина спінюється). Підпалюють етилхлорид, що виділяється, в отворі газовідвідної трубки; він горить характерним полум'ям із зеленою каймою. Етилхлорид при звичайній температурі – газоподібна речовина (темп. кіп. +12,4 °С).
Напишіть рівняння реакції отримання етилхлориду з вказівкою проміжних стадій.
Дослід 21. Властивості хлороформу.
Реактиви: хлороформ, 10% розчин гідроксиду натрію, розчин йоду в йодиді калію, 1% розчин нітрату арґентуму, 10% розчин амоніаку, 1% розчин перманганату калію, 20% розчин нітратної кислоти.
Обладнання: зворотні холодильники до пробірок, зігнуті газовідвідні трубки, стакани (100 мл), лід.
а) У пробірку наливають 1 мл хлороформу і 1 мл води. Закривають пробірку пробкою і енергійно струшують. Через деякий час утворюється два шари.
б) Наливають в пробірку 1,5-2 мл хлороформу і додають декілька крапель розчину йоду в КI, струшують суміш. Нижній шар забарвлюється в рожевий колір. Хлороформ добре розчиняє йод; при струшуванні йод переходить з водного шару в хлороформ, забарвлюючи його в рожевий колір.
в) Гідроліз хлороформу.
У
пробірку наливають 1 мл хлороформу і 3
мл 10%-вого розчину гідроксиду натрію.
Закривають пробірку пробкою із зворотним
холодильником і обережно при струшуванні
нагрівають суміш до кипіння, потім
охолоджують. В умовах досліду хлороформ
гідролізує з утворенням йонів Хлору та
мурашиної кислоти (у лужному середовищі
виходить натрієва сіль мурашиної кислоти
– форміат натрію НCOONa). Для виявлення
іонів Хлору відливають в пробірку
![]() гідролізату, підкислюють його 20% розчином
нітратної кислоти і додають декілька
крапель 1% розчину нітрату арґентуму.
гідролізату, підкислюють його 20% розчином
нітратної кислоти і додають декілька
крапель 1% розчину нітрату арґентуму.
Напишіть рівняння реакцій гідролізу хлороформу в лужному середовищі і взаємодії хлору з нітратом арґентуму.
Мурашина кислота легко окиснюється, оскільки містить в молекулі альдегідну групу. Ця властивість лежить в основі методів виявлення її в розчині. Залишок лужного гідролізату хлороформу ділять на дві частини. До однієї підливають свіжоприготований аміачний розчин гідроксиду арґентуму, а до іншої — декілька крапель 1% розчину перманганату калію. У першій пробірці випадає металеве срібло (реакція «срібного дзеркала»), в другій – розчин забарвлюється в зелений колір (у лужному середовищі КМnО4 відновлюється в сіль манганатної кислоти, аніони якої забарвлені).
Напишіть рівняння реакцій і підберіть до них коефіцієнти методом електронного балансу.
Дослід 23. Одержання й властивості йодоформу.
Реактиви: етиловий спирт, йод, 10% розчин гідроксиду натрію, 1% розчин нітрату срібла, 5% розчин амоніаку, 1% розчин перманганату калію, 20% розчин нітратної кислоти.
Обладнання: хімічні лійки, предметні й покривні скельця, мікроскоп, водяна баня.
При струшуванні розчиняють у пробірці 0,5 г йоду в 1 мл спирту. До спиртового розчину йоду додають 6 мл води (йод при цьому випадає в осад), потім при струшуванні по краплях доливають 10% розчин гідроксиду натрію доти, поки не зникне бурі забарвлення йода й реакційна суміш не набуде яскраво-жовте забарвлення. Надлишок лугу неприпустимий, тому що луг приводе до гідролізу йодоформу. Для прискорення реакції пробірку обережно підігрівають на водяній бані (температура води в лазні 70-80 °С). При охолодженні випадає рясний осад йодоформу у вигляді яскраво-жовтих кристалів зі специфічним запахом. Осад йодоформу відфільтровують, віджимають у фільтрувальному папері й очищають перекристалізацією з етилового спирту або ацетону. Для цього кристали переносять у пробірку, наливають близько 1 мл органічного розчинника (спирту або ацетону) і нагрівають пробірку на водяній бані до повного розчинення осаду. Після охолодження в крижаній воді кристали йодоформу, що випали, відфільтровують і промивають невеликою кількістю дистильованої води. Краплю водної суспензії кристалів йодоформу переносять на предметне скло й розглядають кристали під мікроскопом. Вони мають форму правильних шестикутників або зірочок (рис. 2). Реакція одержання йодоформу описаним способом дуже чутлива, вона дає можливість виявити навіть сліди етилового спирту у водному розчині.
Н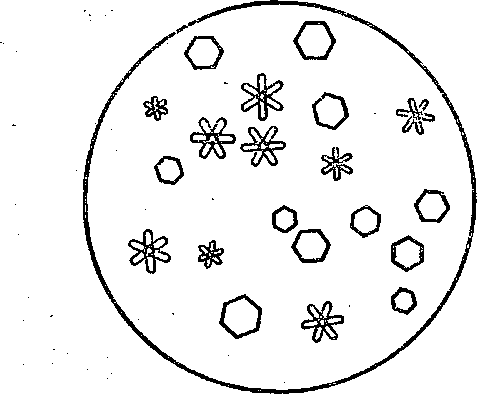 апишіть
рівняння реакції одержання йодоформу
з етилового спирту, йоду й гідроксиду
натрію.
апишіть
рівняння реакції одержання йодоформу
з етилового спирту, йоду й гідроксиду
натрію.
Проведіть гідроліз отриманого йодоформу 10% розчином гідроксиду натрію і якісні реакції з гідролізатом, описані в досліді 21, в.
Напишіть рівняння реакцій гідролізу йодо-
Рис. 2 форма лугом, виявлення йодид-йону (нітратом аргентуму), визначення в гідролізаті форміату натрію (реакцією «срібного дзеркала» , окиснюванням перманганатом калію). Який з галоформів (хлороформ, бромоформ, йодоформ) найбільш легко гідролізує в лужному середовищі?
Дослід 24. Кольорова реакція на галоформи (хлороформ, бромоформ, йодоформ).
Реактиви: хлороформ, бромоформ (у крапельницях), йодоформ, 10% розчин резорцину, 10% розчин гідроксиду натрію.
У три пробірки наливають по 1 мл 10% розчину резорцину й по 5 капель 10% розчину гідроксиду натрію. У першу пробірку додають 5 краплі хлороформу, у другу – стільки ж бромоформа, у третю – трохи йодоформу. Суміші нагрівають. З'являється забарвлення.
Дослід 25. Властивості чотирьоххлористого карбону.
Реактиви: чотирьоххлористий карбон, 10% розчин гідроксиду натрію, 20% розчин нітратної кислоти, 1% розчин нітрату аргентуму, етиловий спирт (або інша легкозаймиста органічна речовина), соняшникове масло (або інший жир),
Обладнання: парцелянова чашка, азбестова сітка, мідний дріт.
Чотирьоххлористий карбон широко використовується як розчинник жирів, олій, смол, каучуку. Важливою властивістю, що відрізняє його від більшості органічних розчинників, є негорючість. На цій властивості засноване його застосування у вогнегасниках для гасіння пожеж на хімічних підприємствах, у лабораторіях, книгосховищах і ін.
а) У пробірку наливають 1 мл ССl4 і додають 1 краплю соняшникового олії або іншого жиру. Збовтують суміш. Результат досліду записують у журнал.
б) У порцелянову чашку наливають 2 мл етилового спирту (або іншої легкозаймистої речовини), ставлять чашку на азбестову сітку й підпалюють спирт. (Обережно! Тяга!). Гасять «пожежу» чотирьоххлористим карбоном.
в) У пробірку наливають трохи ССl4 і 2-3 мл 10% розчини гідроксиду натрію, обережно нагрівають суміш 1-2 хв до початку кипіння (при збовтуванні реакційної суміші). Потім охолоджують, зливають лужну рідину в іншу пробірку, підкисляють її 20% розчином нітратної кислоти й додають трохи 1% розчину нітрату аргентума.
Зрівняйте результати цього досліду з результатами, отриманими при лужному гідролізі галоформів (СНСl3, СНВг3, СНІ3). Зробіть висновок про рухливість хлору в молекулі чотирьоххлористого карбону.
СПИРТИ. СКЛАДНІ ЕСТЕРИ МІНЕРАЛЬНИХ КИСЛОТ.
ПРОСТІ ЕСТЕРИ.
Дослід 27. Розчинність спиртів, відношення їх до індикаторів, горіння. Розчинність галогенів у спиртах.
Реактиви: спирти (метиловий, етиловий, пропіловий, бутиловий, аміловий або ізоаміловий), розчин йоду в йодиді калію (1% розчин), 1% спиртовий розчин фенолфталеїну, синій й червоний лакмусовий папір.
Обладнання: порцелянові чашки (або порцелянові тиглі), лучини.
а) В 4 пробірки наливають по 0,5 мл спиртів: етилового, пропілового, бутилового й амілового (або ізоамілового). Відзначають запах спиртів. Аміловий (ізоаміловий) спирт дратує дихальні шляхи, викликає кашель, тому нюхати спирти треба обережно. У кожну пробірку додають по 1 мл води й вміст пробірок струшують.
Зробіть висновок про розчинність спиртів у воді.
б) З кожної пробірки скляною паличкою наносять по краплі розчинів на синій і червоний лакмусовий папір. У пробірки додають по 1 краплині розчину фенолфталеїну.
Чи змінюється забарвлення індикаторів?
в) У порцелянові чашки (або тиглі) наливають по 2 мл спиртів, розташовуючи їх у порядку збільшення молекулярної маси (метиловий, етиловий, пропіловий, бутиловий, аміловий або ізоаміловий). Підпалюють спирти лучиною і порівнюють характер полум'я.
Поясніть дослід. Розрахуйте процентний вміст Карбону в спиртах, використаних для досліду. Напишіть рівняння реакцій горіння спиртів.
г) У пробірки зі спиртами додають по 0,5 мл розчину йоду в йодиді калію й струшують їх. Що спостерігається?
Дослід 28. Абсолютування етилового спирту.
Реактиви: етиловий спирт (ректифікат), сульфат купруму(II) кристалічний.
Обладнання: порцелянові чашки або тиглі, щипці, водяна баня.
У маленьку порцелянову чашку або порцеляновий тигель поміщають приблизно 1 г кристалічного сульфату купруму(II) і прожарюють його в полум'ї пальника до зникнення блакитного забарвлення.
У суху пробірку наливають 2-3 мл етилового спирту (ректифікату) й вносять у нього отриманий безводний сульфат купруму(II) (білого кольору). Злегка нагрівають пробірку на водяній бані й розмішують її вміст. (Чому змінюється колір сульфату міді?). Отриманий абсолютний етиловий спирт переливають у суху пробірку. Його використовують для одержання алкоголята натрію (дослід 30).
Скільки відсотків води міститься в етиловому спирті-ректифікаті? Чому воду не можна видалити перегонкою?
Дослід 29. Висолювання етилового спирту з його водного розчину.
Реактиви: етиловий спирт (ректифікат), карбонат калію (або тіосульфат натрію кристалічний).
Обладнання: порцелянові чашки, піпетки, лучини.
У пробірку наливають 2,5 мл етилового спирту й при струшуванні додають 2,5 мл води. Суміш розігрівається; 1-1,5 мл отриманого розчину відливають у порцелянову чашку й підносять до нього запалену лучину.
Чи загоряється розведений етиловий спирт?
До залишку в пробірці додають приблизно 2 г порошкоподібного карбонату калію (або тіосульфату натрію), енергійно збовтують вміст пробірки й ставлять пробірку в штатив. Через якийсь час у пробірці утворюються два шари. Верхній шар (етиловий спирт) піпеткою переносять у порцелянову чашку й знову підносять до нього палаючу лучину. Чи запалюється спирт? Потім випробовують на горючість нижній шар. Пояснити результати досліду.
Дослід 30. Утворення й гідроліз алкоголятів натрію.
Реактиви: етиловий спирт (абсолютний ), пропіловий (або ізопропіловий) спирт, аміловий (або ізоаміловий) спирт, металевий натрій, 1% спиртовий розчин фенолфталеїну.
Обладнання: прямі газовідвідні трубки з відтягнутими кінцями.
У три сухі пробірки наливають по 2 мл спиртів: у першу – абсолютний етиловий, у другу – пропіловий (або ізопропіловий), у третю – аміловий (або ізоаміловий). У кожну пробірку вносять по шматочку (розміром з горошину) очищеного від оксидного шару металічного натрію. Пробірки закривають пробками з газовідвідними трубки, кінці яких відтягнуті.
Чому для цього досліду неможна брати ректифікат, а потрібно брати абсолютний спирт? Відзначте, у якій пробірці реакція йде найбільше інтенсивно, а в якій – повільно.
Через 1-2 хв. після початку реакції підпалюють газ, який виділюється, в отворах газовідвідних трубок. Якщо реакція етанолу з натрієм сильно сповільнитися, можна злегка нагріти пробірку.
Напишіть рівняння реакції спирту (R–OH) з металевим натрієм. Як розщеплюється O-H зв'язок у цій реакції? Які властивості спиртів (основні або кислотні) проявляються в реакції з металевим натрієм? Чому спирти реагують із натрієм спокійніше, ніж вода?
Додають у пробірки по 1 краплі розчину фенолфталеїну. Чи змінюється забарвлення індикатору?
Доводять реакцію етанолу з натрієм до кінця. Для цього пробірку з натрієм обережно підігрівають. На дні пробірки утвориться білий твердий етилат натрію. (Шматочків натрію в пробірці не повинне бути!). Додають у пробірку 1-1,5 мл води й розчиняють у ній етилат натрію. Якщо забарвлення не з'являється, додають 1 краплю розчину фенолфталеїну.
Напишіть рівняння реакції етилату натрію з водою. Пояснити, чому з'являється забарвлення з фенолфталеїну.
Дослід 33 Реакції окиснювання спиртів.
Реактиви: етиловий і ізоаміловий спирти, хромова суміш, перманганат калію кристалічний, концентрована сульфатна кислота.
Обладнання: піпетки.
а) Окиснювання спиртів хромовою сумішшю.
У дві пробірки наливають по 2-3 мл хромової суміші й по краплях при струшуванні додають в одну пробірку 0,5 мл етилового спирту. Колір розчинів змінюється з жовтогарячого в зелений, у пробірці з етиловим спиртом відчувається запах оцтового альдегіду, що нагадує запах яблук (нюхати обережно!), а в пробірці з ізоаміловим спиртом – специфічний запах ізовалеріанового альдегіду.
Напишіть рівняння реакцій окиснювання хромовою сумішшю етилового спирту в оцтовий альдегід, а ізоамілового спирту – в ізовалеріановий альдегід. Підберіть коефіцієнти методом електронного балансу.
Дослід 36. Одержання простого (діетилового) етеру і його властивості.
Реактиви: суміш етилового спирту й концентрованої сульфатної кислоти в об'ємному співвідношенні 1:1, етиловий спирт, діетиловий етер (для наркозу або свіжоперегнаний), діетиловий етер, що містить пероксиди, натрій металевий, бромна вода, 1% розчин перманганату калію, концентровані сульфатна й соляна кислоти, 10% сульфатної кислоти, 10% розчин гідроксиду натрію, 1% розчин іодиду калію, 0,5% розчин крохмального клейстеру (у крапельниці), свіжоприготовлений 2% розчин залізоамонійних квасців (сіль Мору), 1% розчин роданіду амонію (або калію), насичений на холоді водний розчин n-бензохінону.
Обладнання: склянки (50 - 100 мл.), піпетки, прямі газовідвідні трубки з відтягнутими кінцями, лід, коркові пробки до пробірок, годинникові скла (або скляні пластинки), пінцет, фільтрувальний папір.
а) Одержання діетилового етеру і його горіння.
У суху пробірку наливають 3 мл суміші етилового спирту й сульфатної кислоти (1:1) і обережно нагріти її до кипіння. Після цього пальник забирають і до гарячої суміші доливають по стінці пробірки з піпетки 5-10 крапель етилового спирту. Діетиловий етер виявляють по запаху.
Потім пробірку закривають пробкою із прямою газовідвідною трубкою, що має відтягнутий кінець, знову обережно нагрівають пробірку й підпалюють етер, що виділяється. Чому етер горить світним полум'ям на відміну від етилового спирту? Обчислити процентний вміст Карбону в етанолі й у діетиловому етері.
Напишіть рівняння реакції одержання діетилового етеру й розглянути її механізм.
Дослід 37 Властивості гліцерину й етиленгліколу.
Реактиви: гліцерин, етиленгліколь, 2% розчин сульфату купруму(ІІ), 10% розчин гідроксиду натрію, розчин сульфатної кислоти (1:1), гідросульфат калію.
Одержання гліцерату й гліколяту міді. У пробірку наливають 3-4 краплі 2% розчину CuSO4 і 2-3 мл 10% розчину NaOH. До утвореного осаду блакитного кольору доливають трохи крапель гліцерину й суміш перемішують. Осад розчиняється, з'являється волошкове забарвлення розчину від комплексної сполуки гліцерат купру(ІІ). Напишіть рівняння реакцій, що відбуваються, укажіть, які властивості гліцерину проявляються в реакції з гідрооксидом купруму(ІІ).
Дослід повторюють, але замість гліцерину вводять у реакцію етиленглікол. Напишіть рівняння реакції утворення гліколяту купруму(ІІ).
АЛЬДЕГІДИ Й КЕТОНИ
Дослід 39. Одержання альдегідів і деякі кольорові реакції на них.
Реактиви: розчин фуксинсульфітної кислоти, 10% розчин формальдегіду,10% розчин оцтового альдегіду, конц. хлоридна кислота, оксид купрум(II), етиловий спирт.
Обладнання: пробірки, мірні пальчикові пробірки.
а) Реакція альдегідів з фуксинсульфітною кислотою.
У пробірку наливають 1 мл розчину фуксинсульфітної кислоти й додають краплі 10% розчину формальдегіду. Пробірку ставлять у штатив. У другу пробірку до фуксинсульфітної кислоти додають таку ж кількість 10% розчину оцтового альдегіду й теж залишають її. Через кілька хвилин у пробірці з формальдегідом з'являється фіолетове забарвлення, а в пробірці з оцтовим альдегідом – рожево-фіолетове.
При додаванні до забарвлених розчинів по 0,5 мл концентрованої хлоридної кислоти відбуваються наступні зміни: забарвлення в пробірці з формальдегідом переходить у фіолетово-синє, а в пробірці з оцтовим альдегідом через кілька хвилин зникає.
Поясніть результати досліду. Що собою представляє фуксинсульфітна кислота? Чому при додаванні альдегідів до безбарвного фуксинсульфітної кислоти з'являється забарвлення?
д) Одержання оцтового альдегіду з етилового спирту шляхом окислювання оксидом купруму(II).
Для одержання оцтового альдегіду окиснюванням етилового спирту оксидом купрум(II) повторюють дослід, але замість метилового спирту суху пробірку змочують етиловим спиртом. Оцтовий альдегід у невеликій концентрації пахне яблуками. Виявляють його кольоровою реакцією з фуксинсульфітною кислотою.
Напишіть рівняння реакції окиснювання етилового спирту в оцтовий альдегід оксидом купруму(II).
Дослід 40. Одержання й деякі властивості ацетону.
Реактиви: вода дистильована, сухий ацетат кальцію, порошок йоду, 10% розчин гідроксиду натрію, 10% розчину хлоридної кислоти.
Обладнання: штатив, пробірка, пробка з вигнутою під тупим кутом газовідвідною трубкою, порцелянова ступка.
а) Одержання ацетону піролізом ацетату кальцію.
Збирають прилад. На ¼ частину висоти пробірки насипають сухий ацетат кальцію й розподіляють його по нижній стінці пробірки. Після цього пробірку закривають пробкою з вигнутої під тупим кутом газовідвідною трубкою й закріплюють у штативі з нахилом убік пробірки. Кінець газовідвідної трубки опускають у пробірку-приймач, що містить 1,5-2 мл води. Прогрівають всю пробірку, потім прожарюють її, починаючи із дна. При піролізі ацетату кальцію утворюється ацетон, що розчиняється при відгоні у воді, наявної в пробірці-приймачі. Через 5-7 хв об'єм рідини в приймачі збільшується приблизно вдвічі.
Напишіть рівняння реакції одержання ацетону з ацетату кальцію.
Ацетон виявляють у розчині дуже чутливої йодоформною пробой (проба Лібена). Вона дозволяє відкрити ацетон у водяних розчинах при концентрації його близько 0,04%.
Для цього розчину ацетону додають небагато розтертого в порошок йода й по краплях при струшуванні додають 10% розчин гідроксиду натрію до знебарвлення йоду. Без нагрівання з ацетону випадає осад йодоформу.
При піролізі ацетату кальцію, крім ацетону, виходить карбонат кальцію. Для виявлення його до вмісту пробірки після охолодження додають трохи 10% розчину хлоридної кислоти. Відбувається виділення CO2.
Напишіть рівняння реакції.
Дослід 42. Реакція заміщення карбінольного оксигену.
Реактиви: сухий солянокислий гідроксил амін, безводний карбонат натрію, ацетон.
Обладнання: пробірки, склянка, лід.
в) Одержання оксима ацетону.
У пробірці розчиняють 1 г солянокислого гідроксиламіну в 3 мл води. Кислий розчин нейтралізують приблизно 0,7 г безводного карбонату натрію, додаючи його невеликими порціями; при струшуванні виділяється оксид карбону(IV). Пробірку з отриманим розчином охолоджують у склянці із крижаною водою. Потім додають до розчину гідроксил аміну близько 0,7 мл ацетону (при струшуванні). Суміш розігрівається. Знову виділяється оксид карбону(IV), з'являються безбарвні кристали оксиму ацетону. При охолодженні пробірки кількість кристалів збільшується. Оксим ацетону має слабкий запах.
Напишіть рівняння реакції утворення оксима ацетону й розглянете її механізм.
Дослід 44. Реакції окиснення альдегідів.
Реактиви: формалін (40% розчин формальдегіду), 5% розчин формальдегіду, ацетон, 1% розчин гідроксиду натрія, 2-відсотковий розчин сульфата купруму(II), 10% розчин нітратної кислоти, 1% розчин нітрата аргентума, 5% розчин амоніаку.
Обладнання: водяні бані, термометр.
а) Окиснення формальдегіду амоніачним розчином гідроксиду аргентума (реакція «срібного дзеркала»).
Для отримання «срібного дзеркала» необхідно спочатку добре вимити пробірку. Для цього в пробірці кип’ятять (обережно!) протягом 1-2 хв. близько 5 мл 10 % розчину гідроксиду натрія, а потім обмивають її дистильованою водою. У вимитій пробірці готують амоніачний розчин гідроксиду срібла: до 2-3 мл 1 % розчину нітрату аргентуму додають по краплям при струшуванні 5 % розчин амоніаку до тих пір, доки утворений спочатку осад повністю не розчиниться. Надлишок аміаку в розчині знижує чуттєвість реакції. До отриманого безкольорового розчину додають декілька крапель 5 % розчину формальдегіду та опускають пробірку на декілька хвилин у водяну баню з температурою води 60-70ºС. На стінках пробірки поступово виділяється шар срібла у вигляді дзеркала, іноді срібло виділяється у вигляді темного осаду.
Напишіть рівняння реакцій: утворення амоніачного розчину гідроксиду аргентуму і окиснення ним формальдегіду до мурашиної кислоти. Підберіть коефіцієнти. Чи вступає в цю реакцію ацетон (та другі кетони)?
б) Окиснення формальдегіду гідроксидом купруму(II).
В пробірку наливають 2 мл 5% розчину формальдегіду, 2 мл 10% розчину гідроксиду натрію та при струшуванні додають по краплям 2% розчин сульфат купруму(II) до появи незникаючого вапна. Верхню частину рідини нагрівають до початку кипіння. Блакитне забарвлення змінюється на жовте (осад), а потім на червоне (осад). Ця реакція, як і реакція «срібного дзеркала», є якісною реакцією на альдегіди.
Які сполуки міді мають блакитне, жовте і червоне забарвлення? Напишіть рівняння реакції окиснення формальдегіду гідроксидом купруму(II) до мурашиної кислоти. Підберіть коефіцієнти.
Дослід 46. Реакції конденсації і осмолення альдегідів.
Реактиви: оцтовий альдегід, 10% розчин гідроксиду натрію, сечовина, 35-40% розчин формальдегіду (формалін) – нейтралізований, щавлева кислота (насичений розчин), 25% розчин амоніаку.
Обладнання: водяні бані, термометри, кип’ятильники.
а) Альдольна та кротонова конденсація оцтового альдегіду.
Осмолення оцтового альдегіду. В пробірку наливають 3 мл 10% розчину гідроксиду натрію, додають 5-6 крапель оцтового альдегіду та суміш нагрівають. Спочатку утворюється альдоль (він має приємний запах), потім насичений кротоновий альдегід, що має різкий запах. (Нюхати обережно!) При тривалому нагріванні рідина стає бурою, утворюється смола.
Напишіть рівняння реакції альдольної і кротонової конденсації оцтового альдегіду та розгляньте механізм цих реакцій (в лужному середовищі). Які продукти отримуються при конденсації пропіонового і триметилоцтового альдегідів?
НАСИЧЕНІ ОДНООСНОВНІ КАРБОНОВІ КИСЛОТИ
ТА ЇХ ПОХІДНІ
Дослід 47. Розчинність насичених карбонових кислот у воді та в органічних розчинниках.
Реактиви: карбонові кислоти: мурашина, оцтова, масляна (або ізомасляна), стеаринова (або пальмітинова), діетиловий ефір (або бензол).
В пробірки вносять по 0,5 г кислот: мурашиної, оцтової, масляної, стеаринової і додають по 2 мл води. Вміст пробірок збовтують; якщо кислота не розчиняється, пробірку нагрівають. Після охолодження відмічають розчинність у воді взятих для досліда кислот.
Дослід повторюють, але в якості розчинника використовують ефір (або бензол). Відмічають результати в робочому журналі.
Дослід 48. Порівняння сили карбонових і мінеральних кислот.
Реактиви: 0,1 н. розчини кислот: мурашиної, оцтової, масляної (або ізомасляної), соляної (у крапельницях), універсальний індикаторний папір зі шкалою рН.
На смужку індикаторного паперу наносять по краплі розчинів органічних кислот і соляної кислоти. За допомогою шкали визначають рН цих розчинів. Результати досліду записують у робочому журналі.
Дослід 49. Одержання й властивості мурашиної кислоти.
Реактиви: мурашина кислота (або форміат натрію), хлороформ, 10% розчин гідроксиду натрію, 1% розчин нітрату арґентуму, 5% розчин амоніаку, концентрована сульфатна кислота, вапняна вода, оксид хрому (V1).
Обладнання: водяна баня, вигнуті газовідвідні трубки, піпетки, зворотні холодильники до пробірок.
в) Окислювання мурашиної кислоти перманганатом калію.
У пробірку поміщають приблизно 0,5 г мурашиної кислоти або її солі, 0,5 мл 10% розчину сульфатної кислоти й 1 мл 5% розчину сульфатної кислоти й 1 мл 5% розчину КМnО4. Пробірку закривають пробкою з газовідвідною трубкою, кінець якої опускають в іншу пробірку з 2 мл вапняної (або баритової) води, і нагрівають реакційну суміш.
Які зміни в пробірках ви спостерігаєте? Напишіть рівняння реакцій і підберіть коефіцієнти.
г) Окиснювання мурашиної кислоти оксидом хрому (V1). (Тяга!).
У пробірку поміщають близько 1 г оксиду хрому (V1) і 2,5 мл мурашиної кислоти. Через кілька хвилин починається енергійна реакція, реакційна суміш закипає. Відзначте зміну забарвлення реакційної суміші.
Напишіть рівняння реакції окиснювання мурашиної кислоти оксидом хрому (V1), підберіть коефіцієнти.
д) Розкладання мурашиної кислоти при нагріванні з концентрованою сульфатною кислотою. (Тяга!).
У суху пробірку вносять 1 мл мурашиної кислоти або 1 г її солі й 1 мл концентрованої сульфатної кислоти. Пробірку закривають пробкою з газовідвідною трубкою й обережно нагрівають. Мурашина кислота розкладається з утворенням оксиду карбону(ІІ) і води. Оксид карбону(ІІ) підпалюють біля отвору газовідвідної трубки. Зверніть увагу на характер полум'я.
Після закінчення роботи пробірку з реакційною сумішшю необхідно остудити, щоб припинити виділення отрутного СО. Напишіть рівняння реакції розкладання мурашиної кислоти в умовах описаного досліду.
Дослід 53. Естери органічних кислот. Реакція естерифікації. Гідроліз естерів.
Реактиви: етиловий спирт, крижана оцтова кислота, концентрована сульфатна кислота, 20% розчин сульфатної кислоти, насичений 30 та 10% розчин гідроксиду натрію, ізоаміловий спирт, етилацетат.
Обладнання: водяні бані, термометри, зворотні холодильники до пробірок.
б) Одержання ізоамілацетату (грушевої есенції).
У сухій пробірці змішують 2 мл ізоамілового спирту, 2 мл крижаної оцтової кислоти й 1 краплю концентрованої сульфатної кислоти. Пробірку з'єднують зі зворотним холодильником. Реакційну суміш нагрівають у киплячій водяній бані 8-10 хв., після чого охолоджують і виливають у пробірку з холодною водою. Естер (ізоамілацетат) спливає. Зверніть увагу на його запах. Пари ізоамілацетату викликають подразнення дихальних шляхів, вони можуть викликати кашель, тому нюхати ізоамілацетат потрібно обережно.
Напишіть рівняння реакції утворення ізоамілацетату (грушевої есенції).
в) Гідроліз естерів. Вплив умов реакції на швидкість гідролізу етилацетату.
У три пробірки наливають по 2-3 мл етилацетату. В одну з них додають 1 мл води, в іншу – 1 мл 20% розчину сульфатної кислоти, у третю – 1 мл концентрованого (30%) розчину гідроксиду натрію. Пробірки закривають пробками зі зворотними холодильниками. Реакційні суміші перемішують струшуванням, після чого поміщають пробірки на 5-10 хв. у водяну баню (температура води в бані 65-75 С).
Після закінчення досліду порівнюють, наскільки зменшився об’єм етилацетату в кожній пробірці, і роблять висновок про швидкості гідролізу його в нейтральному, кислому й лужному середовищах.
Напишіть рівняння реакцій гідролізу етилацетату в різних середовищах. Чому гідроліз у лужному середовищі – реакція необоротна?
54 А). Розчинність жирів та олій в органічних розчинниках.
В чотири пробірки наливають по 2 краплини соняшникової олії і додають по 2 мл органічного розчинника: в першу пробірку – етиловий спирт, в другу – діетиловий ефір, в третю – хлороформ, в четверту – чотири хлористий карбонат. Вміст всіх пробірок енергійно струшують.
В яких розчинниках олія розчинилась? Результат досліду записати в журнал.
Пробірку, в якій утворилась емульсія, закривають пробкою зі зворотнім холодильником, нагрівають на водяній бані до початку кипіння і струшують.
Чи збільшується розчинність олії при нагріванні?
55 А) Взаємодія рослинної олії з водним розчином перманганату калію (реакція е.Е. Вагнера).
В пробірку наливають приблизно 0,5 мл соняшникової олії, 1 мл 10% розчину карбонату натрію і 1 мл 2% розчину перманганату калію. Енергійно струшують вміст пробірки. Фіолетове забарвлення перманганату калію зникає.
Напишіть рівняння реакції дипальмітоолеїну з перманганатом калію у водному середовищі та підберіть коефіцієнти.
55 Б) Утворення акролеїну при термічному розкладі жиру. (Тяга!)
В суху пробірку поміщають небагато кристалічного гідросульфату калію і 1 крапля соняшникової олії розтопленого твердого жиру (баранячого, свинячого, яловичого). Пробірку нагрівають спочатку обережно, потім сильно. Суміш обвуглюється, з пробірки виділяються пари води и леткі продукти розкладу жиру, в тому числі і ті, що мають різкий характерний запах акролеїну СН2=СН-СНО.
Напишіть рівняння реакції гідролізу тригліцериду. При дегідратації якої сполуки утворюється акролеїн? Напишіть рівняння реакції утворення акролеїну.
55Омилення жиру спиртовим розчином гідроксиду натрію.
В конічну колбу ємкістю 50-100 мл поміщають 1,5-2 г твердого жиру і приливають 6 мл 15% спиртового розчину гідроксиду натрію. Колбу закривають пробкою з повітряним холодильником, перемішують реакційну суміш і нагрівають колбу на водяній бані при струшуванні протягом 10-12 хв. (температура води в бані близько 80 °С). Для визначення кінця реакції декілька крапель гідролізату виливають в 2-3 мл гарячої дистильованої води: якщо гідролізат розчиняється повністю, без виділення крапель жиру, то реакцію можна вважати закінченою. Після закінчення омилення гідролізату висолюють мило додаванням 6-7 мл гарячого насиченого розчину хлориду натрію. Мило, що виділилось, спливає, утворюючи на поверхні розчину шар. Після відстоювання суміш охолоджують холодною водою, затверділе мило відділяють.
Напишіть рівняння реакції омилення тристеаріну гідроксидом натрію. Назвіть продукти реакції.
Двоосновні кислоти
Дослід 61. Одержання й властивості оксалатної кислоти.
Реактиви: кристалічна оксалатна кислота, вапняна (або баритова) вода, концентрована та 10% сульфатна кислота, 5% розчин перманганату калію.
Обладнання: пробірки, пробка з вигнутою газовідвідною трубкою, штатив.
г) Розкладання оксалатної кислоти при нагріванні.
У суху пробірку вносять приблизно 1 г кристалічної оксалатної кислоти. Пробірку закривають пробкою з вигнутою газовідвідною трубкою й закріплюють у лапці штатива. Кінець газовідвідної трубки опускають у пробірку з вапняної (або баритової) водою. При нагріванні оксалатна кислота розкладається з виділенням оксиду карбону(IV), що виявляють за помутнінням вапняної води.
Напишіть рівняння реакцій: розкладання оксалатної кислоти при нагріванні, взаємодії оксиду карбону(IV) з вапняною водою.
д) Розкладання оксалатної кислоти при нагріванні з концентрованою сульфатною кислотою. (Тяга!)
У суху пробірку поміщають близько 1 г оксалатної кислоти (C2H2O4·2H2O) і 1-2 мл концентрованої сульфатної кислоти. Пробірку закривають пробкою з газовідвідною трубкою, кінець якої опускають в іншу пробірку, що містить вапняну воду. Реакційну суміш обережно нагрівають, оксалатна кислота розкладається, вапняна вода каламутніє. Після цього виймають газовідвідну трубку із пробірки з вапняною водою й біля отвору її підпалюють іншу газоподібну речовину – CO. Оксид карбону(II) горить характерним полум'ям – блакитними спалахами.
Напишіть рівняння реакцій: розкладання оксалатної кислоти при нагріванні з концентрованою сульфатною кислотою, взаємодії оксиду карбону(IV) з вапняною водою й горіння оксиду карбону(II).
е) Окиснювання оксалатної кислоти перманганатом калію.
У пробірку наливають 3-4 мл 5% розчину перманганату калію, 1-2 мл 10% розчину сульфатної кислоти й 1 мл насиченого розчину оксалатної кислоти. Пробірку з'єднують із газовідвідною трубкою, кінець якої опускають у пробірку з вапняною водою. Реакційну суміш обережно нагрівають.
Як змінюється забарвлення реакційної суміші й що відбувається в пробірці з вапняною водою? Напишіть рівняння реакції окиснювання оксалатної кислоти перманганатом калію в кислому середовищі й підберіть коефіцієнти.
Дослід 62. Малонова кислота. Малоновий естер.
Реактиви: малонова кислота, вапняна вода.
Обладнання: пробірки, пробка з вигнутою газовідвідною трубкою.
а) Декарбоксилювання малонової кислоти.
У суху пробірку вносять близько 0,5 г малонової кислоти. Пробірку закривають пробкою з вигнутою газовідвідною трубкою, кінець якої опущений в іншу пробірку з вапняною водою. При нагріванні малонова кислота декарбоксилюється з утворенням оксид карбону(IV), який виявляють реакцією з вапняною водою.
Напишіть рівняння реакції термічного розкладання малонової кислоти. Яке практичне значення має здатність малонової кислоти декарбоксилюватися при нагріванні?
Дослід 65. Властивості винної кислоти
Реактиви: 5, 10%, 1 н розчин тартратної кислоти, 1 н. розчин гідроксиду калію, 10% розчин сульфатної кислоти, 5%розчин сульфіду купруму, 15% розчин гідроксиду натрію, 35% розчин сегнетової солі (змішаної натрієво-калієвої солі тартратної кислоти) або двозаміщеної (середньої) солі тартратної кислоти, 5% розчин хлориду кальцію, 10% розчин амоніаку, лакмусовий папір (червоний).
Обладнання: бюретки.
а) Утворення калієвих солей тартратної кислоти.
Наливають у пробірку з бюретки 2 мл 1 н. розчину тартратної кислоти й з іншої бюретки додають 1 мл 1н. розчину гідроксиду калію. При струшуванні випадає мілкокристалічний осад білого кольору. Якщо осад не випадає, стінки пробірки потирають скляною паличкою. Потім продовжують додавати з бюретки 1 н. розчин гідроксиду калію до повного розчинення осаду (при струшуванні). Напишіть рівняння реакцій і поясніть дослід. До половини розчину по краплях додають10% розчин сірчаної кислоти. Знову з'являється осад або каламуть, що зникають при додаванні надлишку сульфатної кислоти. Напишіть рівняння реакції.
б) Взаємодія солі тартратної кислоти з гідроксидом купруму(ІІ)
До 1 мл 35% розчину сегнетової солі (змішаної натрієво-калієвої солі тартратної кислоти ) додають 1 мл 15% розчину гідроксиду натрію й при струшуванні по краплях додають 5% розчин сульфату купруму(ІІ). Від кожної краплі спочатку виходить осад блакитних кольорів – гідроксид купруму(ІІ), при струшуванні він розчиняється. Утвориться інтенсивно забарвлений розчин волошкових кольорів. Тартратна кислота містить дві гідроксильні групи й здатна в лужному розчині утворювати комплексні сполуки типу алкоголятів з гідроксидом купруму(ІІ) подібно багатоатомним спиртам (див. дослід 37). Лужний розчин комплексної сполуки двовалентноого купруму із сіллю тартратної кислоти називають фелінговою рідиною. Вона легко окиснює багато альдегідів. Фелінгову рідину широко використовують для якісного й кількісного аналізу цукрів, що відновлюють.
Напишіть рівняння реакцій: утворення гідроксиду купруму(ІІ) і взаємодії сегнетової солі з гідроксидом купруму(ІІ).
Дослід 66. Властивості лимонної (цитратної) кислоти
Реактиви: лимонна кислота (кристалічна), 5% розчин лимонної кислоти, 5% розчин хлориду кальцію, 10% розчин амоніаку, конц. сульфатна кислота, вапняна (або баритова) вода (насичений розчин), розчин йоду в йодиді калію, 10% розчин гідроксиду натрію, лакмусовий папір (червоний).
Обладнання: вигнуті газовідвідні трубки.
а) Одержання цитрату кальцію.
Наливають у пробірку 1 мл 5% розчину лимонної кислоти й додають по краплях 10% розчин амоніаку до нейтральної реакції по лакмусу. Після цього доливають 1 мл 5%розчину хлориду кальцію й обережно нагрівають реакційну суміш до кипіння. Випадає осад цитрату кальцію. Ця сіль у гарячій воді розчиняється гірше, ніж у холод: при кип'ятінні розчину вона випадає, при охолодженні знову розчиняється.
Напишіть рівняння реакції утворення цитрату кальцію (середньої солі).
б) Розкладання лимонної кислоти при нагріванні з концентрованою сульфатною кислотою. (Тяга!)
У суху пробірку з вигнутою газовідвідною трубкою поміщають близько 1 г кристалічної лимонної кислоти, доливають 2 мл концентрованої сульфатної кислоти, потім укріплюють пробірку в лапці штатива. Обережно нагрівають реакційну суміш. Підпалюють біля отвору газовідвідної трубки оксид карбону(ІІ), він горить характерним блакитнуватим полум'ям. Потім опускають кінець газовідвідної трубки в пробірку з вапняною водою й по помутнінню її виявляють оксид карбону(IV). Після цього опускають кінець газовідвідної трубки в пробірку, де перебуває заздалегідь підготовлений лужний розчин йоду (до 2 мл розчину йоду в йодиді калію по краплях додають 10% розчин гідроксиду натрію до майже повного знебарвлення розчину йоду). Утворюється осад йодоформу, що має специфічний запах.
Напишіть рівняння реакції розкладання лимонної кислоти при нагріванні її з концентрованою сульфатною кислотою, оксиду карбону(ІІ) і води. Ацетонова кислота при нагріванні декарбоксилюється з утворенням ацетону й оксиду карбону(IV).
Напишіть рівняння реакції. Напишіть також рівняння реакції утворення йодоформу з ацетону.
Дослід 67. Одержання піровіноградної кислоти окиснюванням молочної кислоти.
Реактиви: 5% розчин молочної кислоти, 1% розчин перманганату калію, 10% розчин карбонату натрію, 10% розчин гідроксиду натрію, оцтова кислота, гідросульфат натрію (насичений розчин), 10% розчин нітропрусиду натрію, лакмусовий папір (червоний).
Обладнання: фільтрувальний папір, хімічні лійки.
У пробірку наливають 2 мл 5% розчин молочної кислоти й додають по краплях при струшуванні 10% розчин карбонату натрію до нейтральної реакції по лакмусу. Потім доливають 1 мл 1% розчину перманганату калію й суміш нагрівають до кипіння. В умовах досліду молочна кислота окиснюється до піровіноградної кислоти.
Напишіть рівняння реакції.
Вміст пробірки фільтрують і у фільтрі виявляють піровіноградну кислоту якісними реакціями на карбоксильну групу.
АМІНИ АЛІФАТИЧНОГО РЯДУ
Дослід 70. Одержання амінів.
Реактиви: ацетамід, етиловий спирт, бром, концентрований розчин гідроксиду натрію, натрій металевий.
Обладнання: водяна бані, колби Вюрца (50-100 мл), водяні холодильники, алонжі, вигнуті газовідвідні трубки, склянки (100 мл), лід.
а) Одержання метиламіну з ацетаміда. (Тяга!)
У колбу Вюрца ємністю 50-100 мл вносять 1 г ацетаміду, 4 мл води й 1 мл брому. (Обережно!). При струшуванні в суміш доливають по краплях концентрований розчин гідроксиду натрію до зникнення забарвлення брому, а потім ще такий же обєм NaOH. При цьому колбу охолоджують у бані. Через 10-15 хв. у реакційну суміш опускають кип'ятильники, приєднують водяний холодильник з алонжем і відганяють метиламін у пробірку, що містить 1-2 мл води. Пробірку І – приймач занурюють у склянку із крижаною водою, кінець алонжа повинен бути опущений у воду на 0,5 см. Колбу Вюрца насухо витирають і потім нагрівають на азбестовій сітці (рис. 3). Перегонку припиняють, коли об’єм рідини в пробірці І – приймачі збільшується в 3-4 рази. Звертають увагу на різкий запах метиламіну. Напишіть рівняння реакції одержання метиламіну з ацетаміду (перегрупування Гофмана, 1879 р.).
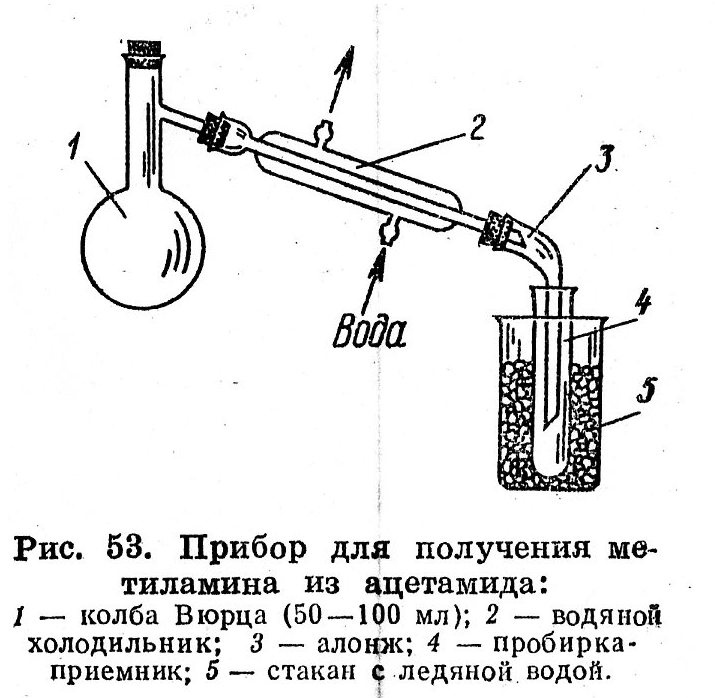
Рис. 3. Прилад для одержання метиламіну з ацетаміду: 1 – колба Вюрца (50-100 мл); 2 – водний холодильник; 3 – алонж; 4 – пробірка-приймач; 5 – склянка з льодяною водою
МОНОСАХАРИДИ
Дослід 77. Реакції на гідроксильні групи в моносахаридах.
Реактиви: глюкоза (безводна), 1% розчин глюкози, 1% розчин фруктози, 10% і 20% розчини глюкози, ацетат натрію (безводний), оцтовий ангідрид, 10% розчин гідроксиду натрію, 5% розчин сульфату міді, вапняне молоко (свіжоприготовлена 10-15% суспензія гідроксиду кальцію у воді), бензоїлхлорид.
Обладнання: водні бані, термометри (100°С), апарат Кіппа (для одержання СО2), хімічні лійки, фільтрувальний папір, піпетки, склянки (100 мл), лід, зворотні холодильники до пробірок, мікроскоп, предметні й покривні стекла.
а) Реакція моносахаридів з лужним розчином гідроксиду купруму(ІІ).
У пробірці змішують 2 мл 1% розчини глюкози й 1 мл 10% розчину гідроксиду натрію, потім по краплях додають 5% розчину сульфату купруму. Спочатку утворенийблакитний осад, с гідроксиду купруму(ІІ) при струшуванні розчиняється, виходить синій прозорий розчин комплексного алкоголята (сахарату) купруму(ІІ).
Ця реакція доводить присутність у молекулі глюкози декількох гідроксильних груп; вона характерна для багатоатомних спиртів (дивися дослід 37). Дослід повторюють, але замість глюкози використовують 1% розчин фруктози.
Напишіть рівняння реакції глюкози з гідроксидом купрумом(ІІ).
б) Реакція моносахаридів з гідроксидом кальцію.
До 2 мл 20% розчину глюкози додають по краплях при струшуванні вапняне молоко. Гідроксид кальцію розчиняється утворенням глюкозату кальцію. Додають надлишок взмученого вапняного молока: у пробірці повинен бути осад, що не зникає при струшуванні. Через 5 хв. відфільтровують 1 мл розчину й через прозорий фільтрат пропускають повільний потік оксиду карбону(ІV) з апарата Кіппа. Виділяється осад карбонату кальцію. При тривалому пропусканні оксиду карбону(ІV) осад може розчинитися (утворюється гідрокарбонат кальцію).
Напишіть рівняння наступних реакцій: утворення глюкозату кальцію й взаємодії його з оксидом карбону(ІV).
в) Одержання пентаацетилглюкози. (Тяга!).
У сухій пробірці змішують 1 г безводної глюкози з 1 г безводного ацетату натрію. До суміші додають 5 мл оцтового альдегіду, вміст пробірки перемішують скляною паличкою. Пробірку закривають пробкою зі зворотним холодильником і при струшуванні обережно нагрівають на пальнику 5-10 хв. Пробірку прохолоджують на повітрі, після чого виливають реакційну суміш у склянку, що містить близько 25 мл води з льодом. Суміш ретельно перемішують. Незабаром починають виділятися кристали пентаацетил-глюкози. Через 10 хв. частину кристалів відфільтровують, промивають на фільтрі невеликою кількістю крижаної води, висушують між аркушами фільтрувального паперу. Розглядають кристали пентаацетилглюкози під мікроскопом і замальовують їх.
Напишіть рівняння реакції ацілювання глюкози оцтовим ангідридом.
Дослід 78. Реакції на карбонільні групи в моносахаридах.
Реактиви: 1% розчин глюкози, 1% розчин фруктози, 2% розчин глюкози, 2% розчин фруктози, 10% розчин глюкози, 10% розчин формальдегіду, фуксинсульфітна кислота, 5% розчин сульфату міді, 10% розчин гідроксиду натрію, реактив Фелінга, бромна вода (насичена), 1% розчин хлориду феруму(ІІІ), 1% розчин фенолу, 1% розчин нітрату аргентуму, 5% розчин глюкози, розчин ацетатнокислого фенілгідразилу.
Обладнання: водяної лазні, термометри (100°С), мікроскоп, піпетки, предметні й покривні стекла.
а) Реакції фуксинсульфітной кислоти з формальдегідом і глюкозою.
У дві пробірки наливають по 1,5 мл розчину фуксинсульфітной кислоти. В одну пробірку доливають 1,5 мл 10% розчину формальдегіду, в іншу – 1,5 мл 10% розчину глюкози. Вміст пробірки перемішують. Через якийсь час у пробірці з формальдегідом з'являється фіолетове – рожеве забарвлення. Розчин, що містить глюкозу, залишається безбарвним.
Чому глюкоза (і інші моносахариди) не дає деяких реакцій на карбонільні групи? Наприклад, вона не реагує з фуксинсульфітною кислотою й з гідросульфітом натрію.
б) Окиснювання моносахаридів гідроксидом купруму(ІІ) у лужному середовищі.
У пробірці змішують 3 мл 1% розчини глюкози й 1,5 мл 10% розчину гідроксиду натрію. Потім при струшуванні додають 5% розчин сульфату купруму до появи не зникаючої при струшуванні каламуть. Надлишок гідроксиду купруму(ІІ) заважає реакції, тому що при нагріванні він втрачає воду й перетворюється в оксид купруму CuО чорних кольорів. Якщо ж гідроксид купруму(ІІ) занадто мало, то не зв'язана їм глюкоза при нагріванні смоляніє, продукти смоління темних кольорів також маскують реакцію. Вміст пробірки нагрівають до початку кипіння, так, щоб нагрівалася лише верхня частина розчину, а нижня залишалася для контролю. У нагрітій частині розчину з'являється жовтий осад гідроксиду купруму(І), що незабаром переходить у червоний осад оксиду купруму(І). Дослід повторюють, але замість глюкози беруть 1% розчин фруктози.
В умовах досліду однаково легко окисляються гідроксидом купруму(ІІ) і альдози (глюкоза), і кетози (фруктоза). Пояснюється це тим, що при нагріванні з окиснювачем у лужному середовищі вуглецеві ланцюги молекул моносахаридів розщеплюються, при цьому утворюється суміш речовин, у тому числі таких, що окиснюється (формальдегід, мурашина кислота й ін.). Серед продуктів окиснювання глюкози виявлена також глюконова (одноосновна) кислота.
Напишіть рівняння реакції окиснювання глюкози в глюконову кислоту гідроксидом купруму(ІІ).
в) Окиснювання моносахаридів реактивом Фелінга.
Наливають у дві пробірки по 1,5-2 мл розчинів моносахаридів: в одну пробірку – 1% розчин глюкози, в іншу – 1% розчин фруктози. Потім у кожну пробірку додають рівний об’єм реактиву Фелінга, вміст пробірок перемішують і нагрівають верхню частину розчину до кипіння, що починається. У верхній частині рідини в обох пробірках з'являється жовтий осад гідроксиду купруму(І), що переходить у червоний осад оксиду купруму(І), нижня частина рідини, що не нагрівали, залишається синьої.
Реактивом Фелінга користуватися зручніше, ніж гідроксидом купруму(ІІ), тому що при нагріванні суміші його з розчином моносахариду не відбувається утворення чорного осаду оксиду купруму(ІІ), що маскує червоні кольори осаду оксиду купруму(І). Реакція з фелінговою рідиною протікає швидше й більш чітко. Цією реакцією широко користуються для якісного й кількісного аналізу моносахаридів, для розпізнання дисахаридів, що відновлюють, від тих що не відновлюють.
Що таке реактив Фелінга? Яку будову має цей реактив і як його готують? Напишіть рівняння реакції окиснювання глюкози в глюконову кислоту реактивом Фелінга.
г) Окиснювання моносахаридів амоніачним розчином оксиду аргентуму (реакція «срібного дзеркала»).
Спочатку готують амоніачний розчин гідроксиду аргентуму (див. дослід 44, а) з 4-5 мл 1% розчину нітрату аргентуму. Амоніачний розчин гідроксиду срібла ділять навпіл. До однієї частини його доливають 1,5 мл 1% розчину глюкози, до інший 1,5 мл 1% розчину фруктози. Обидві пробірки нагрівають 5-10 хв. на водяній бані, нагрітої до 70-80°С. Металеве срібло в обох пробірках виділяється на стінках у вигляді дзеркального нальоту. Під час нагрівання пробірки не можна струшувати, інакше металеве срібло виділиться не на стінках пробірки, а у вигляді темного осаду. Щоб одержати гарне дзеркало, у пробірках попередньо кип'ятять 10% розчин гідроксиду натрію, потім їх споліскують дистильованою водою.
При окиснюванні моносахаридів у лужному середовищі, як уже було сказано вище (див. дослід 78, б), виходить суміш продуктів, що утворюються при глибокому розщепленні їхніх молекул. Серед продуктів окислювання глюкози знайдена й альдонова (одноосновна) глюконова кислота.
Напишіть рівняння реакцій: утворення амоніачного розчину гідроксиду арґентуму й окиснювання D-глюконової кислоти амоніачним розчином гідроксиду арґентуму.
Дослід 79. Смоління моносахаридів.
Реактиви: 10% розчин глюкози, 30-40% розчин гідроксиду натрію, 10% розчин сульфатної кислоти.
Обладнання: кип'ятильники.
У пробірці змішують 1 мл 10% розчину глюкози й 1 мл концентрованого (30-40%) розчину гідроксиду натрію, вносять у суміш кип'ятильники й кип'ятять її протягом 2-3 хв. При виконанні досліду необхідно бути обережним: реакційна суміш кипить поштовхами, її може викинути із пробірки. Рідина в пробірці набуває жовтий, потім бурий кольори. Після охолодження її підкисляють 10% розчином сульфатної кислоти, при цьому забарвлення блідне й з'являється запах паленого цукру.
При нагріванні з концентрованим розчином лугу моносахариди смоляться й окиснюються, утворюється складна суміш речовин. У ній містяться продукти полімеризації й конденсації сполук, що виходять при розпаді моноз, а також знайдені молочна й мурашина кислоти. Продукти осмолення містять вільні гідроксильні групи, цим пояснюється їхня розчинність у воді.
Дослід 80. Кольорові реакції на моносахариди.
Реактиви: 1% розчин глюкози, 1% розчин фруктози, 2% розчин глюкози, 2% розчин фруктози, 0,1, 1% розчин арабіинози (або іншої пентози), 5% розчин меду, реактив Селіванова, хлоридна кислота, розведена водою в об'ємному відношенні 1:1, анілін, оцтова кислота, етиловий спирт, концентрована сульфатна кислота, 5% спиртовий розчин α-нафтолу, анілінфталатний реактив, орциновий реактив, аміловий спирт.
Обладнання: піпетки, фільтрувальний папір, водяні бані, термометри.
а) Реакція Селіванова на кетогексози.
У дві пробірки наливають по 2 мл реактиви Селіванова (розчин резорцину в розведеній хлоридній кислоті), потім в одну пробірку додають 2 краплі 1% розчину фруктози, а в іншу – 2 краплі 1% розчину глюкози. Обидві пробірки одночасно поміщають у водяну баню з температурою води 80°С и витримують при цій температурі протягом 8 хв. Порівнюють забарвлення розчинів у пробірках із глюкозою й із фруктозою. Поясніть дослід.
б) Виявлення фруктози в меді.
Повторюють дослід 80 (а), але замість розчину фруктози використовують 5% розчин меду.
в) Реакція Панова на фруктозу.
Дослід проводять паралельно з розчинами фруктози й глюкози.
У дві пробірки наливають по 0,5 мл 2% розчинів моноз і по 5 мл суміші етилового спирту з концентрованою сульфатною кислотою. Потім у пробірки доливають по 2-3 краплі 5% спиртового розчину α-нафтолу. Рідини перемішують і нагрівають на киплячій водяній бані 5-8 хв. У пробірці із фруктозою з'являється інтенсивне фіолетове забарвлення. Глюкоза в умовах досліду забарвлення не дає.
г) Кольорова реакція з анілінфталатом.
У пробірку наливають 1 мл 1% розчину глюкози й додають 2 краплі анілінфталатного реактиву. Суміш струшують і нагрівають у киплячій водяній бані. Через 3-5 хв розчин забарвлюється в яскраво-коричневі кольори. Реакцію повторюють із 1% розчином арабінози (або іншої пентози). Альдопентози дають вишнево-червоне забарвлення.
д) Реакція на пентози з оцтовоокислим аніліном.
У пробірку поміщають кілька крупинок арабінози (або іншої пентози) і доливають 2 мл розчину хлоридної кислоти (1:1). На смужку фільтрувального паперу наносять 1-2 краплі аніліну й 1-2 краплі оцтової кислоти. Потім цей папірець підносять до отвору пробірки із сумішшю арабінози із хлоридною кислотою й кип'ятять реакційну суміш. Через 1-2 хв на папері з'являється яскрава рожево-червона пляма.
При нагріванні пентоз із хлоридною кислотою відбувається їхня дегідратація й утворення фурфуролу. Фурфурол конденсується з аніліном з утворенням забарвлених сполук.
Напишіть рівняння реакції дегідратації (утворення фурфуролу) L- арабінози.
е) Відкриття пентоз орциновим реактивом (реакція Біаля). Змішують у пробірці 1 мл 0,1% розчину арабінози з 2 мл орцинового реактиви. Суміш кип'ятять 1-2 хв. З'являється синьо-зелене забарвлення. Після охолодження в пробірку додають 0,5 мл амілового спирту й енергійно струшують вміст пробірки. Забарвлені речовини екстрагуються аміловим спиртом.
При нагріванні в кислому середовищі пентози дегідратуються й перетворюються у фурфурол, що конденсується з орцином (5-метилрезорцином) у присутності слідів хлориду заліза(III). Продукти конденсації забарвлені. Гексози (глюкоза, фруктоза й ін.) з орциновим реактивом дають коричневе забарвлення.
Дисахариди
Дослід 81. Реакції на гідроксильні групи дисахаридів.
Реактиви: 1% розчин сахарози, 1% розчин лактози (або мальтози), 20% розчин сахарози, вапняне молоко (свіжоприготовлене), 10% розчин гідроксиду натрію, 5% розчин сульфату купруму, лактоза (безводна), ацетат натрію (безводний), оцтовий ангідрид.
Обладнання: склянки (25, 50 і 100 мл), мірні циліндри (10 мл), хімічні лійки, фільтрувальний папір, лід.
а) Одержання сахарата кальцію.
У невелику склянку (25-50 мл) наливають 5-7 мл 20% розчину сахарози й по краплях при перемішуванні додають свіжоприготовлене вапняне молоко. Гідроксид кальцію розчиняється в розчині сахарози. Потім доливають надлишок вапняного молока (3-4 мл), перемішують реакційну суміш скляною паличкою й залишають її на 5-7 хв. Потім відфільтровувають у пробірку розчин, у якому містяться розчинені на холоді сахарати кальцію. При нагріванні фільтрату до кипіння випадає дрібний-кристалічний осад сахаратів кальцію.
При охолодженні реакційної суміші в склянці з льодяною водою осад знову розчиняється. Здатність сахарози давати розчинні сахарати кальцію використовується в промисловості для очищення цукру при виділенні його із цукрового буряка.
б) Реакція дисахаридів з гидроксидом купруму(ІІ) у лужному розчині.
У пробірці змішують 1,5 мл 1% розчину сахарози й 1,5 мл 10% розчину гідроксиду натрію. В іншій пробірці змішують такі ж кількості 1% розчину лактози (або мальтози) і 10% розчину лугу. Потім у кожну пробірку по краплях додають 5% розчин сульфату купруму. Блідо-блакитний осад гідроксида купруму(ІІ), що утворюється спочатку, при струшуванні розчиняється, розчини набувають синювате забарвлення внаслідок утворення комплексних сахаратів купруму(ІІ).
Напишіть рівняння реакції утворення моносахарата купруму(ІІ) при взаємодії сахарози з гидроксидом купруму(ІІ). Який висновок можна зробити із цього досліду?
в) Одержання октаацетиллактози. (Тяга!)
Змішують у сухій пробірці 1 мл безводної лактози з 1 мл безводного ацетату натрію, додають 5 мл оцтового ангідриду. Нагрівають суміш протягом 5 хв. при безперервному струшуванні. Охолоджують пробірку на повітрі й виливають реакційну суміш у склянку з водою і льодом при ретельному перемішуванні.
Напишіть рівняння реакції ацилування лактози оцтовим ангідридом (одержання октаацетиллактози).
Дослід 82. Реакції дисахаридів по карбонільних групах (порівняння властивостей дисахаридів, що відновлюються і невідновлюються).
Реактиви: 1% розчин сахарози, 1, 5% розчин мальтози, 1, 5% розчин лактози, реактив Фелінга, оцтова кислота, 10% розчин гідроксида натрію, 40% розчин гідроксида натрію, молоко, розбавлене водою в об'ємному відношенні 1:1, розчин оцтовокислого фенілгідразина, фенолфталеїновий індикаторний папір.
Обладнання: хімічні склянки (25 мл), хімічні лійки, фільтрувальний папір, мірні циліндри (10 мл), кип’ятильник, мікроскопи, предметні й покривні скельця, водяна баня.
а) Реакція дисахаридів з реактивом Фелінга.
У три пробірки наливають по 1,5-2 мл 1% розчинів сахарози, мальтози й лактози. Потім у кожну пробірку додають однаковий об’єм реактиву Фелінга, рідини перемішують і нагрівають у полум'ї пальника верхню частину розчинів до початку кипіння. Нижня частина розчинів не повинна нагріватися.
Чи у всіх пробірках з'являється червоний осад оксиду купруму(І)? Поясните результати досліду. Напишіть рівняння реакцій з гідроксидом купруму(І) для тих дисахаридів, які дають позитивну реакцію з реактивом Фелінга.
б) Виявлення лактози в молоці.
У невелику хімічну склянку (ємністю 25 мл) наливають 5-7 мл молока, розбавленого водою (1:1), і додають до нього краплі оцтової кислоти при перемішуванні суміші скляною паличкою. У кислому середовищі білок згортається й випадає у вигляді пластівців.
Осад відфільтровують і відкидають, а фільтрат нейтралізують 10% розчином гідроксиду натрію до слабо-лужної реакції по індикаторному фенолфталеїновому папірцю. Розчин лугу додають по краплях при перемешуванні рідини скляной паличкою. Відливають 2 мл одержаного лужного розчину, додають до нього 2 мл реактиву Фелінга, суміш перемішують і нагрівають верхню частину розчину до початку кипіння.
Чи міняється забарвлення розчину? Пояснити дослід і написати рівняння реакції.
в) Осмолення дисахаридів, що відновлюють.
У три пробірки наливають по 1,5 мл 1% розчинів мальтози, лактози й сахарози. У кожну пробірку додають рівний об’єм 40% розчину гідроксиду натрію, вносять кип’ятильники й потім кип'ятять отримані розчини декілька хвилин. (Обережно, лужні рідини киплять поштовхами!!!) У пробірках з дисахаридами, що відновлюють (мальтозою й лактозою) розчини здобувають буре забарвлення, розчин сахарози не змінюється.
При нагріванні дисахаридів, що відновлюють, з концентрованим розчином лугу утворюється складна суміш продуктів – відбувається осмолення ( див. дослід 79).
Дослід 83. Гідроліз (інверсія) сахарози.
Реактиви: 1% розчин сахарози, 10% розчин сульфатної кислоти, реактив Фелінга, реактив Селіванова, гідрокарбонат натрію (сухий).
Обладнання: водяна баня, термометри (100º С).
У пробірку наливають 3 мл 1% розчин сахарози й додають 1 мл 10% розчину сульфатної кислоти. Отриманий розчин кип'ятять протягом 5 хв., потім охолоджують і ділять на дві частини. Половину розчину нейтралізують сухим гідрокарбонатом натрію, додаючи його невеликими порціями при перемішуванні. (Обережно, рідина спінюється від оксиду, що виділяється) Після нейтралізації (коли припиниться виділення СО2) доливають рівний об’єм реактиву Фелінга й нагрівають верхню частину рідини до початку кипіння.
Чи змінюється забарвлення реакційної суміші?
В іншій пробірці нагрівають суміш 1,5 мл 1% розчину сахарози з рівним об’ємом реактиву Фелінга. Порівнюють результати досліду – реакцію сахарози з реактивом Фелінга до й після гідролізу.
Пояснити процес. Напишіть рівняння реакції гидроліза сахарози.
Другу половину гідролізату сахарози використовують для виявлення фруктози (кетози) реакцією Селіванова (див. дослід 80, а). Паралельно проводять реакцію Селіванова з розчином негідролізованої сахарози.
Порівнюють забарвлення розчинів у двох пробірках. Пояснити.
Дослід 84. Реакція сахарози із сульфатами нікелю й кобальту.
Реактиви: 10% розчин сахарози, 5% розчин сульфату кобальту, 5% розчин сульфату нікелю, 5% розчин гідроксиду натрію.
У дві пробірки наливають по 2-5 мл 10% розчину сахарози й по 1 мл 5% розчину гідроксиду натрію. Потім в одну пробірку додаю краплі 5% р-ну сульфату кобальту, в іншу – краплі 5% р-ну сульфату нікелю. У пробірці із сіллю кобальту з'являється фіолетове забарвлення, а із сіллю нікелю – зелене.
Дослід 85. Тонкошарова хроматографія вуглеводів на закріпленому шарі силікагелю.
Реактиви: силікагель марки КСК, гіпс, 1% розчини вуглеводів (глюкози, фруктози, арабінози, сахарози, мальтози, лактози), анілінфталатний реактив, розчинник для хроматографії (етанол – амоніак - вода в об'ємному співвідношенні 16:1:3).
Обладнання: порцелянові ступки, капіляри для хроматографії, скляні пластинки (1-18 см), камери для хроматографії, пульверизатори, термостат (100-105оС), циліндри мірні (25 мл).
У порцеляновій ступці ретельно перемішують 6 г силікагелю, 0,35 г гіпсу й 15 мл води. Отриману пасту наносять на скляну пластинку, потім її сушать при кімнатній температурі 6-12 год. або 40 хв. при температурі 104-106оС.
На суху пластинку на лінію старту капілярами наносять 1% розчини цукрів на відстані 3-4 см від нижнього краю пластинки й 2 см один від одного (для кожного цукра повинен бути окремий капіляр). Діаметр плями не повинен перевищувати 3-5 мм. Усього наносять чотири крапки: у три крапки – індивідуальні цукри, а в четверту - їхню суміш. Спочатку вносять розчин одного цукру (наприклад, глюкози). Коли пляма висохне, у те ж місце наносять розчин іншого цукру (сахарози) і т.д. Хроматографують висхідним способом, поміщаючи пластинку в закриту камеру під кутом 15-20о. Розчинник наливають безпосередньо в камеру. Поділ цукрів проводять у системі етанол - амоніак - вода (16:1:3). Пластинку висушують на повітрі (тяга!), потім обприскують із пульверизатора проявником (анілінфталатним реактивом) і витримують у термостаті при 105оС протягом 5-10 хв. Розраховують коефіцієнти рухливості (Rf) для використаних у досліді цукрів.
ВИЩІ ПОЛІСАХАРИДИ
Дослід 86. Якісні реакції на вуглеводи.
Реактиви: крохмаль (або целюлоза), сахароза (або глюкоза), 15% спиртовий розчин £-нафтолу, концентрована сульфатна кислота, реактив Фелінга, 1% крохмальний клейстер, 1% розчин глікогену, розведений розчин йода в йодиді калію (яскраво-жовтого кольору), соляна кислота (1:1), анілін, крижана оцтова кислота.
Обладнання: піпетки, тирса (суха), вигнуті газовідвідні трубки, фільтрувальний папір, хімічні склянки (100 мл), лід.
а) Реакція вуглеводів з -нафтолом (реакція Моліша).
У дві пробірки наливають по 1 мл води й вносять дуже невелику кількість вуглеводів: в одну пробірку – сахарозу (або глюкозу), в іншу – крохмаль (або целюлозу). Потім у кожну пробірку додають 1-2 краплі 15% спиртового розчину -нафтолу й, нахиливши пробірку, по стінках з піпетки обережно доливають по 1 мл концентрованої сульфатної кислоти. Утворюються два шари: знизу – сульфатна кислота, зверху – водний шар. Через невеликий проміжок часу на границі двох шарів з'являється забарвлене кільце, спочатку зеленуватого кольору, потім фіолетове.
Реакція з £-нафтолом – якісна реакція на вуглеводи. При взаємодії з концентрованою сульфатною кислотою вуглеводи розкладаються, поряд з іншими продуктами розкладання утвориться фурфурол і його похідні; вони конденсуються з -нафтолом з утворенням забарвлених продуктів.
Напишіть рівняння реакції дегідратації D-глюкози (з утворенням оксиметилфурфуролу).
б) Реакція вищих полісахаридів з реактивом Фелінга.
У дві пробірки наливають по 1-1,5 мл 1% крохмального клейстера й 1% розчину глікогену й додають рівний об’єм реактиву Фелінга. Рідини перемішують і нагрівають верхню частину розчинів до початку кипіння.
Чи змінюється забарвлення розчинів? Поясните дослід.
в) Реакція з йодом.
У дві пробірки наливають по 1 мл 1% розчинів крохмального клейстеру й глікогену й потім додають по трохи капель сильно розведеного водою розчину йода в йодиді калію. У пробірці з розчином крохмалю з'являється інтенсивне синє забарвлення. При нагріванні цього розчину до кипіння синє забарвлення зникає, при охолодженні розчину знову з'являється. Глікоген з розчином йода дає червоно-буре забарвлення.
Йодокрохмальна реакція застосовується в аналітичній хімії для відкриття як крохмалю, так і йода. Крохмаль широко застосовується як індикатор в йодометрії.
г) Реакція на пентозани (утворення фурфуролу). (Тяга!).
У пробірку вносять суху тирсу (висота шару 1-1,5 см) і додають хлоридну кислоту (1:1) у такій кількості, щоб вона покрила ошурки. На смужку фільтрувального паперу наносять 1-2 краплі аніліну й 1-2 краплі крижаної оцтової кислоти (у ту ж пляму). Змочену ацетатнкислим аніліном фільтрувальний папір підносять до отвору пробірки й кип'ятять суміш ошурок із хлоридною кислотою. Фурфурол, що втримується в парах, утворює на папері яскраву рожево-червону пляму. Для відгону фурфуролу, летучого з водяною парою, пробірку закривають вигнутою газовідвідною трубкою, її кінець опускають у порожню пробірку-приймач, охолоджувану в склянці із крижаною водою. Відганяють краплі водної емульсії фурфуролу. У пробірку-приймач додають каплю аніліну й 1 краплю крижаної оцтової кислоти. З'являється забарвлення.
Пояснити дослід і написати рівняння наступних реакцій: гідроліз пентозанів, дегідратація пентоз (утворення фурфуролу).
Дослід 87. Кислотний гідроліз крохмалю.
Реактиви: 1% крохмальний клейстер, 10% розчин сульфатної кислоти, розведений розчин йода в йодиді калію (яскраво-жовтого кольору), 10% розчин гідроксиду натрію, індикаторний фенолфталеїновий папір, реактив Фелінга.
Обладнання: конічні колби (50 мл), піпетки, мірні циліндри (50 і 10 мл), порцелянові чашки.
У конічну колбу ємністю 50 мл наливають 20-25 мл 1% крохмального клейстеру й 3-5 мл 10% розчину сульфатної кислоти. В 7-8 пробірок наливають по 1 мл дуже розведеного розчину йода в йодиді калію (яскраво-жовтого кольору), пробірки ставлять у штатив. У першу пробірку вносять 1-3 краплі підготовленого для досвіду розчину крохмалю. Відзначають утворене забарвлення. Потім колбу нагрівають на азбестовій сітці невеликим полум'ям пальника. Через 30 с після початку кипіння відбирають піпеткою другу пробу з розчином йода, після струшування відмічають колір розчину. Надалі відбирають проби розчину через кожні 30 с і вносять їх у наступні пробірки з розчином йода. Відзначають поступову зміну забарвлення розчинів при реакції з йодом. Зміна забарвлення відбувається в наступному порядку (див табл.)
Таблиця
Номер проби |
Забарвлення |
1 |
Синя |
2 |
Синьо-фіолетова |
3 |
Червоно-фіолетова |
4 |
Червонясто-бура |
5 |
Жовтогаряча |
6 |
Оранжево-жовта |
7 |
Жовта (колір иода) |
Після того як реакційна суміш перестане давати забарвлення з иодом, суміш кип'ятять ще 2-3 хвилини, після чого неї прохолоджують і нейтралізують 10%-процентним розчином гидроксида натрію, додаючи його по краплях до лужної реакції середовища (поява рожевого забарвлення на фенолфталеїновому індикаторному паперу).
Частина лужного розчину переливають у пробірку, змішують із рівним об’ємом реактиву Фелінга й нагрівають верхню частину рідини до початку кипіння.
Чи випадає червоний осад купруму(І)? Напишіть рівняння реакції гідролізу крохмалю, укажіть проміжні й кінцевий продукти. Пояснити, чому в процесі гідролізу змінюється забарвлення гідролізату з йодом.
Дослід 88. Властивостей целюлози.
Розчини: мідно-амоніачний розчин, гігроскопічна вата (целюлоза), конц. сульфатна кислота, 5% розб. розчин амоніаку, розчин амоніаку, реактив Фелінга, 40% розчин гідроксиду натрію, 10% розчин хлоридної кислоти, конц. нітратна кислота, хлороформ, суміш етилового спирту й диетилового ефіру (1:3), оцтовий ангідрид, крижана оцтова кислота, ацетон.
Обладнання: пробірки, скляні палички, смуги фільтрувального паперу, водяна баня, склянка на 25 мл або порцелянова чашка, конічна колба (50 мл), лійка Бюхнера, годинникове скло.
а) Розчинення целюлози в мідно-амоніачному розчині (реактив Швейцера).
У пробірку наливають 5 мл мідно-амоніачного розчину (реактиву Швейцера), опускають у нього дуже маленький шматочок гігроскопічної вати (целюлози) і ретельно перемішують вміст пробірки скляною паличкою до повного розчинення вати. Виходить грузла прозора рідина яскраво-синього кольору. Її виливають тонким струменем у склянку, що містить близько 100 мл теплої води, підкисленої 2-3 мл концентрованою сульфатною кислоти. Целюлоза виделяється з розчину у вигляді пластівців. Здатність целюлози розчинятися в реактиві Швейцера використовують при виробництві мідно-амоніачного штучного шовку.
б) Одержання рослинного пергаменту (амілоїда).
У три порцелянові чашки наливають: у першу – 80% розчин сульфатної кислоти, у другу – 5% розчин амоніаку, у третю - воду. У розчин сульфатної кислоти опускають на 8-10 с середню частину смуги фільтрувального паперу (103 см), сухі кінці паперу тримають у руках. Надлишок кислоти швидко зливають у ту ж порцелянову чашку, промивають ділянку паперу, оброблену кислотою, у воді, налитої в другу чашку. Потім нейтралізують залишки кислоти розбавленим розчином амоніаку. Просушують отриманий рослинний пергамент між аркушами фільтрувального паперу й порівнюють вид і міцність обробленої кислотою ділянки паперу з необробленим. Наносять краплю розведеного розчину йоду на оброблену кислотою ділянку паперу.
Яке виходить забарвлення?
в) Кислотний гідроліз целюлози.
У суху конічну колбу ємністю 50-100 мл поміщають багато дуже дрібно нарізаних шматочків фільтровального паперу (целюлози) і змочують їх концентрованою сульфатною кислотою. Ретельно перемішують вміст колби скляною паличкою до повного руйнування паперу й утворення безбарвного грузлого розчину. Після цього до нього додають невеликими порціями при перемішуванні 15-20 мл води (обережно!), колбу з'єднують із повітряним зворотним холодильником і кип'ятять реакційну суміш 20-30 хв, перемішуючи її періодично. Після закінчення гідролізу відливають 2-3 мл рідини, нейтралізують її сухим карбонатом натрію, додаючи його невеликими порціями (рідина спінюється), і виявляють присутність цукрів, що відновлюють, реакцієй з реактивом Фелінга.
Напишіть рівняння реакції гідролізу целюлози й поясніть дослід.
г) Реакція целюлози з лугом.
У невелику склянку наливають 40% розчин гідроксиду натрію й опускають у нього смужку фільтрувального паперу. Другу смужку такого ж розміру опускають у склянку з водою (контрольний зразок). Через 5-7 хв смужки паперу виймають. Зразок, що був у воді, віджимають у фільтрувальному папері. Другий зразок – зі склянки з розчином гідроксиду натрію – промивають водою (у склянці або порцеляновій чашці), потім 10% розчином хлоридної кислоти й знову водою. Промиту смужку віджимають у фільтрувальному папері. Коли обидві паперові смужки висохнуть, порівнюють їхню довжину й щільність.
При обробці целюлози концентрованими розчинами лугів утворюється "лужна целюлоза" (алкаліцелюлоза). У розчині лугу целюлоза сильно набухає, її волокна стають товще й коротше. Оброблена лугом смужка паперу (або тканини) робиться більше щільної й короткої в порівнянні з контрольної. У текстильній промисловості обробку лугом бавовнянопаперових тканин і ниток проводять із метою облагороджування (мерсерізація) їхнього покращення якості.
д) Одержання й властивості нітратів целюлози. (Тяга!)
У невелику колбу наливають 4 мл концентрованої нітратної кислоти й обережно при розмішуванні додають 8 мл концентрованої сульфатної кислоти. Суміш, що розігрілася, трохи охолоджують і занурюють у неї за допомогою скляної палички невелику грудочку гігроскопічної вати. Реакційну суміш періодично перемішують паличкою й нагрівають на водяній бані (температура води 60-70º С) протягом 5 хв. Потім вату виймають і ретельно промивають водою спочатку в склянці, а потім у струмені води під водопровідним краном. Надлишок води віджимають у фільтрувальному папері, вату розпушують і висушують у порцеляновій чашці на киплячій водяній бані. В умовах досліду виходить переважно динітрат целюлози – колоксилін.
Напишіть схему утворення динітрата целюлози (фрагмент молекули целюлози напишіть по Хеуорсу). Чому часто вживана назва "нітроцелюлоза" невірна?
Висушений волокнистий нітрат целюлози (світло-жовтого кольору) ділять на три частини. Одну частину кладуть на азбестову сітку й підпалюють. Поруч підпалюють шматок гігроскопічної вати (целюлози). Відзначають різницю в характері горіння цих двох зразків.
Другу частину колоксилінової вати поміщають на дно сухої пробірки й нагрівають її в полум'ї пальника. Колоксилін при нагріванні розкладається з вибухом і вилітає із пробірки. (Обережно! Отвір пробірки поверніть до стіни.)
Третю частину колоксиліну розчиняють при примішуванні паличкою у суміші етилового спирту й диетилового ефіру (1:3). Утвориться грузлий розчин - колодій. Частина колодія виливають на предметне скло; після випару розчинника залишається тверда плівка. Її вносять тигельними щипцями в полум'я пальника. Плівка колодія згоряє повільніше, ніж колоксилінова вата.
е) Одержання й властивості триацетату целюлози. (Тяга!)
У склянку ємністю 25 мл або в порцелянову чашку поміщають невеликий шматочок гігроскопічної вати (приблизно 0,4 г), заливають його водою й витримують у ній 3-5 хв. Потім вату виймають із води, віджимають у фільтрувальному папері, розскубують і занурюють невеликими порціями при розмішуванні скляною паличкою у конічну колбочку (50 мл), у якій перебуває суміш 5 мл оцтового ангідриду, 5 мл крижаної оцтової кислоти й 1-2 краплі концентрованої сульфатної кислоти (каталізатора). При внесенні в колбу вологої вати відбувається розігрівання реакційної суміші, тому колбу прохолоджують у бані з холодною водою. Коли саморозігрівання суміші припиниться (через 5-10 хв), колбу поміщають у нагріту водяну баню й ретельно перемішують реакційну суміш скляною паличкою до повного розчинення целюлози. Отриманий розчин виливають тонким струменем при перемішуванні в склянку з 250 мл холодної води. Випадає ацетат целюлози у вигляді пластівців. Їх відсмоктують на лійці Бюхнера, промивають водою, розскубують і сушать у порцеляновій чашці на киплячій водяній бані. Сухий ацетат целюлози являє собою аморфну масу, що легко розтирається в порошок. В умовах досліду виходить переважно триацетат целюлози.
Напишіть рівняння реакції одержання триацетату целюлози (формулу фрагмента молекули целюлози напишіть по Хеуорсу).
Частину сухого ацетату целюлози переносять у пробірку з 2 мл ацетону. Пробірку закривають пробкою зі зворотним холодильником і при перемішуванні нагрівають суміш у водяній бані до кипіння (Обережно!) і витримують при слабкому кипінні приблизно 2 хв. Отриманий розчин зливають із осаду на годинне скло й дають ацетону випаруватися. Чи утворюється на склі плівка?
Іншу частину сухого ацетату целюлози розчиняють при слабкому нагріванні в 1-2 мл хлороформу. Отриманий грузлий розчин виливають на скляну пластинку (1010 см) і залишають у горизонтальному положенні для висушування (у витяжній шафі). Щоб зняти плівку, що вийшла, скло обережно поливають водою. Потім плівку висушують між аркушами фільтрувального паперу й шматочок її вносять щипцями в полум'я пальника. Чи легко вона загоряється? Яке практичне значення мають ацетати целюлози?
Дослід 89. Деякі властивості бавовняни і штучних волокон.
Реактиви: конц. нітратна кислота, 25% розчин сульфатної кислоти, 10% розчин гідроксиду натрію, ацетон, віскозне, ацетатне, бавовняне волокно.
Обладнання: пробірки, азбестову сітку, лучинка.
а) Наливають у чотири пробірки по 1,5-2 мл: концентрованої нітратної кислоти, 25% розчину сульфатної кислоти, 10% розчину гідроксиду натрію, ацетону. У кожну пробірку опускають невеликий шматочок віскозного волокна (або тканини). Розмішують вміст пробірки скляною паличкою протягом 2-3 хв. Результати досліду записують у таблицю.
Дослід повторюють зі зразками: б) ацетатного й в) бавовняного волокна. Чи можна чистити плаття з віскозного і ацетатного шовку ацетоном?
Для визначення відношення волокон до нагрівання розташовують зразки досліджуваних волокон на азбестову сітку й підпалюють їх лучинкою. (Тяга!) Результати записують у таблицю:
Таблиця
Волокно |
Відношення до дії |
Характер горіння |
|||
HNO3 конц. |
25% H2SO4 |
10% NaOH |
Ацетону |
||
Бавовняне |
|
|
|
|
|
Віскозне |
|
|
|
|
|
Ацетатне |
|
|
|
|
|
