
- •1. Контрольная задача № 1
- •2. Контрольная задача № 2
- •2.1. Исходные данные
- •Исходные данные для расчета процессов 1-2 и 2-3
- •2.2. Объем задания
- •2.1. Адиабатный процесс
- •2.2. Изобарный процесс
- •2.3. Изохорный процесс
- •2.4. Изотермический процесс
- •3. Контрольная задача № 3
- •2.4. Контрольная задача № 4
- •Для теоретического курса
- •Для практических занятий
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ПОВОЛЖСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра физики
РАСЧЕТ ПОЛИТРОПНЫХ ПРОЦЕССОВ
СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
Методические указания и задания для выполнения контрольной работы
№ 1 по дисциплине “Теплофизика”
Йошкар-Ола 2012
КОНТРОЛЬНЫЕ ЗАДАНИЯ_ТТД
В объем контрольных заданий входит 4 задачи.
1. Контрольная задача № 1
Провести расчет двух последовательно протекающих процессов изменения состояния смеси идеальных газов и изобразить эти процессы в Р,v– и T,s– диаграммах.
Исходные данные:
Состав смеси (химические формулы трех компонентов смеси идеальных газов).
Массовая или объемная доля одного из компонентов смеси.
Одна из характеристик смеси газов: молекулярная масса смеси, газовая постоянная смеси, изохорная или изобарная теплоемкости смеси.
Некоторые термические параметры в начальном и конечном состоянии каждого из указанных процессов или одна из характеристик процесса (показатель политропы, теплота процесса, работа изменения объема, изменение внутренней энергии, энтальпии).
Варианты задания приведены в табл. 1.1 и 1.2.
Таблица 1.1
Исходные данные для расчета характеристик смеси идеальных газов
-
№
Состав смеси
Доля одного из компонентов
Одна из характеристик смеси
1
2
3
4
1
CH4, CO2, N2
 =
0,3
=
0,3см = 30 кг/кмоль
2
CO2, O2, C2H2
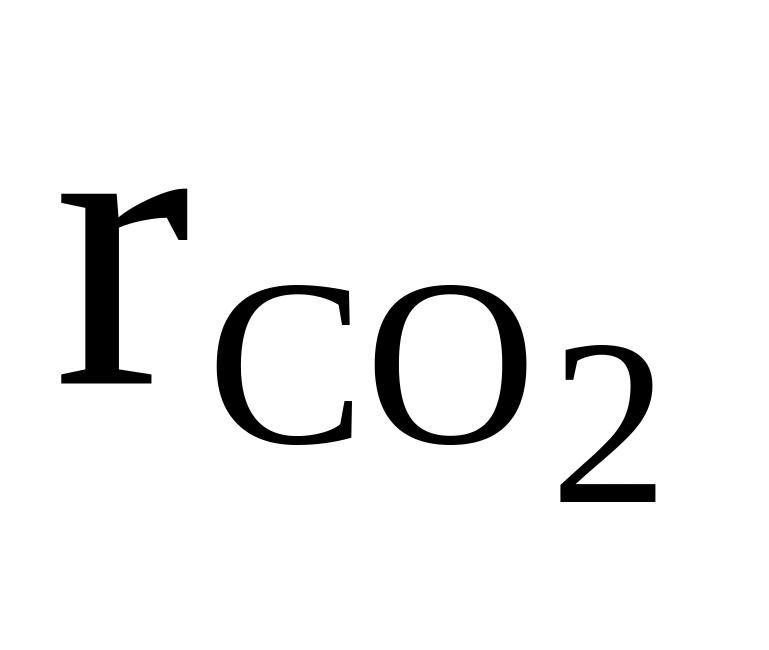 =
0,4
=
0,4cр,см = 31500 Дж/(кмольК)
3
NH3, N2, C2H2
 =
0,3
=
0,3cv,см = 23000 Дж/(кмольК)
4
NH3, SO2, CO
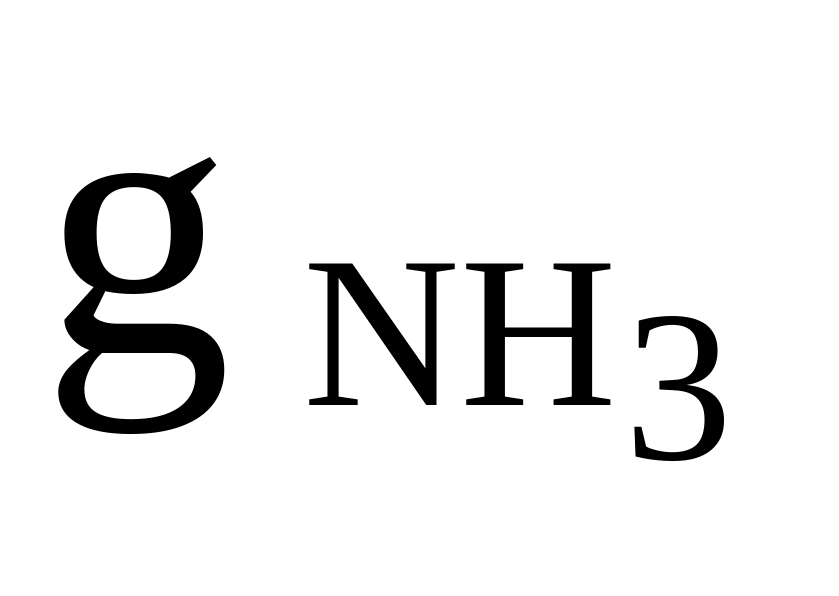 = 0,2
= 0,2Rсм = 280 Дж/(кгК)
5
CO, CH4, O2
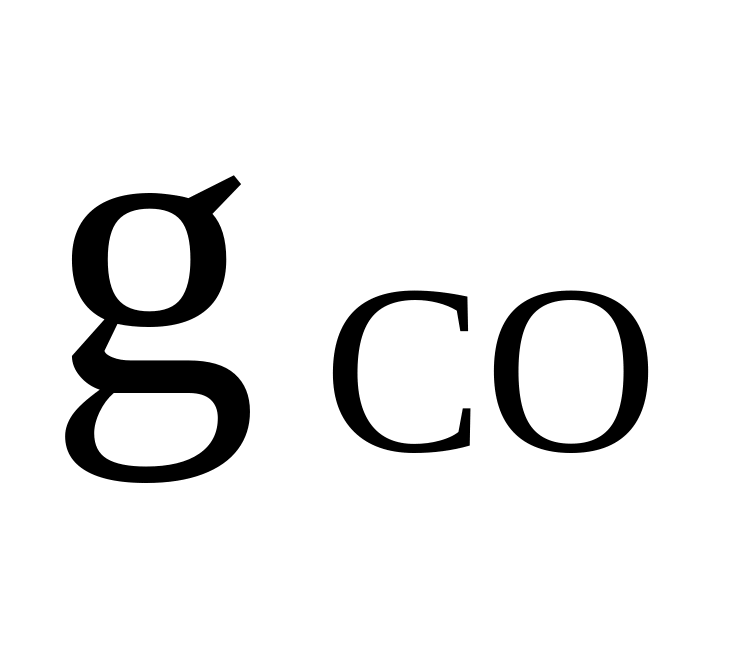 = 0,35
= 0,35cр,см = 1500 Дж/(кгК)
6
CH4, C2H6, N2
 = 0,15
= 0,15cv,см = 900 Дж/(кгК)
7
CO, CH4, O2
 =
0,25
=
0,25см = 25 кг/кмоль
8
C2H6, CO2, N2
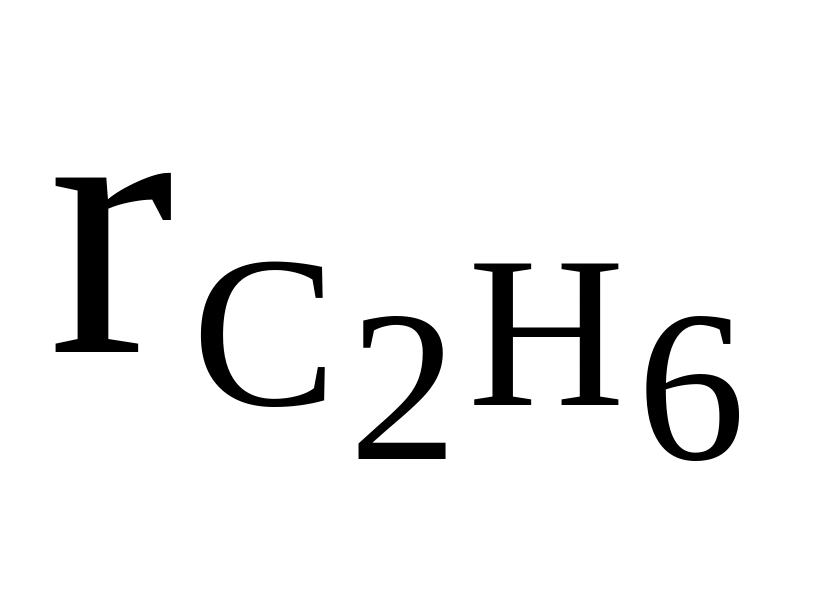 =
0,4
=
0,4cр,см = 32000 Дж/(кмольК)
9
Ne, NH3, N2
 =
0,45
=
0,45cv,см = 18000 Дж/(кмольК)
10
CO2, O2, CO
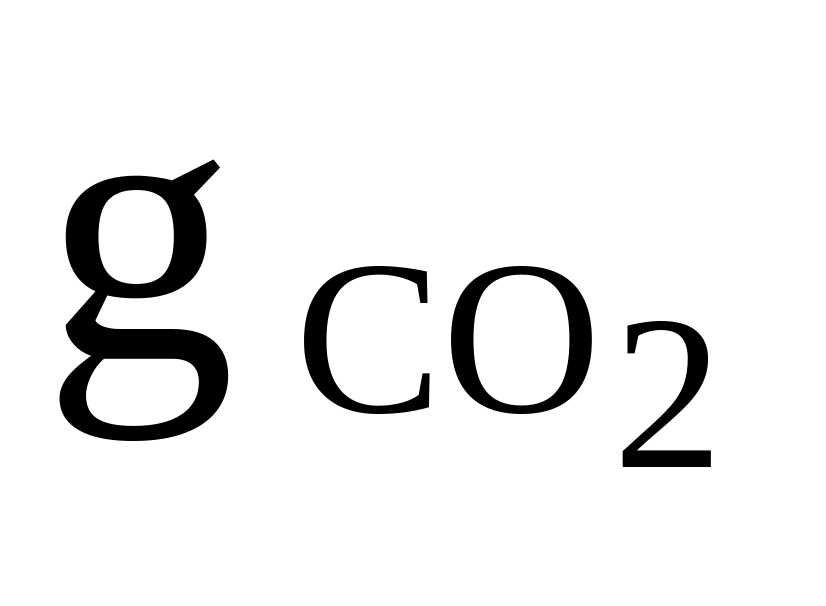 = 0,3
= 0,3Rсм = 250 Дж/(кгК)
11
CO2, C2H4, CO
= 0,45
cр,см = 950 Дж/(кгК)
Продолжение таблицы 1.1
-
1
2
3
4
12
O2, CH4, C2H6
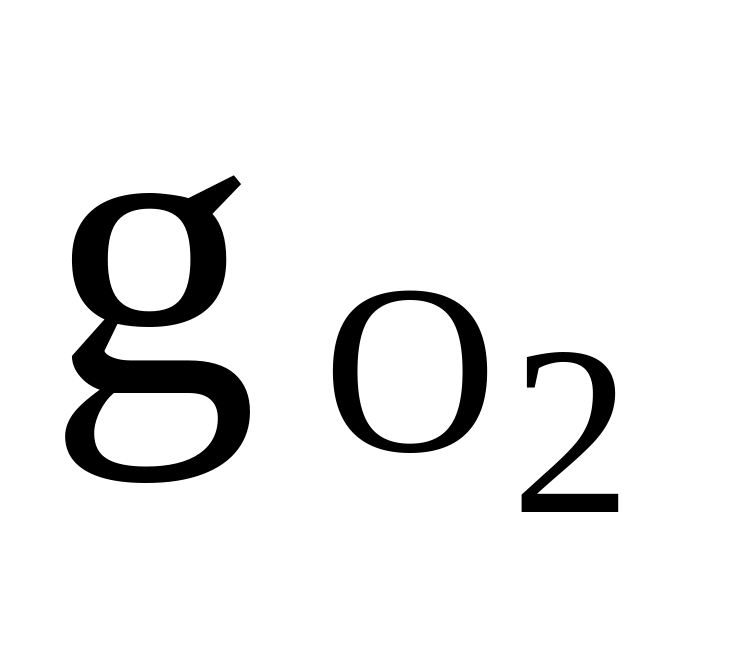 = 0,4
= 0,4cv,см = 1000 Дж/(кгК)
13
O2, C2H2, CH4
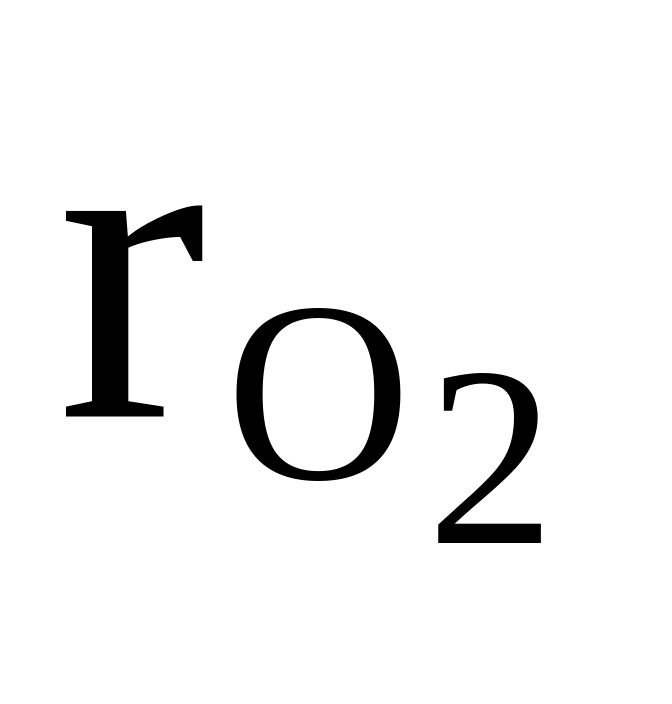 =
0,4
=
0,4см = 25 кг/кмоль
14
He, C2H6, CO
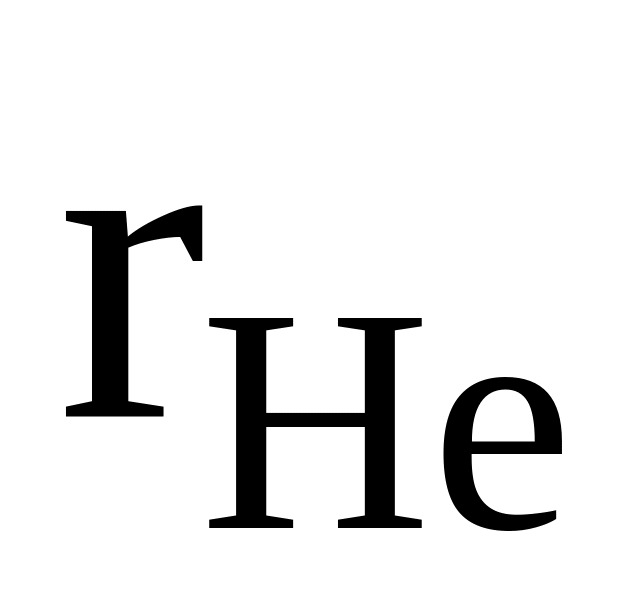 =
0,6
=
0,6cр,см = 25000 Дж/(кмольК)
15
CH4, Ne, NH3
= 0,35
cv,см = 20000 Дж/(кмольК)
16
N2, CO2, O2
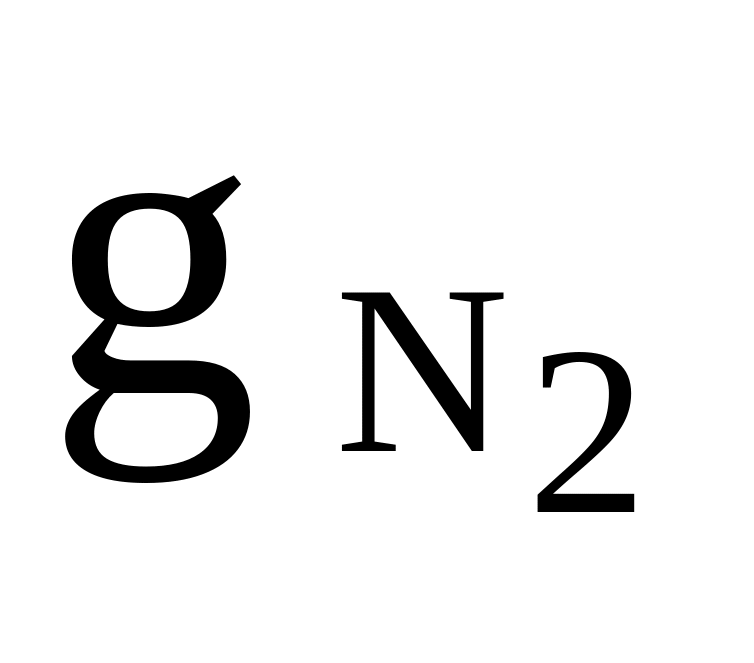 = 0,4
= 0,4Rсм = 260 Дж/(кгК)
17
O2, CO, CO2
= 0,2
cр,см = 900 Дж/(кгК)
18
C2H4, O2, CH4
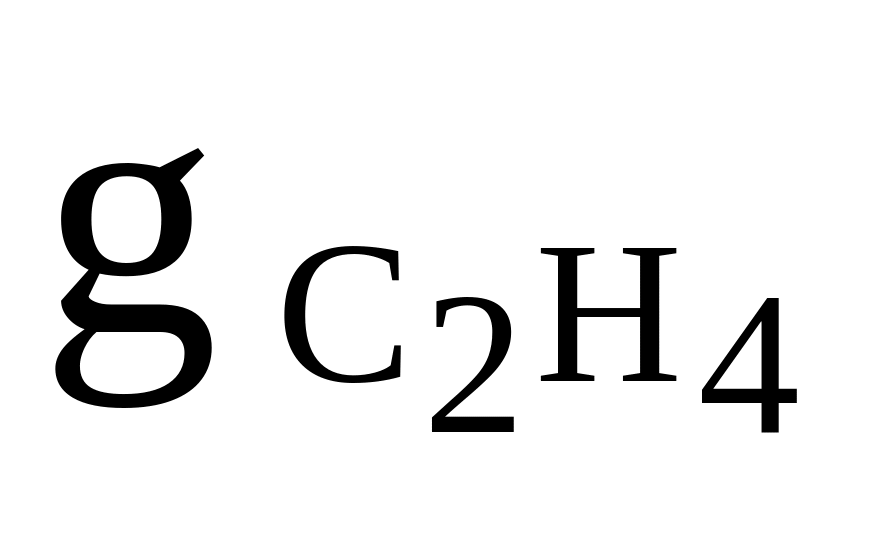 = 0,3
= 0,3cv,см = 950 Дж/(кгК)
19
NH3, O2, CO
= 0,5
см = 23 кг/кмоль
20
CH4, He, C2H6
= 0,55
cр,см = 29000 Дж/(кмольК)
21
CO, CH4, Ne
= 0,5
cv,см = 19000 Дж/(кмольК)
22
C2H2, N2, CO2
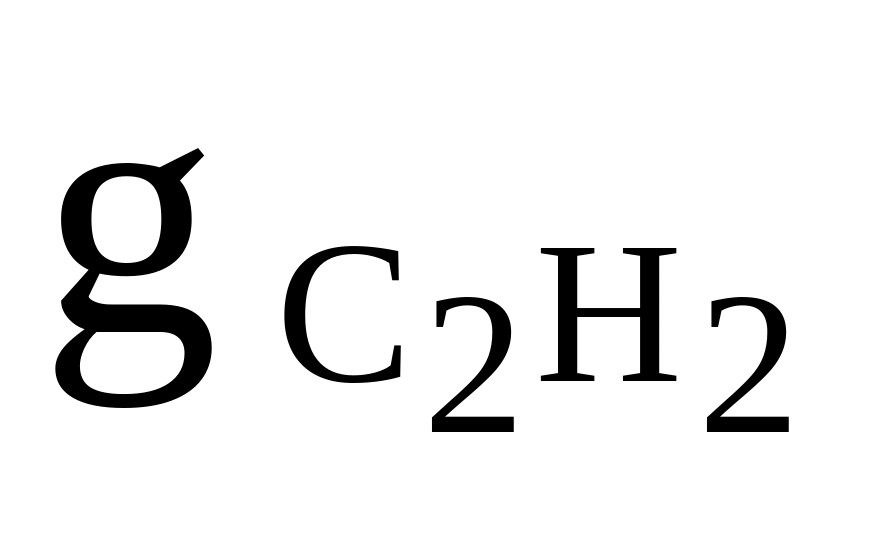 = 0,25
= 0,25Rсм = 255 Дж/(кгК)
23
CH4, O2, C2H4
= 0,3
cр,см = 1350 Дж/(кгК)
24
Ar, C2H4, O2
 = 0,25
= 0,25cv,см = 680 Дж/(кгК)
25
SO2, CO2, He
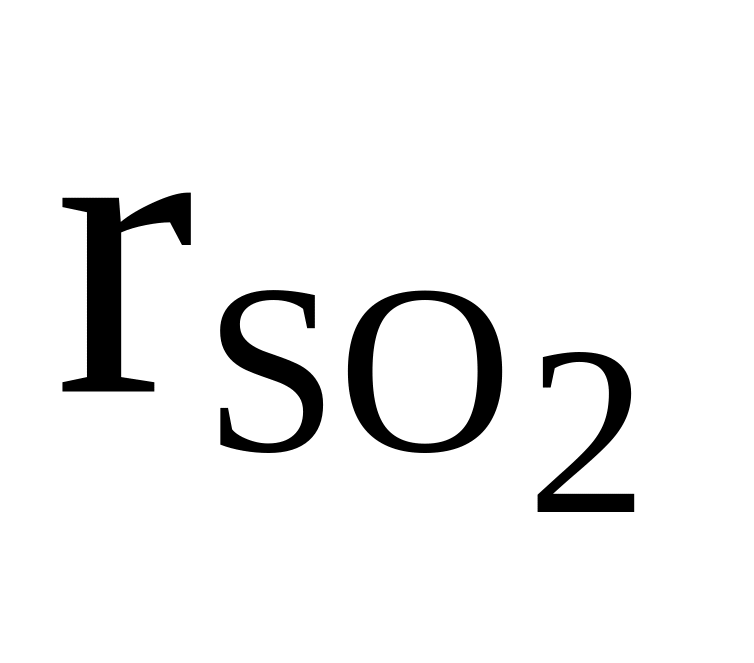 =
0,2
=
0,2см = 21 кг/кмоль
26
Ar, SO2, CO
 =
0,14
=
0,14cр,см = 29200 Дж/(кмольК)
27
CO2, CO, CH4
= 0,4
cv,см = 24000 Дж/(кмольК)
28
Ar, C2H2, N2
= 0,45
Rсм = 265 Дж/(кгК)
29
N2, He, CH4
= 0,72
cр,см = 1750 Дж/(кгК)
30
SO2, Ar, C2H4
 = 0,27
= 0,27cv,см = 650 Дж/(кгК)
Молекулярные массы компонентов смеси приведены в приложении табл. 1.
Таблица 1
Характеристики газов
Химическая формула газа |
Молекулярная масса , кг/кмоль |
|
Атомный вес элементов газа |
Азот N2 |
28,01 |
|
Водород Н — 1,008 |
Кислород О2 |
32,00 |
|
Кислород О — 16,00 |
Окись углерода СО |
28,01 |
|
Азот N — 14,007 |
Углекислый газ СО2 |
44,01 |
|
Углерод С — 12,01 |
Метан СН4 |
16,04 |
|
Сера S — 32,06 |
Аммиак NH3 |
17,03 |
|
|
Диоксид серы SO2 |
48,06 |
|
|
Ацетилен С2Н2 |
26,04 |
|
|
Этилен С2Н4 |
28,05 |
|
|
Этан С2Н6 |
30,07 |
|
|
Массы киломоля газов
Название газа |
Химическая формула газа |
Масса киломоля , кг/кмоль |
Неон |
Ne |
20,18 |
Гелий |
He |
4,00 |
Аргон |
Ar |
39,94 |
Азот |
N2 |
28,01 |
Кислород |
О2 |
32,00 |
Окись углерода |
СО |
28,01 |
Углекислый газ |
СО2 |
44,01 |
Метан |
СН4 |
16,04 |
Аммиак |
NH3 |
17,03 |
Диоксид серы |
SO2 |
64,06 |
Ацетилен |
С2Н2 |
26,04 |
Этилен |
С2Н4 |
28,05 |
Этан |
С2Н6 |
30,07 |
Объем задания:
1. Определить для газовой смеси:
а) массовые и объемные доли смеси;
б) молекулярную массу смеси;
в) газовую постоянную смеси;
г) массовую изохорную и изобарную теплоемкости смеси;
д) мольную изохорную и изобарную теплоемкости смеси;
е) коэффициент Пуассона смеси.
Результаты расчетов свести в табл. 1.3.
Таблица 1.3
Результаты расчета смеси идеальных газов
g1 |
g2 |
g3 |
r1 |
r2 |
r3 |
mсм,
|
Rсм,
|
mсv см,
|
mср см,
|
сv см,
|
ср см,
|
Ксм |
|
|
|
|
|
|
|
|
|
|
|
|
|
Теоретические основы для задачи № 1
Основные уравнения и законы идеальных газов и газовых смесей
Совмещенное уравнение 1-го и 2-го законов термодинамики для обратимых процессов имеет вид:
![]() ,
,
![]() ,
,
где dl = Pdv – работа изменения объема в обратимом процессе.
Уравнение состояния идеальных газов может быть записано в виде:
![]() — для 1 кг газа;
— для 1 кг газа;
![]() — для m кг газа;
— для m кг газа;
![]() — для 1 кмоля газа,
— для 1 кмоля газа,
где Р – абсолютное давление, Па;
v – удельный объем газа, м3/кг;
V – объем данной массы газа, м3;
Vm – объем кмоля газа, м3/кмоль;
Т – абсолютная температура, К;
m – масса газа, кг;
m – молекулярная масса газа, кг/кмоль;
Rm = 8314 Дж/(кмоль×К) – универсальная газовая постоянная;
![]() – газовая постоянная, Дж/(кг×К).
– газовая постоянная, Дж/(кг×К).
Согласно молекулярно–кинетической теории идеальных газов их удельные мольные и массовые изохорные и изобарные теплоемкости постоянны и рассчитываются по формулам:
![]() ,
кДж/(кмольК);
,
кДж/(кмольК);
![]()
![]() ,
кДж/(кмольК);
,
кДж/(кмольК);
![]()
![]() ;
;
![]()
![]() ,
,
где i – число степеней свободы данного газа.
Для одноатомных газов i = 3; для двухатомных газов i = 5; для трех и многоатомных газов i =6. Для смеси идеальных газов i не имеет смысла и данные формулы использовать нельзя.
Разность изобарной и изохорной теплоемкостей идеальных газов определяется соотношением Майера:
![]() ;
; ![]() .
.
В расчетах политропных процессов используется коэффициент Пуассона, который для однородного газа определяется соотношением
![]() .
.
Смесь идеальных газов
Состав смеси идеальных газов может быть задан массовыми или объемными долями:
gi = mi / mсм – массовая доля смеси,
ri = Vi / Vсм = Рi / Pсм – объемная доля смеси,
где mi, mсм – массы данного компонента и смеси газа,
Vi, Рi – парциальный объем и давление данного компонента смеси газа,
Vсм, Рсм – объем и давление смеси газа.
Сумма массовых и объемных долей смеси газов равна единице.
![]() ,
,
![]() .
.
Между массовыми и объемными долями газовой смеси справедливо соотношение:
![]() или
или ![]() ,
,
где mсм – молекулярная масса смеси, которая может рассчитываться как
![]() ;
;
Rсм – газовая постоянная смеси, она может рассчитываться как
![]() ,
,
причем Rсм = 8314/mсм , Дж/(кмоль×К).
Массовая и мольная теплоемкости смеси идеальных газов рассчитываются как суммы алгебраических произведений массовых или объемных долей на соответствующие массовые и мольные теплоемкости компонентов смеси газов
![]() и
и ![]() или
или
![]() .
.
Коэффициент Пуассона для смеси идеальных газов рассчитывается как
![]() .
.
Таблица 1.2
Исходные данные для расчета политропных процессов
смеси идеальных газов
-
№
Р1, МПа
v1, м3/кг
t1, оС
Р2, МПа
v2, м3/кг
t2, оС
q, кДж/кг
l, кДж/кг
n
1
2
3
4
5
6
7
8
9
10
1
0,2
30
0,4
2
0,6
120
– 100
1,5
3
0,2
100
500
0
4
0,4
0,7
0,3
20
5
0,34
0,68
70
k
6
0,8
400
0,3
1
7
1,6
0,13
0,72
3v1
8
0,55
25
200
0
9
0,35
800
600
1,15
10
0,2
20
300
11
0,34
0,6
0,6
0
12
1,2
300
0,25v1
1,7
13
0,6
800
– 180
0
14
0,25
0,8
– 300
1,15
15
0,55
800
500
0
16
0,1
20
0,8
1
17
0,3
0,75
0,9
1,2
18
0,44
780
– 140
0
19
1
300
3v1
1,6
20
0,32
0,65
100
21
0,1
200
0,2
1
22
0,25
25
2
125
23
1
0,2
900
0
24
0,6
250
90
0,35
25
0,12
20
0,4
k
26
0,4
0,5
950
27
0,32
100
2
175
28
2
900
0,1
0
29
1,3
0,16
50
0,4
30
0,1
17
0,5
1
Объем задания:
2. Расчет процесса изменения состояния смеси идеальных газов.
В результате этого расчета необходимо определить:
а) начальные и конечные термические параметры процесса Р, v, t;
б) количество теплоты, работу изменения объема, изменение внутренней энергии, энтальпии и энтропии. Эти величины определяются для 1 кг смеси газа.
Результаты расчетов свести в табл. 1.4, 1.5.
3. Построить процесс в диаграммах Р,v и Т,s в масштабе.
Результаты расчетов свести в табл. 1.4, 1.5.
Таблица 1.4
Результаты расчета параметров состояния
политропного процесса 1-2 смеси идеальных газов
Р1 |
t1, oC |
v1, м3/кг |
Р2 |
t2, oC |
v2, м3/кг |
|
|
|
|
|
|
Таблица 1.5
Таблица 1.5
Результаты расчета энергетических характеристик политропного процесса 1-2 смеси идеальных газов
Процесс (название) |
n |
q, кДж/кг |
l, кДж/кг |
Du, кДж/кг |
Dh, кДж/кг |
Ds, кДж/(кг×К) |
|
|
|
|
|
|
|
Политропные процессы изменения состояния идеальных газов
Расчет и анализ политропных процессов идеальных газов проводится на основании уравнений и законов термодинамики. В табл. 1.6 приведены основные расчетные формулы для определения основных параметров состояния (Р, v, Т), мер энергетического взаимодействия (q, l), изменения энергетических параметров (Du, Dh, Ds), значения теплоемкости, показателя политропы n, коэффициента a, определяющего закономерность преобразования форм энергии: a = Du/q, как для произвольного политропного процесса, так и для частных (основных) процессов идеальных газов: изобарного (Р= const), изохорного (v = const), изотермического (T = const), адиабатного — изоэнтропного (dq = 0 или s = const).
Если для политропного процесса показатель политропы не задан в явном виде, то он может быть определен по одному из уравнений, связывающих три основных параметра или по известному коэффициенту a, теплоемкости процесса, работе изменения объема, теплоте процесса и т.п.
На рис. 1.1 и 1.2 в диаграммах Р,v и T,s изображены основные термодинамические процессы идеальных газов, указаны значения их показателей политропы и показаны границы изменения показателя политропы для всех возможных областей прохождения политропных процессов.
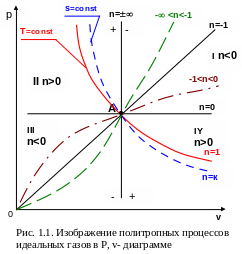

Таблица 1.6
Основные расчетные выражения для политропных процессов идеальных газов
Процессы |
n |
с |
a |
Уравнение |
q |
l |
Ds |
Du, Dh |
Р = const |
0 |
сp |
1/К |
|
сp Dt |
Р Dv = R DТ |
|
|
v = const |
±¥ |
cv |
1 |
|
cv Dt |
0 |
|
|
T = const |
1 |
±¥ |
0 |
|
|
|
|
|
s = const (dq = 0) |
К |
0 |
±¥ |
|
0 |
u1 – u2 =
=cv(T1 – T2) =
= |
0 |
Du = cv(t2-t1), Dh = cp(t2-t1) |
политропа n = const (a = const) |
|
|
|
|
с Dt |
=
|
|
|
