
- •Лабораторный практикум по органической химии (часть 1)
- •Содержание
- •Введение
- •Указания к подготовке и выполнению лабораторных работ
- •Правила техники безопасности при работе в лаборатории
- •Общие положения:
- •Работа со взрывоопасными веществами и приборами:
- •Работа с горючими веществами:
- •Работа с токсичными веществами:
- •Работа с кислотами и щелочами:
- •Действия в случае возникновения несчастного случая и оказание первой помощи:
- •Методы очистки органических соединений
- •Методики лабораторных работ
- •Лабораторная работа № 1. Качественный анализ органических соединений
- •4.2. Лабораторная работа № 2. Предельные углеводороды и непредельные ряда этилена и ацетилена
- •4.3. Лабораторная работа № 3. Галогенпроизводные углеводородов.
- •4.4. Лабораторная работа № 4. Ароматические углеводороды
- •Опыт 1. Получение бензола из бензойной кислоты
- •4.5. Лабораторная работа № 5. Спирты
- •4.6. Лабораторная работа № 6. Альдегиды и кетоны.
- •Контрольные вопросы:
- •4.7. Лабораторная работа № 7. Карбоновые кислоты и их производные.
- •4.8. Лабораторная работа № 8. Фенолы.
- •Опыт 7. Образование трибромфенола
4.5. Лабораторная работа № 5. Спирты
Этот класс соединений характеризуется наличием одной или нескольких функциональных групп – ОН. Количество гидроксильных групп определяет атомность спиртов. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксильная группа, определяют и характер спирта. Многие свойства спиртов определяются гидроксильной функциональной группой, в которой могут поляризоваться как связь водорода с кислородом, так и связь кислорода с углеводородным радикалом. Однако, кислотные свойства спиртов очень слабо выражены, даже в меньшей степени, чем у воды. При взаимодействии с сильными кислотами спирты проявляют основные свойства и образуют соли оксония. Свойства спиртов также зависят и от характера углеводородного радикала, с которым связана гидроксильная группа. Это определяет различную реакционную способность первичных, вторичных и третичных спиртов. Снижение активности водорода при переходе от первичного к третичному спирту объясняется уменьшением полярности связи О-Н вследствие увеличения электронодонорных свойств алкильных радикалов в сравнении с атомом водорода.
Многоатомные спирты по свойствам близки к одноатомным, однако, в сравнении с последними обладают более выраженными кислотными свойствами. Поэтому, в отличие от одноатомных растворяют гидроксиды тяжелых металлов. Многоатомные спирты находят большое применение в синтезе высокомолекулярных соединений, медицине, технике и др.
Материалы: этиловый, пропиловый, изопропиловый и трет-бутиловый спирты; глицерин, реактив Лукаса; вода, подкрашенная перманганатом калия; бутиловый, изоамиловый спирты; медный купорос (CuSO4∙5H2O); поташ (K2CO3) (или гипосульфит калия); металлический натрий; раствор фенолфталеина; концентрированная серная кислота; КМnO4; 5 %-ный раствор бихромат калия (K2Cr2O7); 25 %-ный раствор разбавленной серной кислоты; концентрированная соляная кислота; 2 %-ный раствор сульфата меди; 10 %-ный раствор гидроксида натрия; нитрит натрия; гидросульфат калия или натрия.
Опыт 1. Определение характера спиртов
Помещают в 3 пробирки отдельно первичный, вторичный и третичный спирты (например, пропиловый, изопропиловый и трет-бутиловый). Затем в каждую пробирку приливают по 5 капель реактива Лукаса (хлористый цинк, растворенный в концентрированной соляной кислоте), взбалтывают содержимое пробирок и оставляют на 1 мин. В пробирке с первичным спиртом раствор остался прозрачным, раствор вторичного слегка мутнеет, а в пробирке с третичным образуется на дне маслянистая капля галогеналкила.
Напишите уравнения реакций и объясните различие в реакционной способности спиртов.
Опыт 2. Растворимость спиртов в воде
В 4 отдельные пробирки наливают по 3 мл воды, подкрашенной перманганатом калия, и добавляет по I мл этилового, бутилового, изоамилового спиртов и глицерина. Пробирки встряхивают. Как изменяется растворимость одноатомных спиртов с увеличением молярной массы? Как влияет на растворимость в воде увеличение числа гидроксильных групп? Почему?
Опыт 3. Горение спиртов
В фарфоровые чашки наливают по 10 мл этилового, бутилового и изоамилового спиртов и поджигают их. По мере увеличения молекулярной массы спирты горят более коптящим пламенем. Почему? Напишите уравнения реакций.
Опыт 4. Обнаружение присутствия воды в спирте и обезвоживание спирта
1,5-2 г медного купороса (CuSO4∙5H2O) нагревают в фарфоровой чашке на пламени горелки, перемешивая медной проволочкой, до полного исчезновения голубой окраски и прекращения выделения паров воды. Остывший порошок пересыпают в сухую пробирку и добавляют 2-3 мл этанола. При встряхивании и слабом нагревании порошок приобретает голубой цвет.
Опыт 5. Высаливание спирта из его водного раствора
Смешивают в пробирке 2 мл этанола и 2 мл воды той же (комнатной) температуры. Погрузив в смесь термометр, отмечают повышение температуры при смешивании спирта с водой на 6-8 0С. Поместив несколько капель полученного 50 %-ного спирта на стекло, испытывают, горюча ли эта жидкость.
Затем добавляют к смеси 2 г поташа (K2CO3) (или гипосульфита калия) взбалтывают и дают отстояться. Над водным раствором добавленной соли всплывает слой спирта, который снова испытывают на горючесть.
Опыт 6. Образование и гидролиз алкоголята
![]()
В сухую пробирку помещают кусочек чистого (свежесрезанного, очищенного от корочек и отжатого от керосина) металлического натрия величиной с небольшую горошину, затем добавляют обезвоженный этанол (~5-7 мл). Пробирку закрывают пробкой с газоотводной трубкой и охлаждают в стакане с водой, предотвращая выкипание спирта в результате экзотермической реакции. Когда выделение газа станет спокойным, подносят пробирку отверстием газоотводной трубки к пламени горелки: выделяющийся водород дает в смеси с воздухом вспышку с характерным резким звуком.
Жидкость постепенно густеет, натрий покрывается слоем твердого алкоголята, и реакция замедляется настолько, что для ее ускорения требуется слегка нагреть пробирку. Если выделение водорода почти прекратится, а натрий полностью не растворится, подогревают смесь до разжижения и удаляют из нее оставшийся кусочек натрия при помощи изогнутой проволочки. Извлеченный натрий помещают в банку для остатков натрия.
Полученный концентрированный раствор алкоголята при охлаждении закристаллизовывается.
Добавляют в ту же пробирку 5-6 мл воды и испытывают фенолфталеином или универсальной индикаторной бумагой реакцию полученного раствора.
Опыт 7. Окисление этилового спирта
1) окисление оксидом меди (II):
O
//
СНз-СН2ОН + СuО®СH3-С + Сu + Н2О
\
Н
В сухую пробирку помещают 2-3 капли этилового спирта. Нагревают спираль из медной проволочки в пламени горелки, держа ее пинцетом, до появления черного налета оксида меди (II). Еще горячую спираль опускают в пробирку с этиловым спиртом. Черная поверхность становится золотистой вследствие восстановления оксида меди. При этом ощущается характерный запах уксусного альдегида (запах яблок).
1) окисление перманганатом калия (тяга!):
![]()
Пипеткой аккуратно, не смачивая стенок, вносят в сухую пробирку, закрепленную в штативе, 5 мл концентрированной серной кислоты. Затем по стенке пробирки другой пипеткой осторожно приливают 5 мл этанола так, чтобы получилось два слоя. Затем насыпают 1 г КМnO4 . Через несколько минут на границе двух слоев появляются яркие вспышки, ощущается запах уксусного альдегида.
3) окисление хромовой смесью (тяга!):
![]()
В пробирке смешивают 2 мл 5 %-ного раствора бихромата калия (K2Cr2O7) с 1 мл разбавленной серной кислоты и 0,5 мл этанола и осторожно нагревают. При этом наблюдается изменение цвета раствора и образование уксусного альдегида, обнаруживаемого по запаху.
Опыт 8. Получение этилнитрита
![]()
Растворяют 1 г нитрита натрия в 2 мл воды, добавляют 1-1,5 мл этанола и хорошо охлаждают раствор в смеси воды со льдом (снегом). В другой пробирке смешивают 1 мл концентрированной соляной кислоты с 1 мл воды и также охлаждают смесь до 0 0С. Осторожно, малыми порциями, вливают кислоту в вводно-спиртовой раствор нитрита натрия, все время взбалтывая и тщательно охлаждая смесь. Над водным раствором быстро всплывает желтоватый слой этилнитрита, имеющего приятный фруктовый запах.
Опыт 9. Межмолекулярная дегидратация спиртов
В сухую пробирку помещают 1 мл этанола и 1 мл концентрированной серной кислоты. Смесь осторожно нагревают над пламенем горелки до побурения раствора. К горячей смеси осторожно добавляют еще 1 мл этанола. Ощущается характерный запах диэтилового эфира.
Реакция протекает в две стадии. Вначале образуется этилсерная кислота:
![]()
В избытке спирта образуется простой эфир:
![]()
Если в реакцию вступает относительно много серной кислоты и мало спирта, то при нагревании (до 160 0С) происходит внутримолекулярная дегидратация и образуется алкен.
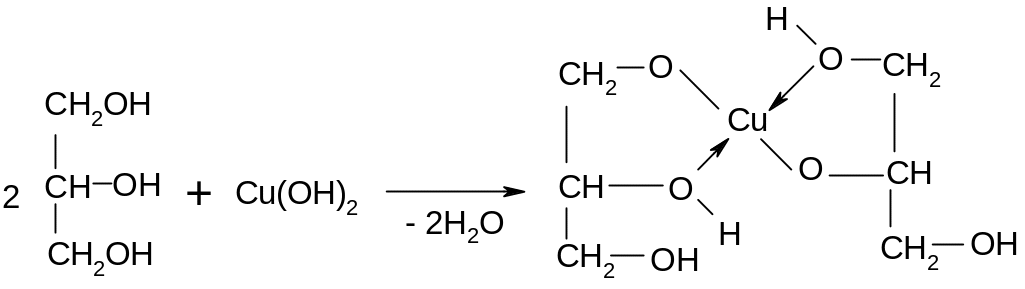
Опыт 10. Качественная реакция на многоатомные спирты
 глицерин
глицерат меди
(II)
глицерин
глицерат меди
(II)
В этой реакции проявляются кислотные свойства глицерина, а также основные (образование координационных связей).
В пробирку наливают 3-4 капли 2 %-ного раствора сульфата меди и 2-3 мл 10 %-ного раствора гидроксида натрия. К образовавшемуся осадку голубого цвета приливают несколько капель глицерина и смесь перемешивают. Осадок растворяется и появляется васильковое окрашивание раствора от образующегося комплексного соединения - глицерата меди (II).
Опыт 11. Дегидратация глицерина
Отнятие воды от молекулы глицерина ведет к одновременному образованию ряда веществ; одним из них является непредельный альдегид – акролеин, образующийся по схеме:
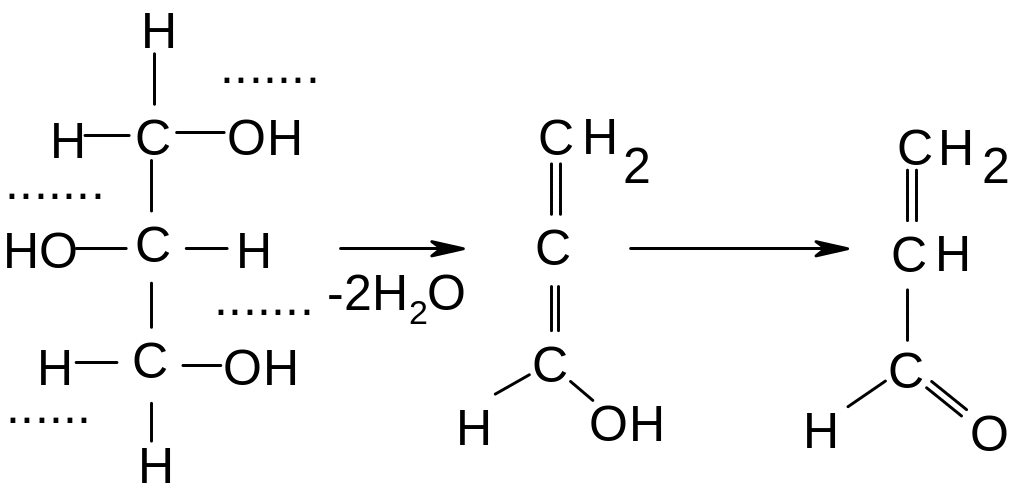
К нескольким каплям глицерина в сухой пробирке добавляют около 1 г гидросульфата калия (или натрия)*; смесь встряхивают и осторожно нагревают. Образование акролеина (пропеналя) обнаруживается по появлению характерного, очень едкого запаха.
* При отсутствии гидросульфата его готовят непосред-ственно во время опыта, смешивая в сухой пробирке 0,5-0,6 г сульфата калия (или натрия) и 5-6 капель концентрированной серной кислоты.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
1. Приведите структурные формулы изомерных спиртов с молекулярной формулой С4Н10О. Назовите их по систематической номенклатуре.
2. Какой спирт можно получить при восстановлении метилэтилкетона.
3. Приведите уравнения реакций внутримолекулярной и межмолекулярной дегидратации 2-бутанола.
4. Каким образом из трет-бутилового спирта можно получить: а) галогеналкил; б) алкоголят; в) сложный эфир?
5. Что образуется при окислении: а) 1-пропанола; б) 2-пропанола; в) 2-метил-2-бутанола?
6. Напишите качественные реакции на глицерин.
