
- •Лабораторный практикум по органической химии (часть 1)
- •Содержание
- •Введение
- •Указания к подготовке и выполнению лабораторных работ
- •Правила техники безопасности при работе в лаборатории
- •Общие положения:
- •Работа со взрывоопасными веществами и приборами:
- •Работа с горючими веществами:
- •Работа с токсичными веществами:
- •Работа с кислотами и щелочами:
- •Действия в случае возникновения несчастного случая и оказание первой помощи:
- •Методы очистки органических соединений
- •Методики лабораторных работ
- •Лабораторная работа № 1. Качественный анализ органических соединений
- •4.2. Лабораторная работа № 2. Предельные углеводороды и непредельные ряда этилена и ацетилена
- •4.3. Лабораторная работа № 3. Галогенпроизводные углеводородов.
- •4.4. Лабораторная работа № 4. Ароматические углеводороды
- •Опыт 1. Получение бензола из бензойной кислоты
- •4.5. Лабораторная работа № 5. Спирты
- •4.6. Лабораторная работа № 6. Альдегиды и кетоны.
- •Контрольные вопросы:
- •4.7. Лабораторная работа № 7. Карбоновые кислоты и их производные.
- •4.8. Лабораторная работа № 8. Фенолы.
- •Опыт 7. Образование трибромфенола
Опыт 7. Образование трибромфенола
Поместите в пробирку 3 капли бромной воды и добавьте 1 каплю прозрачной карболовой воды из опыта № 5. Немедленно происходит обесцвечивание бромной воды и выделение белого осадка трибромфенола:
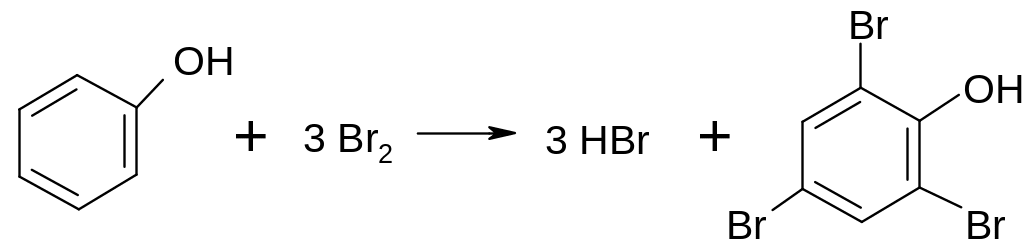
фенол симм-трибромфенол
Опыт с фенолом показывает, что под влиянием гидроксильной группы атомы водорода в бензольном кольце приобретают большую подвижность и очень легко замещаются бромом.
Опыт 8. Доказательство кислотного характера фенола
К остатку фенольной воды из опыта № 5 добавьте 1 каплю фенола и взболтайте. К вновь полученной мутной эмульсии фенола в воде добавьте 1 каплю 2 н раствора гидроксида натрия. Моментально образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде:
![]()
Очевидно, что под влиянием радикала фенила - C6H5 гидроксильная группа приобретает кислотные свойства.
Опыт 9. Разложение фенолята натрия кислотой
В прозрачный раствор фенолята натрия из опыта № 8 добавьте 2 капли 2 н раствора HCl. Жидкость моментально мутнеет вследствие выделения свободного фенола:
![]()
Опыт 10. Цветные реакции фенолов с хлорным железом
В нашем распоряжении имеются следующие фенолы:

о-диоксибензол м-диоксибензол п-диоксибензол 2,6-диоксифенол
пирокатехин резорцин гидрохинон пирогаллол
В 4 пробирки налейте по 3 капли каждого 1 %-ного раствора фенола. В каждую из пробирок добавьте по 1 капле 0,1 н раствора FeCl3 . В пробирке с пирокатехином появляется зеленое окрашивание; с резорцином – фиолетовое; с гидрохиноном – зеленое, очень быстро переходящее в желтое (окисление гидрохинона в хинон); с пирогаллолом – красное.
Проделайте эти опыты на белой фильтровальной бумаге. Для этого на фильтр нанесите по 1 капле растворов (1 %-ный раствор) фенолов. Когда капли растекутся, в центре каждого пятна поместите по 1 капле раствора хлорида железа (III). В случаях с пирокатехином и пирогаллом удается наблюдать эффект распределительной хроматографии на бумаге – пофазное распределение продуктов окисления в виде концентрических колец. Уловить зеленую окраску от гидрохинона удается лишь в момент попадания капли хлорида железа (III) в раствор гидрохинона при наблюдении на фоне белой бумаги. Появление быстроизменяющейся зеленой окраски указывает на то, что при окислении гидрохинона в хинон образуется промежуточное соединение одной молекулы гидрохинона с одной молекулой хинона, так называемый хингидрон:

гидрохинон (бесцветный) + хинон (желтый) =
 хингидрон
(зеленый)
хингидрон
(зеленый)
Обратите внимание на изменение системы двойных связей в молекуле хинона. Характерная для многих красителей хиноидная группировка получила свое название от хинона.
Приложите образцы полученных хроматограмм к своему рабочему журналу.
Опыт 11. Цветные реакции фенолов с гидроксидом натрия
Все фенолы под влиянием кислорода воздуха более или менее быстро окисляются, давая очень сложные смеси окрашенных продуктов. В присутствии щелочи реакция окисления фенолов значительно ускоряется. Скорость реакции окисления у разных фенолов различна, что позволяет отличать фенолы друг от друга. Реакции окисления фенолов в присутствии щелочи очень удобно наблюдать на фильтровальной бумаге.
На фильтровальную бумагу нанесите через равные промежутки по 1 капле растворов: пирокатехина, резорцина, гидрохинона и пирогаллола. Когда капли растекутся, в центре каждого пятна поместите по 1 капле 2 н раствора гидроксида натрия. От пирокатехина немедленно образуется зеленое пятно; от пирогаллола (с такой же скоростью) – темно-коричневое, от гидрохинона – желтое с зеленой каемкой по периферии; от резорцина – слабо выраженное кольцо коричневого цвета. Приложите образцы полученных хроматограмм к своему рабочему журналу.
Обратите внимание на то, что зеленое пятно у пирокатехина постепенно начинает желтеть (частичное образование о-хинона). Постепенное изменение окраски пятна от пирогаллола указывает на то, что окисление его протекает не сразу, а пофазно с образованием промежуточных продуктов.
Опыт 12. Реакции фенолов с нитратом серебра
Еще более резко отличаются фенолы по своему отношению к азотнокислому серебру, которое они восстанавливают при окислении. На восстанавливающих свойствах фенолов основано применение многих из них в качестве проявителей в фотографии.
Поместите предметное стекло на белую бумагу. Через равные промежутки нанесите через равные промежутки по 1 капле растворов: пирокатехина, резорцина, гидрохинона и пирогаллола. Быстрее всего окисляется пирогаллол, затем гидрохинон и пирокатехин. Очень слабо и медленно окисляется резорцин. Появляется только слабое побурение раствора резорцина, в то время как раствор пирогаллола становится уже коричневым, а на поверхности выделяется даже пленка металлического серебра.
Опыт 13. Получение фенолформальдегидной смолы
Схематически реакцию поликонденсации фенола с формальдегидом можно представить так: молекулы фенола связываются углеродными мостиками за счет метиленовых групп формальдегида. На схеме приведены лишь начальная и конечная фазы реакции:

фенол + формальдегид фенолформальдегидная смола
(резит)
Поместите в пробирку 4 капли жидкого фенола. Добавьте к нему 4 капли 40 %-ного формалина и убедитесь в том, что вместо мутной эмульсии получается прозрачный раствор. Очевидно, фенол вступает в реакцию с формальдегидом, образуя хорошо растворимое в воде соединение. Добавьте к полученному раствору 1-2 капли 2 н раствора NH4OH и поставьте в кипящую водяную баню. Через 20-30 минут жидкость в пробирке расслаивается: на дне образуется фенолформальдегидная смола – резол, а над ней водный слой.
После остывания пробирки, когда смола несколько загустеет, слейте водный слой и с помощью жгутика, свернутого из фильтровальной бумаги, снимите со стенок капельки воды. К оставшейся в пробирке смоле прилейте этиловый спирт и нагрейте до растворения смолы. Полученный раствор (спиртовой лак) вылейте на предметное стекло. По мере испарения спирта на стекле постепенно образуется клейкая масса. После окончания высыхания на стекле останется прочная глянцевая пленка.
О пыт
14. Получение хинона и изучение его
реакций
пыт
14. Получение хинона и изучение его
реакций
В небольшую колбу с отводной широкой холодильной трубкой помещают 1 г гидрохинона, 3 г бихромата калия и 20 мл воды. Смесь постепенно буреет, темнеет и сильно густеет вследствие выделения кристаллов хингидрона. Добавляют в колбу 1 мл концентрированной серной кислоты и кипятильный камешек, вставляют пробку с холодильной трубкой и нагревают смесь до энергичного кипения, собирая отгон в пробирку. Сначала появляются желтые пары хинона, затем быстро отгоняется несколько миллилитров его водного раствора, а в холодильной трубке скапливаются ярко-желтые кристаллы. Прекращают перегонку после того, когда количество образовавшихся кристаллов перестанет увеличиваться. Кристаллы выталкивают из трубки палочкой или проволокой, отфильтровывают их из водного раствора и отжимают на фильтровальной бумаге.
Отмечают характерный запах хинона, а водный раствор используют для определения реакций хинона:
1) несколько кристаллов сульфита натрия растворяют в 1 мл воды и подкисляют раствор разбавленной серной кислотой до появления отчетливого запаха сернистого газа. Часть этой жидкости очень медленно, по каплям, при сильном встряхивании, добавляют к 2-3 мл насыщенного раствора хинона (см. выше). От первых капель образуется коричневая окраска и выделяются темно-зеленые кристаллы хингидрона. При дальнейшем воздействии сернистой кислоты кристаллы постепенно исчезают, достигнув этого прекращают добавление сульфита натрия;
2) к полученному бесцветному раствору (из опыта А) добавляют немного желтого раствора хинона и наблюдают изменения;
3) растворяют немного гидрохинона в 1-2 мл воды, добавляют раствор хинона и сравнивают полученные результаты с данными опыта Б;
4) к 1-2 мл раствора хинона добавляют немного раствора йодида калия, а затем 1-2 капли разбавленной серной кислоты, выделяется йод;
5) к 1-2 мл раствора хинона добавляют равный объем разбавленного раствора щелочи. Жидкость мгновенно буреет, через несколько минут подкисляют смесь разбавленной серной кислотой. Выделяются коричневые хлопья.
О пыт
15. Образование фталеинов
пыт
15. Образование фталеинов
флуоресцеин
Опыт проводят с различными фенолами.
Помещают в сухую пробирку 0,1 г фенола и растертого в порошок фталевого ангидрида 1: 2 моль (или резорцина, или -нафтола, -нафтола). Смешивают оба вещества встряхиванием, смачивают смесь 1-2 каплями концентрированной серной кислоты и осторожно нагревают пробирку в пламени горелки. Нагревание прекращают, когда из расплавившейся смеси начнут выделяться пузырьки.
Дают пробирке остыть, приливают в нее 5-7 мл воды и встряхивают. Часть полученного кислого водного раствора отливают в другую пробирку и добавляют к нему по каплям сначала щелочь до изменения окраски раствора, а затем разбавленную кислоту до возвращения первоначальной окраски или до обесцвечивания.
Опыт 16. Щелочные соли фенолфталеина
К 2-3 мл воды добавляют 2 капли 1 % - ного спиртового раствора фенолфталеина, образуется слабая муть. При добавлении 1 капли разбавленного раствора щелочи муть исчезает, и жидкость окрашивается в малиновый цвет.
Если прибавить еще 0,5-1 мл раствора щелочи, то смесь постепенно обесцвечивается.
К полученной бесцветной сильно-щелочной жидкости постепенно добавляют серную кислоту по каплям; раствор окрашивается в малиновый цвет и затем вновь обесцвечивается.

Опыт 17. Образование аурина

Помещают в сухую пробирку 0,05 г щавелевой кислоты (в порошке) примерно вдвое больше кристаллического фенола. Смешивают оба вещества легким встряхиванием и, смочив смесь 1-2 каплями концентрированной серной кислоты, осторожно нагревают ее в пламени горелки до начала кипения и появления интенсивно желтой окраски.
Охладив пробирку, добавляют к затвердевшему продукту реакции 3-4 мл воды и встряхивают; образуется ярко-желтый раствор. При добавлении разбавленной щелочи желтая окраска жидкости переходит в красную, а при последующем подкислении – снова в желтую.
КОНТРОЛЬНЫЕ ВОПРОСЫ:
Приведите способы получения фенола из:
а) хлорбензола;
б) бензойной кислоты;
в) хлористого фенилдиазония.
В чем причина различной способности к замещению атомов водорода в молекуле бензола и фенола?
Сравните свойства бензилового спирта и фенола.
Каким образом протекают реакция образования новолачных смол?
В чем общность и различие свойств одно- и двухатомных фенолов?
Заполните схему превращений:
![]()
Бензол
Список рекомендуемой литературы
Гиттис С.С. Практикум по органической химии / С.С. Гиттис, А.И. Глаз, А.В. Иванов– М.: Высшая школа, 1991. – 303с.
Аверина А.В. Лабораторный практикум по органической химии / А.В. Аверина, А.Я. Снегирева- М.: Высшая школа, 1980. – 184с.
Грандберг И.И. Практические и семинарские занятия по органической химии / И.И. Грандберг - М.: Высшая школа, 1987. – 239с.
Лабораторные работы по органической химии / под ред. О.Ф. Гинзбурга и А.А. Петрова - М.: Высшая школа, 1982. – 189с.
Некрасов В.В. Руководство к малому практикуму по органической химии / В.В. Некрасов - М.: Химия, 1975. 328с.
Петров А.А. Органическая химия : Учебник для вузов / Под ред. Стадничука М.Д.- 5-е изд.,перераб.и доп. – СПб.: Иван Федоров, 2002- 624с.
Рево А.Я. Практикум по органической химии / А.Я. Рево– М.: Высшая школа, 1971. – 208
Травень В.Ф. Органическая химия / В.Ф Травень. - М.: ИКЦ «Академкнига», 2005г.- 1,2 т.
Составители: ЖУКОВА Ирина Юрьевна,
КАШПАРОВ Игорь Сергеевич,
ТЯГЛИВАЯ Инна Николаевна
Лабораторный практикум по органической химии (часть 1).
Редактор А.А. Литвинова
_________________________________________________________
В печать
Объем усл. п. л. Офсет. Формат 60х84/16.
Бумага тип №3. Заказ № _________. Тираж ____ экз. Цена свободная
_________________________________________________________
Издательский центр ДГТУ
Адрес университета и полиграфического предприятия:
344000,
г. Ростов-на-Дону, пл. Гагарина, 1 
