
2 Години.
Дисципліна : Медична хімія (ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ )
Тема : Електрокінетичні явища: електроосмос, електрофорез, потенціали перебігу та седиментації. Застосування електрофорезу в дослідницькій та клініко-лабораторній практиці.
Викладач : Рибальченко Віталій Валентинович
Курс, група : І курс , групи 11, 12, 13. Спеціальність : 5.12010102 «сестринська справа»
І. Актуальність теми : Електрофорез клітин знайшов застосування при оцінці клітинного іммунітету в онкологічних хворих. Електрофоретичні методи належать до найкращих сучасних методів розділення та аналізу суміші білків та виділення цих макромолекул.
ІІ. Навчальні цілі :
Знати: 1. Визначення електрокінетичним явищам
2. Значення для медицини.
Вміти: 1. Пояснювати електрокінетичні явища
ІІІ. Матеріали доаудиторної та аудиторної самостійної роботи :
ІІІ.а. Базові знання , вміння, навички, необхідні для вивчення теми . Для вивчення теми
необхідно:
Знати |
Вміти |
З дисципліни |
Загальна характеристика дисперсних систем: основні визначення та класифікація. |
Характеризувати дисперсні системи |
Фізична та колоїдна хімія |
Методи очищення колоїдних розчинів
|
Пояснювати методи очищення
|
Фізична та колоїдна хімія |
Електричні властивості колоїдно-дисперсних систем |
Пояснювати механізм утворення подвійного шару електронів.
|
Фізична та колоїдна хімія |
ІІІ.б. Рекомендована література :
Основна:В.Гомонай, Фізична та колоїдна хімія. Ужгород 2006р. с. 279-305.
Додаткова: Ю.А. Ершов – Общая химия – Москва 2000г. с. 440-450.
- Лекція № 7.
ІІІ.в. Основні етапи роботи :
1 етап - опрацювання рекомендованої літератури .
Завдання |
Зверніть увагу |
1.Прочитати статтю «Електрокінетичні явища: електроосмос, електрофорез, потенціали перебігу та седиментації» . (З рекомендованої літератури або з додатка № 1.).
|
1. На розрахунок поверхневого потенціалу 2. На визначення електрокінетичного потенціалу. 3. На характеристику електрофорезу та електроосмосу. |
1.Прочитати статтю «Застосування електрофорезу в дослідницькій та клініко-лабораторній практиці» . (З рекомендованої літератури або з додатка № 1.).
|
1. На значення хроматографічних методів. 2. На використання газорідинної хроматографії. 3. На метод рідин – рідинної хроматографії. 4. На значення хроматографії для фармацевтичного аналізу. |
2 етап - виконання завдань для самоконтролю :
Завдання |
Зверніть увагу |
1.Прочитавши статтю «Електрокінетичні явища: електроосмос, електрофорез, потенціали перебігу та седиментації» зробіть стислий конспект (З рекомендованої літератури або з додатка № 1.). |
1. На розрахунок поверхневого потенціалу 2. На визначення електрокінетичного потенціалу. 3. На характеристику електрофорезу та електроосмосу. |
1.Прочитавши статтю «Застосування електрофорезу в дослідницькій та клініко-лабораторній практиці» зробіть стислий конспект (З рекомендованої літератури або з додатка № 1.). |
1. На значення електрокінетичних явищ в медицині.
|
3 етап - закріплення знань та навичок. Після вивчення теми необхідно :
Знати |
Вміти |
1. Визначення електрокінетичним явищам 2. Значення для медицини.
|
1. Пояснювати електрокінетичні явища
|
ІV. Додаткові завдання ( матеріали позааудиторної роботи ):
Практичне використання електрофоретичних явищ.
( з додатка № 2).
Додатки до СПРС № 6 :
ДОДАТОК № 1.
Електрокінетичні явища: електроосмос, електрофорез, потенціали перебігу та седиментації.
Утворення подвійного шару іонів приводить до появи певних електричних потенціалів на межі розділу твердої і рідкої фаз Іони першого шару (внутрішньої обкладки), фіксовані на твердій поверхні, надають цій поверхні свій знак заряду і створюють на ній так званий поверхневий або φ-потенціал. Знак φ-потенціалу збігається зі знаком заряду потенціал-утворюючих іонів. Величина φ -потенціалу пропорційна числу зарядів цих іонів на поверхні частинок.
Якщо подвійний шар утворився в результаті адсорбції іонів або дисоціації твердої речовини, то електричний потенціал на поверхні частинок визначається винятково концентрацією або активністю цих іонів у розчині тому що частинка діє як оборотний електрод щодо цих іонів. У цьому випадку φ -потенціал можна виразити рівнянням Нернста:
RT ao
φ = φo + ------ ln ------- (11)
zF a1
де φo - стандартний потенціал утвореного електрода; R - універсальна газова стала; Т - абсолютна температура; z - заряд потенціалутворюючих іонів; F - число Фарадея, рівне F = 96487 Кл/моль-екв; аo і а1 - активність іонів на поверхні і у розчині відповідно (замість активності для розведених розчинів можна брати концентрацію ci).
З погляду термодинаміки (φ -потенціал дорівнює роботі перенесення одиничного (елементарного) заряду з нескінченно віддаленої точки об'єму розчину на поверхню твердої фази, тобто це потенціал твердої поверхні. Прямих методів його виміру не існує.
Потенціал, що характеризує подвійний шар іонів, називають електрокінетичним або
ζ-потенціалом (дзета-потенціалом). Це електричний потенціал у подвійному шарі на межі між частинкою, здатною до руху в електричному полі, і навколишньою рідиною.
ζ -потенціал є потенціалом поверхні ковзання. Однак у подвійному електричному шарі точна відстань від твердої поверхні до поверхні ковзання невідома Тому приблизно можна прийняти, що поверхня ковзання проходить по межі між адсорбційним і дифузійним шарами іонів. Отже, ζ -потенціал близький, хоча і не зовсім ідентичний по величині, потенціалу на границі адсорбційного і дифузійного шарі.
Знак ζ -потенціалу звичайно збігається зі знаком φ -потенціалу.
Знак електрокінетичного потенціалу залежить від хімічної природи твердої фази. Кислі речовини (кремнієва кислота, танін, сульфіди металів, сірка) у водному середовищі набувають, як правило, від'ємний заряд. Особливо чітко проявляється залежність знака дзета-потенціала твердої фази від її хімічної природи при розгляді сполук кислотного (карбоксильні) і основного (аміни) характеру.
Електрофорез і електроосмос були відкриті Ф.Ф.Рейссом (1808).
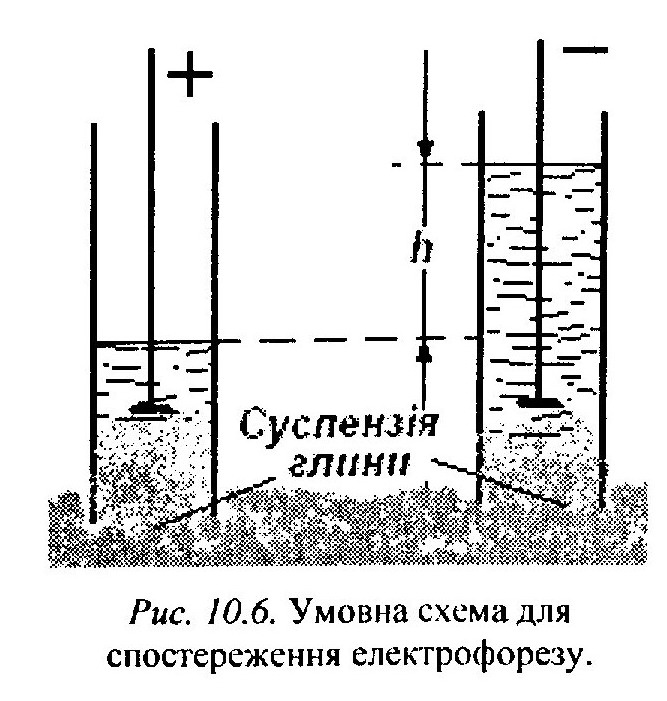 В
дослідженнях Рейсса в шматок вологої
глини були встромлені дві скляні трубки
з вмонтованими в них електродами Заливши
в скляні трубки воду і підключивши
електроди до джерела постійного струму,
Рейсе спостерігав через деякий час
підняття частинок глини (муті) біля
позитивно зарядженого електрода, а в
іншій трубці, яка була підключена до
негативного електрода, він спостерігав
підняття рівня води на деяку висоту h
(рис. 10.6). З цих експериментів
Рейссом було зроблено висновок, що
частинки дисперсної фази (муті)
заряджені негативно, тоді як вода містить
додатні заряди. При подальшому вивченні
цих явищ було виявлено, що вони характерні
для всіх колоїдно-дисперсних систем.
В
дослідженнях Рейсса в шматок вологої
глини були встромлені дві скляні трубки
з вмонтованими в них електродами Заливши
в скляні трубки воду і підключивши
електроди до джерела постійного струму,
Рейсе спостерігав через деякий час
підняття частинок глини (муті) біля
позитивно зарядженого електрода, а в
іншій трубці, яка була підключена до
негативного електрода, він спостерігав
підняття рівня води на деяку висоту h
(рис. 10.6). З цих експериментів
Рейссом було зроблено висновок, що
частинки дисперсної фази (муті)
заряджені негативно, тоді як вода містить
додатні заряди. При подальшому вивченні
цих явищ було виявлено, що вони характерні
для всіх колоїдно-дисперсних систем.
Рух частинок дисперсної фази в електричному полі до протилежно
зарядженого електрода одержало назву електрофорезу.
Щоб зрозуміти причину підняття рівня води в трубці з від'ємне зарядженим електродом, Рейсе поставив інший дослід. Він пропускав постійний електричний струм через ІІ-подібну трубочку, середня частина якої була заповнена дрібним кварцевим піском, який відігравав роль пористої діафрагми. Після включення струму рівень води в коліні з від'ємним електродом почав підніматись, а в коліні з додатнім електродом - знижуватись. Через деякий час пропускання електричного струму встановлювалась певна різниця рівнів, яка надалі не змінювалась. Численні досліди показали, що як і у випадку електрофорезу, цей процес відбувається зі сталою швидкістю. Причому кількість перенесеної рідини пропорційна різниці потенціалу і діелектричній сталій і обернено пропорційна в'язкості середовища. Це явище перенесення рідини крізь пористі діафрагми і вузькі капіляри одержало назву електроосмосу.
Застосування електрофорезу в дослідницькій та клініко-лабораторній практиці.
Методи електрофорезу мають велике теоретичне і практичне значення Величина ζ -потенціалу дозволяє судити про стійкість колоїдного розчину, оскільки зміна стійкості, як правило, відбувається симбатно зі зміною електрокінетичного потенціалу. Але вимір електрофоретичної рухливості може мати більш широке значення. В даний час електрофорез є могутнім засобом для вивчення фракційного складу складних біологічних систем -природних білків (метод Тизеліуса), а також для характеристики таких біологічних об'єктів, як ензіми, віруси, бактерії, форменні елементи крові тощо. За допомогою електрофорезу можна виділяти із суспензій зважені частинки, а також робити покриття твердих частинок або поверхонь шаром інших речовин.
Електрофорез застосовують для очищення різних фармацевтичних препаратів. У фармакопеї передбачене встановлення ступеня чистоти по електрофоретичній однорідності ряду антибіотиків, вітамінів та інших речовин. Електрофорез (іонофорез) є одним з методів уведення лікувальних препаратів в організм людини.
Широке застосування як аналітичний і препаративний метод поділу і виділення різних лікарських речовин і біологічно активних сполук знайшов електрофорез на папері, а також в агаровому або крохмальному гелі. Ці методи застосовують також при діагностиці ряду захворювань шляхом порівняння фракційного складу (по числу й інтенсивності зон на електрофореграмі) нормальних і патологічних біологічних рідин.
Електрофорез у різних його варіантах широко застосовується у медицині для лікування та діагностики. Так, за допомогою іонофорезу через непошкоджену шкіру в організм вводять лікарські препарати При цьому лікувальну дію має не тільки речовина, яка вводиться безпосередньо до зони враження, але й електричний струм.
В гематології та імунології електрофорез застосовують для визначення змін в клітинних частинках. Всі клітини крові хребетних мають негативний заряд. Кожний тип клітин характеризується досить певним значенням електрокінетичного потенціалу з незначними відхиленнями. За електрокінетичною рухливістю клітин крові можна розмістити у такій послідовності: гранулоцити 0,6 .10-12 м2/(сВ), лімфоцити 0,8. 10-12 м2/(сВ), еритроцити 1,0 . 10-12м2/(сВ).
Електрофорез клітин знайшов застосування при оцінці клітинного іммунітету в онкологічних хворих. Електрофоретичні методи належать до найкращих сучасних методів розділення та аналізу суміші білків та виділення цих макромолекул.
В медичній діагностиці та з метою визначення чистоти біохімічних препаратів також застосовуються методи електрофорезу. Впровадження електрофорезу в біохімічні дослідження і в медичну практику є важливим, оскільки дає змогу аналізувати суміші біологічних рідин, розділяти їх на компоненти і визначати їх індивідуальні характеристики. Найбільший інтерес серед біологічних рідин викликає кров, тому вона досліджена найповніше.
В медицині існують прикладні види електрофорезу, гелбелектрофорез, імуноелектро-форез, диск-електрофорез, ізотахофорез тощо.
Електрокінетичні явища широко використовуються в науці і техніці Нанесення електрофоретичним методом на металеві вироби антикорозійного покриття дає можливість одержувати рівномірний шар на деталях складної геометричної форми. Це широко використовується на автоматичних лініях фарбування кузовів автомобілів. В цьому методі одним з електродів є сама деталь, яку покривають фарбою, а другим - ємність, заповнена суспензією, дисперсна фаза якої наноситься на поверхню. В залежності від того, яким електродом є деталь, яку покривають, розрізняють анодофорез і катодофорез.
ДОДАТОК № 2

___________________________________
Методична розробка для організації самостійної роботи
студентів № 7.
