
- •Строение атома.
- •Теория строения атома.
- •I. Планетарная модель Резерфорда (1911г.):
- •III. Квантовая теория строения атома.
- •Правила заполнения орбиталей.
- •Характеристика составных частей атома.
- •Периодический закон д.И. Менделеева. Закон периодичности (1869г.)
- •Периодическая система химических элементов.
Правила заполнения орбиталей.
Подобно любой системе, атомы стремятся к минимуму энергии.
Это достигается при определенном состоянии электронов, т.е. при определенном распределении электронов по орбиталям.
Следует учитывать следующие закономерности:
Принцип Паули: в атоме не может быть электронов с одинаковым значением всех 4-х квантовых чисел. Т.е. на одной орбитали не может находиться более двух электронов. Максимальное число электронов на подуровнях составляет:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Принцип наименьшей энергии: наиболее устойчивому состоянию электрона в атоме соответствует минимальная энергия. Т.е. электрон стремиться занять орбиталь с наименьшей энергией. Принцип справедлив только для основных состояний.
Правило Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимальным.
Правило Клечковского: электрон в атоме занимает уровень с наименьшим значением
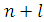 . При одинаковых значениях сумма
заполняется орбиталь с минимальным
значением
. При одинаковых значениях сумма
заполняется орбиталь с минимальным
значением .
.
|
|
|
|
|
|
|
|
Понятие об ![]() ,
,
![]() электронах и их распределении по
энергетическим уровням. Электронные
формулы.
электронах и их распределении по
энергетическим уровням. Электронные
формулы.
Структуру электронных оболочек можно изобразить с помощью электронных или квантовых, ячеек – так называемых графических электронных формул.
Каждая ячейка обозначается клеткой. Клетка – орбиталь, стрелка – направление спина; свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении.
Примеры: Рис.

![]()
![]()
n=2;
l=1;
p
– подуровень
ml=2l+1=3
ms=±1/2
S=±1/2
l=3;
p=3;
N=Ar-p=7-3=4
n=2;
l=1; m=2l+1=2∙1+1=3
ms=±1/2 S=0
l=4;
p=4;
N=Ar-p=9-4=5![]()
![]()
Проскок электронов: с 4s на 3d – подуровень:
наблюдается у
некоторых ![]() ;
;
![]() ;
;
d- элементов с незавершенным с 5s на 4d – подуровень:
d-
подуровнем. Или ![]()
у ![]() стремится к более
стремится к более ![]()
устойчивому - ![]() .
.
![]() (двойной
проскок)
(двойной
проскок)
![]()
![]()
с 6s на 5d – подуровень:
![]()
Последовательность заполнения энергетических уровней и подуровней.
![]()
Характеристика составных частей атома.
Название |
Символ |
Относительная масса |
Заряд |
Количество в атоме |
|
Ядро |
Протон |
|
1 |
+1 |
Z (порядковый номер) |
Нейтрон |
|
1 |
0 |
N = Ar - Z |
|
Электрон |
|
|
-1 |
Z (порядковый номер) |
|
Протонное число равняется заряду ядра атома элемента.
Нуклонное число – это общее количество протонов и нейтронов в ядре.
Нуклид – это тип атомов с определенными значениями нуклонного и протонного чисел.
Изотопы – это разновидности атомов одного химического элемента, которые отличаются по массе вследствие различного содержания нейтронов в ядре.
Например, изотопы водорода:
![]() (Протий),
(Протий),
![]() (Дейтерий – D);
(Дейтерий – D);
![]() (Тритий – Т).
(Тритий – Т).
В настоящее время известно ~ 300 устойчивых изотопов и синтезировано больше 1800 неустойчивых радиоактивных изотопов.
Изобары – это атомы (нуклиды) разных химических элементов, которые имеют одинаковые массовые числа.
Например,
массовое число 40 имеют атомы разных
элементов: Аргона ![]() Калия
Калия ![]() ,
Кальция
,
Кальция ![]() .
.
Изотоны – это ядра атомов химических элементов, которые имеют разное число протонов, но одинаковое число нейтронов.
![]()
Радиоактивность.
Устойчивость ядер характеризуются соотношением:
![]() ,
,
Где Z
– заряд ядра атома, А – его массовое
число. Если![]()
![]() ,
то ядро неустойчивое, радиоактивное.
Неустойчивые ядра атомов, имеют нечетный
атомный номер.
,
то ядро неустойчивое, радиоактивное.
Неустойчивые ядра атомов, имеют нечетный
атомный номер.
Радиоактивность. Самопроизвольное превращение неустойчивых ядер атомов одного химического элемента в ядра атомов одного или нескольких других элементов, сопровождающееся излучением элементарных частиц и энергии, называется радиоактивностью.
Химические элементы, все изотопы которых радиоактивны, называются радиоактивными элементами.
Радиоактивность различают:
естественную;
искусственную.
Естественную радиоактивность проявляют изотопы элементов, существующие в природе.
Z = 84 – 92 не имеют ни одного стабильного изотопа.
Искусственную радиоактивность проявляют изотопы элементов, полученные в лаборатории вследствие ядерных реакций. (Начало работ 1943г. Ф.Ж. Кюри и Ирэн Кюри).
Z = 43 (технеций), Z = 85 (астат), Z = 93 -110 (трансурановые элементы), получены искусственно. Они имеют лишь радиоактивные изотопы.
Устойчивость
радиоактивного изотопа характеризуют
периодом
получения
распада,
то есть промежутком времени, на протяжении
которого распадается половина начального
количества данного радиоактивного
изотопа. Период полураспада обозначают
![]() ,
,
![]()
![]() .
.

Где ![]() исходное количество радиоактивных
атомов,
исходное количество радиоактивных
атомов,![]() количество
оставшихся атомов к моменту времени
количество
оставшихся атомов к моменту времени
![]() (
(![]()
Примеры:
![]() -
- ![]() 80000,
80000,
![]()
![]()
Радиоактивный распад относится к реакциям 1-го порядка.
Виды радиоактивного распада:
 Излучение – поток ядер гелия, движутся
с большой скоростью.
Излучение – поток ядер гелия, движутся
с большой скоростью. Излучение
– поток электронов, движутся со скоростью
света.
Излучение
– поток электронов, движутся со скоростью
света. Излучение
– поток позитронов – частиц, имеющих
положительные заряды, движутся как
электроны.
Излучение
– поток позитронов – частиц, имеющих
положительные заряды, движутся как
электроны. Излучение
– электромагнитные волны с большой
проникающей способностью и высокой
энергией.
Излучение
– электромагнитные волны с большой
проникающей способностью и высокой
энергией.
Примеры:
![]() - распад ядер
- распад ядер
![]()
Образовался элемент, расположенный в ПСЭ на две группы левее.
![]() распад
ядер
распад
ядер
![]() .
.
Элемент расположен в соседней справа группе ПС.
![]() распад
ядер
распад
ядер
![]()
Протон превращается в нейтрон.
Образовался элемент, расположенный в ПС левее на одну группу
![]() или
или ![]()
Уменьшение заряда ядра на единицу может быть вызвано не только
![]() распадом,
но и электронным захватом.
распадом,
но и электронным захватом.
Пример:
![]()
![]()
Электрон поглощается ядром. (Такой ядерный процесс называется К-захватом – электрон находится в К-электронном слое.)
Структура периодической
Системы (ПС)
НОМЕР
Периоды (1-й – 7-й)
Горизонтальные ряды ПС,
которые начинаются со щелочного
металлического элемента и заканчиваются
инертным элементом
Группы (I-VIII)
Вертикальные столбцы ПС,
которые содержат подробные по свойствам
элементы
Малые (1-й– 3-й)
Состоят из одного ряда
Большие (4-й–7-й)
Состоят из 2-х рядов
Главные подгруппы (группа А) Состоят
из элементов малых и больших периодов
Побочные подгруппы (группа Б) Состоят
только из элементов больших периодов
Типические элементы – это элементы 2-го и 3-го периодов, по которым наиболее наглядно проследить смену свойств элементов и их соединений.
Период, соответствующий кол-ву
энергетических уровней, сод. электроны
Группы определяет максимальное кол-во
валентных неспаренных электронов
Порядковый номер элемента равняется
заряду ядра (кол-во протонов) и кол-во
электронов
Много свойств элементов изменяются периодически. К ним относятся:
Атомный радиус; характеризует межатомное (межядерное) расстояние между одинаковых атомов в молекуле или кристалле.
Энергия ионизации (I) – это энергия, необходимая для отрыва электрона от невозбужденного атома; измеряется в электрон-вольтах (ЭВ);
 .
Наименьшее напряжение поля, при котором
происходит ионизация атомов, называют
потенциал
ионизации.
Измеряется в вольтах. Для многоэлектронных
атомов энергию отрыва 1-го электрона
называют первым потенциалом ионизации.
.
Наименьшее напряжение поля, при котором
происходит ионизация атомов, называют
потенциал
ионизации.
Измеряется в вольтах. Для многоэлектронных
атомов энергию отрыва 1-го электрона
называют первым потенциалом ионизации.
![]() так как образуется катион крепко
удерживает оставшиеся электроны. Энергия
ионизации зависит
от заряда ядра атома, электронной
конфигурации валентных электронов,
расстояния электрона от ядра, числа
внутренних электронных слоев, которые
обусловливают эффекты экранирования
и проникновение электрона к ядру. Чем
меньше энергия ионизации, тем сильнее
проявляются металлические и
восстановительные свойства.
так как образуется катион крепко
удерживает оставшиеся электроны. Энергия
ионизации зависит
от заряда ядра атома, электронной
конфигурации валентных электронов,
расстояния электрона от ядра, числа
внутренних электронных слоев, которые
обусловливают эффекты экранирования
и проникновение электрона к ядру. Чем
меньше энергия ионизации, тем сильнее
проявляются металлические и
восстановительные свойства.
Эффект экранирования заряда ядра обусловленный способностью внутренних электронных слоев ослаблять действие ядра на внешние электроны и уменьшать их связь с ядром. Эффект экранирования возрастает с увеличением электронных слоев.
Энергия сродства к электрону (Е) – это энергия, которая выделяется или поглощается при присоединении электрона к нейтральному невозбужденному атому с образованием аниона.
Единица измерения – кДж/моль или ЭВ.
Сродство к электрону зависит от электронного строения атома: чем больше количество электронов во внешнем электронном слое и меньше радиус атома, тем больше сродство к электрону.
Наибольшее сродство к электрону имеют галогены, чем больше Е, к электрону, тем сильнее выражены неметаллические свойства. Сродство к электрону при возрастании атомного номера элемента изменяется периодически.
Электроотрицательность – это способность атомов присоединять к себе валентные электроны. По Малликену
 Чем больше
Чем больше 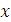 ,
тем сильнее неметаллические свойства.
,
тем сильнее неметаллические свойства.Металлические свойства: характеризуют способность отдавать валентные электроны.
Неметаллические свойства: характеризуют способность присоединять электроны до завершения уровня.
