
- •Лабораторная работа Определение спиртовой группы методом окисления.
- •Лабораторная работа Исследование оксигруппы (фенолов) бромид-броматным методом.
- •Лабораторная работа Определение альдегидной группы йодометрическим методом
- •Лабораторная работа Определение примесей в сульфокислотах титрометрическим методом с хлоридом бария
- •Лабораторная работа Определение нафтолов йодометрическим методом
- •Лабораторная работа Определение анилина методом диазотирования
- •Лабораторная работа Определение кислотного числа
- •Лабораторная работа Определение йодного числа
- •Лабораторная работа Определение числа омыления и эфирного числа
Лабораторная работа Определение анилина методом диазотирования
Цель работы.
Изучить методику определения анилина.
Пояснения к работе.
Диазотированием называют реакцию взаимодействия первичных ароматических аминов с азотистой кислотой, в результате которой образуются соли диазония. Так как азотистая кислота - вещество нестойкое, то применяют ее соли в среде минеральной кислоты. Реакция протекает по схеме:
Ar - NH2 + NaNO2 + 2НСl →[Ar ─ N+2] Сl- + 2Н2О + NaCl.
В качестве титрованного раствора применяют раствор нитрита натрия. Конец диазотирования по йодокрахмальной бумажке в качестве индикатора. Первая капля избыточной азотистой кислоты, нанесенная на индикатор, окисляет иодид-ион до йода. Йод же реагирует с крахмалом и окрашивает индикатор в синий цвет:
2HNO2 + 2НСl + 2КI → 2КСl + I2 + 2NO + 2Н2O.
Диазотированию подвергают не только моноамины, но и некоторые диамины, а также амины, аминогруппы которых расположены в разных ароматических ядрах, например бензидин H2N - С6Н4 - С6Н4 - NH2. Реакция диазотирования протекает количественно при низкой температуре, Т.К. азотистая кислота, которая выделяется при взаимодействии минеральной кислоты с нитритом натрия NaNO2, нестойка и при более высокой температуре разлагается. Кроме того, образующиеся в результате реакции соли диазония при более высокой температуре разлагаются с выделением азота.
На проведение реакции диазотирования и предупреждение возникновения побочной реакции влияет количество минеральной кислоты. В кислой среде получаются более стойкие диазосоединения. Из продуктов диазотирования и свободного амина, находящегося в растворе (побочная реакция), при избытке минеральной кислоты азосоединения не образуются. В слабокислой среде соли диазония легко переходят в гидроокись фенилдиазония, а затем в диазогидрат:
H2O
[Ar─N≡N+]Cl- [Ar─N≡N+]OH-
⇆
Ar–N=N–OH.
[Ar─N≡N+]OH-
⇆
Ar–N=N–OH.
Переход диазосоединений в диазогидраты - обратимый процесс, зависящий от кислотности среды. Поэтому для про ведения диазотирования необходим избыток минеральной кислоты по сравнению с теоретически рассчитанным количеством. Скорость диазотирования зависит от растворимости амина, его природы и расположения заместителей в ядре. Хорошо растворимые амины в воде диазотируются быстро.
Аминосульфокислоты бензольного и нафталинового рядов трудно растворимы в воде, а поэтому медленно диазотируются. Скорость диазотирования таких аминов можно увеличить действием бромисто водородной кислоты. Для этого к кислому раствору добавляют небольшое количество бромида калия. Бромид калия не должен содержать следов бромата калия, который в кислом растворе выделяет свободный бром, вытесняющий йод из иодида калия йодкрахмальной бумажки, и искажает результаты титрования. Поэтому наличие следов бромата калия в используемом продукте предварительно проверяют. В случае применения бромида калия реакцию диазотирования ведут при 15-20°.
Для анализа амин растворяют в кислоте. Если вещество не растворимо в кислоте, то его растворяют в соде или аммиаке и подкисляют перед самым титрованием. Для поддерживания низкой температуры стакан для диазотирования помещают в чашку со льдом. Для диазотирования применяют 1 н., 0,5 н. и 0,1 н. растворы нитрита натрия. Окрашенное пятно на йодокрахмальной бумаге появляется при некотором избытке нитрита. В случае работы с 1 н. или 0,5 н. растворами нитрита натрия избыток не превышает одной капли. Следует иметь ввиду, что на йодокрахмальной бумажке может образоваться синее пятно за счет окисления иона йода кислородом воздуха в среде сильной кислоты и в отсутствии нитрит-иона, поэтому окраску йодокрахмальной бумажки надо наблюдать немедленно после нанесения капли пробы на бумажку. Пятно от нитрита возникает быстро и окрашено ярко в синий цвет с фиолетовым ободком; пятно от кислоты имеет фиолетовый оттенок, несколько буроватый по краям, и появляется медленнее, чем от действия нитритов.
Выполнение определения содержания анилина. Анилин - маслообразная прозрачная жидкость от светло-желтого до красновато-коричневого цвета. Высушенный продукт содержит не менее 99% анилина. Определение количественного содержания анилина в испытуемом продукте основано на реакции диазотирования:
C6H5 - NH2 + NaNO2 + 2HCl → [C6H5 - N+2] Cl- + NaCl + 2Н2О.
NH2 N=N–Cl
| |


+ NaNO2 + 2HCl → + NaCl + 2H2O
Задание.
1. Отобрать пробу технического анилина.
2. Приготовить рабочее место.
3. Выполнить определение по методике.
4. Выполнить необходимые расчеты.
5. Сделать вывод о проделанной работе.
6. Ответить на контрольные вопросы.
Оборудование и реактивы.
1- бюретка;
2 - коническая колба;
3 - набор пипеток от 1 см3 ДО 25 см3;
4 - мерная колба на 100 см3;
5 - соляная кислота (пл. 1,19 г/см3);
6 - нитрит натрия 0,1 н раствор;
7 - сульфаниловая кислота 0,1 н раствор;
8 - бромид калия (ч.д.а.);
9 - йодкрахмальная бумага;
10 - дистиллированная вода.
Работа в лаборатории.
1. Установка концентрации нитрита натрия.
1.1. В коническую колбу отобрать пипеткой 25 см3 сульфаниловой кислоты и 25 см3 дистиллированной воды.
1.2. Подкислить раствор по Конго красному соляной кислотой (Конго синеет) прибавить еще избыток соляной кислоты в количестве 5 см3.
1.3. Титровать нитритом натрия до точки эквивалентности. Точка эквивалентности определяется на вытек на йодкрахмальную бумагу (бумага синеет). Выдержка диазотитрования 5 минут.
2. Выполнение определения.
2.1. Навеску технического анилина перевести в солянокислый анилин. Для перевода к навеске анилина добавить 5 см3 HCl плотностью 1,19 г/см3.
2.2. Соль анилина растворить в воде. Объем раствора довести до метки.
2.3. На титрование в коническую колбу
взять 10 см3 раствора и 10
см3дистиллированной воды. Прилить
2 см3 соляной кислоты ( =1,19
г/см3) и добавить 2,0 г катализатора
KBr.
=1,19
г/см3) и добавить 2,0 г катализатора
KBr.
2.4. Титровать нитритом натрия, соблюдая время выдержки на реакцию диазотирования (5 минут). Первое титрование «грубое». Проверка на точку эквивалентности через каждые 1 см3 прилитого нитрита натрия. Последующие титрования «точные». Приливать нитрит натрия по 0,1 см3. Начать с объема, установленного при грубом титровании. Точка эквивалентности (конечного титрования) наступает, когда капля реакционной жидкости мгновенно окрашивает йодкрахмальную бумагу в синий цвет. Определение ведется до сходимости результатов.
Содержание отчета.
Протокол исследования:
Установка концентрации нитрита натрия.
Vс.к. – объем сульфаниловой кислоты (см3) =
Сс.к. – концентрация сульфаниловой кислоты (моль/дм3) =
V – объем нитрита натрия, пошедший
на титрование сульфаниловой кислоты
(см3) =
– объем нитрита натрия, пошедший
на титрование сульфаниловой кислоты
(см3) =
 (моль/дм3)
(моль/дм3)

m – масса технического анилина (г) =
Vк – объем мерной колбы (см3) =
Vп – объем пипетки (см3) =
 –
концентрация нитрита натрия (моль/дм3)
=
–
концентрация нитрита натрия (моль/дм3)
=
Объемы нитрита натрия, пошедшие на титрование пробы:

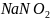 (см3) =
(см3) =
 (см3) =
(см3) =
 (см3) =
(см3) =
Процентное содержание
 в продукте (
)
рассчитывают по формуле:
в продукте (
)
рассчитывают по формуле:

=

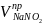 - объем нитрита натрия, пошедший на
титрование пробы, см3;
- объем нитрита натрия, пошедший на
титрование пробы, см3;
Vк – объем колбы, см3;
m – масса навески вещества, г;
Vп– объем пипетки, см3;
=
= =
Погрешность методики ( )10%.
Расчет сходимости
d=( )=
dk=0,1* =
ВОК сходимости пройден, если d<dk
Выводы:
Контрольные вопросы.
1. Для чего приливают соляную кислоту к техническому анилину?
2. Роль бромида калия в реакции диазотирования.
3. Какими реактивами пропитана бумага, почему она синеет от капли реакционной жидкости?
4. Зачем после нейтрализации раствора по Конго добавляют еще избыток?
5. Напишите формулу сульфаниловой кислоты.
Литература.
К.и.Годовская. «Технический анализ». М., Высшая школа, 1972.
