
- •Лабораторная работа Определение спиртовой группы методом окисления.
- •Лабораторная работа Исследование оксигруппы (фенолов) бромид-броматным методом.
- •Лабораторная работа Определение альдегидной группы йодометрическим методом
- •Лабораторная работа Определение примесей в сульфокислотах титрометрическим методом с хлоридом бария
- •Лабораторная работа Определение нафтолов йодометрическим методом
- •Лабораторная работа Определение анилина методом диазотирования
- •Лабораторная работа Определение кислотного числа
- •Лабораторная работа Определение йодного числа
- •Лабораторная работа Определение числа омыления и эфирного числа
Лабораторная работа Исследование оксигруппы (фенолов) бромид-броматным методом.
Цель работы.
Изучить методику определения количественного содержания фенола в техническом продукте. Закрепить полученные знания по дисциплине «Органическая химия». «Свойства органических веществ».
Пояснения к работе.
Методы бромирования и йодирования основаны на способности оксигрупп, содержащихся в ароматических соединениях увеличивать подвижность атомов водорода ядра, что делает возможным легкое замещение последних бромом и йодом. Так ОН- группа в феноле увеличивает подвижность атомов водорода, стоящих в орто- и параположениях:
ОН OH

 Br
Br
Br
Br
 +3Br2
+3HBr
+3Br2
+3HBr
Br
фенол трибромфенол
Направляющее влияние оксигрупп значительно больше, чем влияние других заместителей. Поэтому замещение атомов водорода ядра в оксисоединениях, содержащих мета- , орто- и паразаместители, происходит даже в водном растворе:
ОН OH
Br Br
+3Br2 +3HBr
СН3 СН3
Br
м-кпезол 2,4,6-трибромкрезол
Бромирование орто-и паразамещенных происходит с образованием дигалогензамещенных:
ОН ОН

 СН3
Br
CH3
СН3
Br
CH3
+2Br2 +2HBr2
Br
о-крезол 4,6-дибром-о-крезол
ОН OH
 Br
Br
Br
Br
+2Br2 +2HBr
CH3 CH3
n-крезол 2,6-дибром- n-крезол
Таким образом, на бромирование 1 моль орто- или паразамещенного оксипроизводного бензола расходуется 2 моль галогена, а на 1 моль метазамещенного – 3 моль галогена.
Выполнение определения содержания фенола методом бромирования.
Бромометрический метод анализа фенола основан на том, что фенол в водном растворе количественно образует с бромом трибромфенол. Бромируют фенол в кислой среде раствором смеси бромистого калия KBr и бромноватистого калия KBrO3 (бромид-бромат). В кислой среде бромид-броматная смесь выделяет свободный бром по уравнению:
5 KBr+KBrO3+6HCl 3Br2+6KCl+3H2O
Фенол реагируя с бромом, количественно переходит вначале в трибромфенол:
ОН OH
Br Br
+3Br2 +3HBr
Br
фенол трибромфенол
а затем при избытке брома – в трибромфенолбром:
ОН OBr
Br Br
+Br2 +HBr
Br
трибромфенолбром
Под действием йодистоводородной кислоты трибромфенолбром снова переходит в трибромфенол и не мешает количественному определению фенола данным методом:
ОBr OH
Br Br Br Br
+2HI +HBr +I2_
Br Br
Йодистоводородная кислота выделяется из йодистого калия в кислом растворе:
K I+HCl KCl+HI
Избыток брома, не вступивший в реакцию с фенолом, реагирует с йодистоводородной кислотой с выделением свободного йода:
B r2+2HI 2HBr+I2
Йод титруют серноватистокислым натрием:
I 2+2Na2S2O3 2NaI+Na2S4O6
Данный метод применим для определения фенола в различных препаратах, не содержащих примесей, способных бромироваться, а также для определения чистого фенола.
Задание.
Приготовить пробу технического фенола:
-взвесить на аналитических весах в бюксе навеску технического фенола;
- перенести навеску количественно в мерную колбу, объем довести до метки дистиллированной водой.
Познакомиться с теоретическими основами методики определения фенола.
Провести исследования.
Оформить протокол исследования.
Выполнить необходимые расчеты.
Оценить полученные данные.
Ответить на контрольные вопросы.
Оборудование и реактивы:
Бромид-бромат, 0,1 моль/дм3 раствор.
Серная кислота, 50-ный раствор.
Иодид калия, 10-%-ный раствор.
Тиосульфат натрия, 0,1 моль/дм3 раствор.
Крахмал, 1%-ный раствор.
Мерная колба, 100 см3.
Коническая колба, 250-300 см3.
Мерные пипетки, 1-10 см3.
Бюретка.
Работа в лаборатории.
При определении фенола в фармацевтических препаратах (камфорно-фенольной пасте) навеску продукта около 1г, взятую с точностью до 0.0002г, помещают в стаканчик емкостью 50 мл, добавляют 15 мл дистиллированной
воды, тщательно растирают стеклянной палочкой и фильтруют через складчатый фильтр. Стаканчик и фильтр промывают 2-3 раза по 15 мл дистиллированной водой. Фильтрат и промывные воды собирают в колбу емкостью 100 мл, содержимое колбы доводят до метки водой и тщательно перемешивают. Пипеткой отбирают 10 мл фильтрата в колбу емкостью 200-250 мл с притертой пробкой, добавляют 25 мл 0,1 Н раствора бромид-бромата, 10 мл 50%-ного раствора серной кислоты. Жидкость в колбе тщательно перемешивают и оставляют на 15 минут в темном месте. После этого к смеси прибавляют 15 мл 10%-ного раствора йодистого калия, сильно взбалтывают, оставляют на 10 минут в темном месте. Выделившийся йод титруют 0,1 Н раствором тиосульфата натрия до соломенно-желтого цвета, затем добавляют около 1 мл 1%-ного крахмала и титруют до исчезновения синей окраски раствора. Параллельно ставят холостой опыт в тех же условиях с теми же реактивами, но без анализируемой пробы.
Содержание отчета.
Протокол исследования:
m – масса технического фенола (г) =
V – объем мерной колбы (см3) =
V – объем пипетки (см3) =
C – концентрация тиосульфата (моль/дм3) =
V – объем бромид-бромата (см3) =
Объемы тиосульфата натрия, пошедшие на титрование пробы:
V1 (см3) =
V2 (см3) =
V3 (см3) =
Объемы тиосульфата натрия, пошедшие на титрование холостого опыта:
V (см3) =
V (см3) =
Vср. (см3) =
Процентное содержание фенола в продукте ( ) рассчитывают по формуле:

=
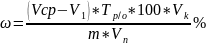
V1 – объем тиосульфата натрия, израсходованный на титрование пробы;
Vср – объем тиосульфата натрия, израсходованный на титрование холостого опыта;
Тр/о – титр тиосульфата натрия по фенолу;
Vк – объем мерной колбы;
Vп – объем пипетки;
m – масса технического фенола.

 =
=

 =
= =
=
Погрешность методики ( )10%.
Расчет сходимости
d=( )=
)=
dk=0,1 =
=
ВОК сходимости пройден, если d<dk
Выводы:
Контрольные вопросы:
В какой среде протекает реакция бромирования?
Из каких исходных веществ и при каких условиях идет реакция получения брома?
Какое вещество выпадет в осадок при избытке брома? Как избежать его отрицательного влияния на точность определения фенола?
Назовите назначение серной кислоты при определении фенола.
Какой индикатор применяют при определении фенола?
Литература.
К.И.Годовская. Технический анализ. М., Высшая школа, 1972.
