Білкові речовини: амінокислоти, білки Основні питання:
Амінокислоти: класифікація, ізомерія, номенклатура, фізичні і хімічні властивості, способи одержання, біологічна роль.
Пептиди: номенклатура, способи одержання, фізичні та хімічні властивості.
Білки:
методи виділення;
рівні структурної організації білкової молекули;
фізико-хімічні властивості білків;
хімічні властивості;
класифікація білків.
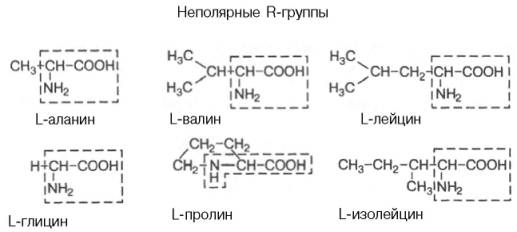
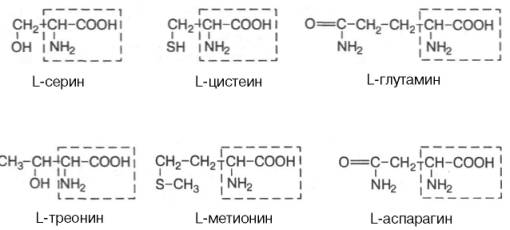
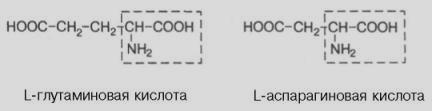
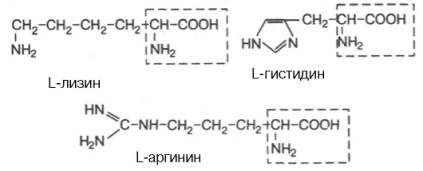
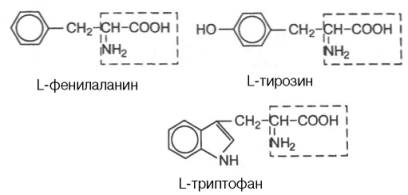
Амінокислоти – похідні карбонових кислот, у радикалі яких один або декілька атомів Гідрогену заміщено на аміногрупу – NH2.
Класифікація амінокислот:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ізомерія амінокислот:
ізомерія карбонового радикала;
ізомерія по місцеположенню в радикалі аміногрупи;
оптична ізомерія (крім гліцину).
Номенклатура амінокислот:
Тривіальна номенклатура (історичні назви): аргінін, лізин, гліцин.
Раціональна номенклатура. Вказують місце розміщення аміногрупи у вуглеводневому радикалі літерами грецького алфавіту (α, β, λ) + назва карбонової кислоти:
СН3СНNH2COOH – α-амінопропіонова кислота.
Номенклатура ІЮПАК. Цифрами вказують місце розміщення аміногрупи і радикала + назва кислоти (за вуглеводнем):
СН3СН(СН3)СНNH2COOH ‑ 2 аміно-3-метилбутанова кислота.
Фізичні властивості:
Амінокислоти – безбарвні кристалічні речовини, добре розчинні у воді, мають високі температури плавлення, можуть розкладатися. Кристалізуються з розчинів у вигляді біполярних іонів. Більшість D-амінокислот солодкі, L-амінокислоти гіркі або без смаку.
У воді амінокислоти дисоціюють: |
|
|
[ОН-]↑, Кр → (кислотні властивості), у вигляді аніонів |
|
[Н+]↑, Кр → (основні властивості), у вигляді катіонів. |
Хімічні властивості:
Амфотерні властивості (взаємодія з мінеральними кислотами та основами з утворенням солей).
Утворення солей з кислотами
NH2 – CH2 – COOH + НСІ → [+NH3 – CH2 – COOH] CI- (хлорид гліцину)
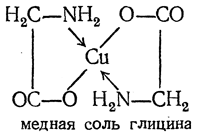
Утворення солей з основам: звичайних солей з лугами та внутрішньо комплексних солей з купрумом (ІІ) інтенсивно-синього кольору:
Утворення внутрішніх солей (цвіттер-іонів)
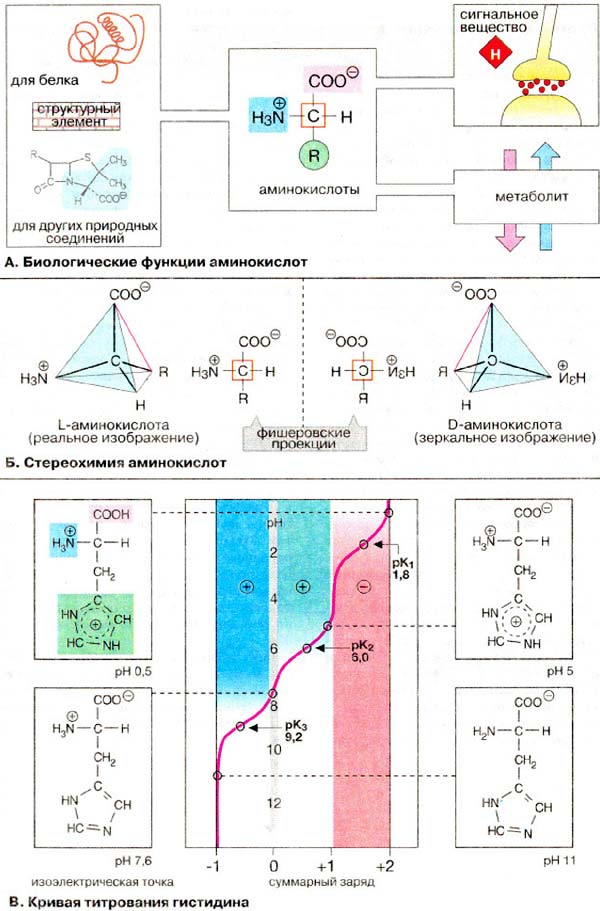
B aмінoкиcлотax містяться дві іоногенні групи тому їх сyмapний зapяд залежить від значення pH середовища.
NH2 – CH2 – COOH ↔ +NH3 – CH2 – COO-
гліцин внутрішня сіль
В молекулі гістидину поряд з карбоксильною та аміногрупою наявний імідазольний залишок. Тому при підвищенні рН середовища заряд гістидину змінюється від +2 до -1. При рН = 7,6 сумарний заряд дорівнює нулю, назважаючи на наявність двох повністю іонізованих груп в молекулі гістидину.
Величина рН, при якій сумарний заряд дорівнює нулю, називається ізоелектричною точкою.
В ізоелектричній точці гістидин є цвіттер-іоном, тобто молекула виявляє властивості як аніона так і катіона. B нейтральній області рН більшість амінокислот також є цвіттер-іонами.
Утворення естерів. О
![]()
 NH2
– CH2
– C – O – CH3
NH2
– CH2
– C – O – CH3
гліцин метиловий естер гліцину (метилгліционат)
Реакцію використовують для розділення і виділення амінокислот із білкових гідролізатів.
Утворення хлорангідридів відбувається при взаємодії амінокислот з пентахлоридом фосфору, утворюються хлорангідриди амінокислот. Вони нестійкі і існують тільки у вигляді солей:
![]()