
- •1) Потенциал действия и его развитие. 2) Синаптическая передача. 19
- •Строение белков
- •3. Полярные (гидрофильные)
- •Биологические функции белков
- •Таким образом, свойства, необходимые этому структурному белку – слабая растяжимость, прочность и гибкость определяются особенностями его строения.
- •1) Потенциал действия и его развитие. 2) Синаптическая передача.
- •Таким образом, свойства, определяющие способность глобинов обратимо связывать кислород и передавать его друг другу, определяются особенностями их строения.
1) Потенциал действия и его развитие. 2) Синаптическая передача.
Итак, нам уже известны следующие факты:
Мышечное сокращение
М
 ышечное
сокращение – результат работы весьма
сложного и мощного белкового аппарата,
который в зачаточной форме присутствует
почти во всех эукариотических клетках.
В процессе эволюции мышечных клеток
элементы цитоскелета подверглись
сильной гипертрофии и специализации,
что сделало сократительный механизм
мышц чрезвычайно стабильным и эффективным.
В поперечнополосатой мускулатуре, к
которой относятся скелетные и сердечная
мышцы, а также сходные ткани беспозвоночных
(например, летательные мышцы насекомых),
структурная организация сократительного
аппарата достигает такой степени, что
можно непосредственно наблюдать его
работу, и при этом сразу выявляется ряд
важных свойств составляющих его молекул.
ышечное
сокращение – результат работы весьма
сложного и мощного белкового аппарата,
который в зачаточной форме присутствует
почти во всех эукариотических клетках.
В процессе эволюции мышечных клеток
элементы цитоскелета подверглись
сильной гипертрофии и специализации,
что сделало сократительный механизм
мышц чрезвычайно стабильным и эффективным.
В поперечнополосатой мускулатуре, к
которой относятся скелетные и сердечная
мышцы, а также сходные ткани беспозвоночных
(например, летательные мышцы насекомых),
структурная организация сократительного
аппарата достигает такой степени, что
можно непосредственно наблюдать его
работу, и при этом сразу выявляется ряд
важных свойств составляющих его молекул.
Сократительными элементами клеток скелетной мышцы служат миофибриллы
Длинные, тонкие мышечные волокна, из которых построена скелетная мышца – это гигантские клетки, образующиеся в ходе онтогенеза при слиянии множества отдельных клеток. Они получаются многоядерными, причем ядра располагаются прямо под плазматической мембраной. Основная же часть цитоплазмы (около двух третей сухого веса) состоит из миофибрилл – цилиндрических элементов толщиной 1-2 мкм, которые часто тянутся от одного конца клетки до другого. На изолированных миофибриллах отчетливо видны поперечные полоски, от которых и зависит характерная поперечная исчерченность клеток скелетных мышц. Если к изолированным миофибриллам добавить АТР и Са2 + , они тотчас же сократятся – значит, именно они служат генераторами силы при сокращении мышечных клеток. Каждая миофибрилла представляет собой цепь миниатюрных сократимых единиц, состоящих из регулярным образом расположенных систем толстых и тонких нитей (филаментов).
Миофибриллы построены из повторяющихся ансамблей толстых и тонких филаментов
Регулярно повторяющиеся единицы, образующие миофибриллы и придающие им характерную исчерченность – саркомеры – имеют длину около 2,5 мкм. При большом увеличении в миофибрилле можно видеть широкие темные и светлые полосы, а посередине каждой светлой полосы – плотную линию, которая отделяет один саркомер от другого и называется Z-линией.
У

 льтраструктурная
основа поперечной исчерченности была
выявлена в 1953г. в одной из первых работ
по электронной микроскопии биологического
материала. Оказалось, что в состав
каждого саркомера входят два набора
параллельных, частично перекрывающихся
филаментов: толстых,
которые
образуют темную полосу и тянутся от
одного ее края до другого, и тонких,
лежащих в
области светлой полосы и частично
проникающих в соседние темные полосы.
Толстые
филаменты организованы в виде правильной
гексагональной решетки, причем каждый
толстый филамент окружен тонкими, тоже
расположенными регулярно.
Наверху
льтраструктурная
основа поперечной исчерченности была
выявлена в 1953г. в одной из первых работ
по электронной микроскопии биологического
материала. Оказалось, что в состав
каждого саркомера входят два набора
параллельных, частично перекрывающихся
филаментов: толстых,
которые
образуют темную полосу и тянутся от
одного ее края до другого, и тонких,
лежащих в
области светлой полосы и частично
проникающих в соседние темные полосы.
Толстые
филаменты организованы в виде правильной
гексагональной решетки, причем каждый
толстый филамент окружен тонкими, тоже
расположенными регулярно.
Наверху
электронные микрофотографии поперечного среза летательной мышцы насекомого. Видна кристаллоподобная упаковка толстых и тонких филаментов. У насекомых в отличие от позвоночных толстые филаменты имеют продольную центральную полость, что можно видеть при более сильном увеличении (справа).
С
 окращение
– результат скольжении тонких и толстых
филаментов друг относительно друга.
окращение
– результат скольжении тонких и толстых
филаментов друг относительно друга.
При сокращении мышцы пропорционально укорачивается и каждый саркомер. Если миофибрилла, состоящая из 20000 саркомеров, укорачивается с 5см до 4см (т.е. на 20%), длина каждого саркомера соответственно уменьшится с 2,5 до 2 мкм.
При укорочении саркомера сжимаются только светлые полосы, а темная полоса своих размеров не меняет. Это можно легко объяснить, предположив, что сокращение вызывается скольжением тонких филаментов относительно толстых без изменения длины тех и других. Эта «модель скользящих нитей», впервые предложенная в 1954г., сыграла решающую роль в понимании механизма мышечного сокращения. Она, в частности, привлекла внимание к молекулярным взаимодействиям, лежащим в основе взаимного скольжения соприкасающихся толстых и тонких филаментов.
Ультраструктурную основу этого взаимодействия удается выявить с помощью электронной микроскопии высокого разрешения. Оказалось, что от толстых филаментов отходят многочисленные боковые отростки, или поперечные мостики, соприкасающиеся с тонкими нитями, которые лежат на расстоянии около 13 нм от толстых. При сокращении мышцы толстые и тонкие филаменты протягиваются друг относительно друга с помощью этих мостиков, работающих циклично, как миниатюрные весла.
Взаимодействующие белки тонких и толстых филаментов были идентифицированы как актин и миозин соответственно. Актин, которого в цитоскелете больше, чем какого-либо другого белка, часто образует вместе с миозином структуры, способные к сокращению. Хотя эти белки имеются почти во всех эукариотических клетках, большая часть знаний об их свойствах первоначально была получена в биохимических экспериментах с актином и миозином, выделенными из мышцы.
Молекулярная организация миофибрилл.
Архитектура миофибрилл.
Удивительная сила и быстрота мышечного сокращения обусловлена тем, что в каждой миофибрилле актиновые и миозиновые филаменты находятся на оптимальном расстоянии друг от друга и в правильном расположении. Тонкую организацию миофибрилл обеспечивает группа структурных белков, из которых больше дюжины уже идентифицировано. Примеры:
Актиновые филаменты «заякорены» своими плюс-концами в Z-диске, где их удерживают в правильно организованной решетке другие белки. Из них лучше всего охарактеризован α-актинин – актин-связывающий белок, имеющийся в большинстве животных клеток. В мышечных клетках он находится в области Z-диска. Очищенный α-актинин – биполярная палочковидная молекула, которая может связывать актиновые филаменты в параллельные пучки.
Аналогичную функцию в случае миозина выполняет белок миомезин, который сшивает соседние миозиновые филаменты в области М-линии (посередине биполярного толстого филамента), собирая их в гексагональную упаковку.
Стабилизирует упаковку миозиновых филаментов еще одна группа миозин-связывающих белков, выявляемых при окраске антителами как серия из 11 регулярно расположенных бледных полосок по обе стороны от М-линии.
Группа филаментов, построенных из очень крупного белка, названного титином, тянется параллельно толстым и тонким филаментам и соединяет толстые филаменты с Z-диском. Титиновые филаменты очень эластичны и, по-видимому, действуют как пружины, «центрируя» толстые филаменты между Z-дисками.
П
 ромежуточные
филаменты, которые расположены между
Z-дисками
соседних миофибрилл, удерживают саркомеры
в определенных пространственных
отношениях между собой и соединяют
миофибриллы с плазматической мембраной
мышечной клетки.
ромежуточные
филаменты, которые расположены между
Z-дисками
соседних миофибрилл, удерживают саркомеры
в определенных пространственных
отношениях между собой и соединяют
миофибриллы с плазматической мембраной
мышечной клетки.
Миозин и миозиновые (толстые) филаменты.
Миозин.
Миозин есть почти во всех клетках позвоночных и всегда находится в сократительных пучках, образуемых в цитоплазме актиновыми филаментами. Миозин – эволюционно гораздо менее консервативный белок, чем актин, и известно несколько его форм.
Электронные микрофотографии молекул миозина (напыление платиной).
Обратите внимание, что каждая молекула состоит из двух глобулярных
головок, прикрепленных к фибриллярному хвосту.
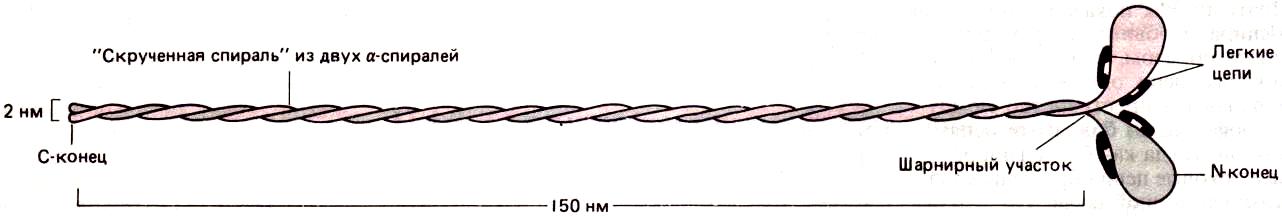
Миозин – основной компонент толстых нитей. Он является гексамером (Mr ≈ 500000Да) – каждая молекула состоит из двух одинаковых больших (тяжелых) и четырех малых (легких) полипептидных цепей. Каждая большая цепь состоит из двух частей: вытянутого «хвоста», имеющего α-спиральную конформацию, и глобулярной «головки» на небольшой «шейке». Хвосты обеих больших цепей заплетены друг вокруг друга. Жесткость «хвостов» определяется наличием общего структурного элемента, в котором две α-спирали благодаря особому расположению гидрофобных аминокислотных остатков обвиваются друг около друга, образуя «скрученную спираль». Эти две спирали направлены параллельно (ориентация N- и С-концов у них совпадает) и объединены в нить длиной 140-150 нм и толщиной около 2 нм.

Топология «скрученной спирали». Слева одиночная а-спираль представлена в виде цилиндра, где боковые цепи аминокислот обозначены семичленной последовательностью букв abcdefg (снизу вверх). Аминокислоты а и d в этой последовательности оказываются на поверхности цилиндра рядом, образуя «полосу» (выделена цветом), которая медленно оборачивается вокруг а-спирали. Белки, образующие скрученную спираль, как правило, имеют в положениях a и d гидрофобные аминокислоты. Поэтому, как показано справа, две а-спирали обвивают друг друга таким образом, что гидрофобные боковые цепи одной а-спирали попадают в пространство между гидрофобными боковыми цепями другой, тогда как более гидрофильные боковые цепи обращены к окружающей водной среде.

Глобулярная головка каждой большой цепи находится в комплексе с двумя малыми цепями; весь комплекс также является глобулярным. Таким образом, молекула миозина имеет две глобулярные головки на шейках и один фибриллярный двухцепочечный хвост. Это подтверждается тем, что протеолитический фермент папаин расщепляет молекулу миозина на длинный α-спиральный участок, называемый миозиновым стержнем (или миозиновым хвостом), и две раздельные глобулярные миозиновые головки, называемые также субфрагментами-1 или S1-фрагментами.
Эти части молекулы выполняют разные функции – хвост ответствен за самопроизвольную сборку толстых филаментов, а с помощью головок осуществляется взаимодействие с актином и движение миозиновых филаментов относительно прилегающих актиновых нитей.
М
 олекула
миозина построена из двух тяжелых цепей
(каждая длиной около 2000 аминокислотных
остатков) и четырех легких цепей. Легкие
цепи представлены молекулами двух типов
(в одних около 190 аминокислотных остатков,
в других около 170)-по одной молекуле
каждого типа в каждой миозиновой головке.
олекула
миозина построена из двух тяжелых цепей
(каждая длиной около 2000 аминокислотных
остатков) и четырех легких цепей. Легкие
цепи представлены молекулами двух типов
(в одних около 190 аминокислотных остатков,
в других около 170)-по одной молекуле
каждого типа в каждой миозиновой головке.
Миозиновые филаменты
Толстые филаменты имеют диаметр 15 нм и образованны в основном именно миозином.
В

 то время как структура отдельных молекул
миозина определяется гидрофобными
взаимодействиями между двумя α-
спиральными тяжелыми цепями, структура
толстых филаментов, образуемых миозином
в мышце, зависит от ионных взаимодействий
между хвостами. В мышечных клетках эти
взаимодействия стабилизируются
различными сопутствующими белками, и
получающиеся в результате толстые
филаменты образованы сотнями миозиновых
хвостов, упакованных в плотные
упорядоченные пучки, из которых торчат
миозиновые головки на шейках расположенные
«лесенкой»,
получившие название поперечных мостиков.
Они ориентированы по отношению к оси
миозиновой нити под углом 120°. Каждая
головка содержит АТРазный центр и четыре
актин-связывающих центра. Шейка обладает
эластическими свойствами и представляет
собой шарнирное соединение, поэтому
головка поперечного мостика может
поворачиваться вокруг своей оси.
то время как структура отдельных молекул
миозина определяется гидрофобными
взаимодействиями между двумя α-
спиральными тяжелыми цепями, структура
толстых филаментов, образуемых миозином
в мышце, зависит от ионных взаимодействий
между хвостами. В мышечных клетках эти
взаимодействия стабилизируются
различными сопутствующими белками, и
получающиеся в результате толстые
филаменты образованы сотнями миозиновых
хвостов, упакованных в плотные
упорядоченные пучки, из которых торчат
миозиновые головки на шейках расположенные
«лесенкой»,
получившие название поперечных мостиков.
Они ориентированы по отношению к оси
миозиновой нити под углом 120°. Каждая
головка содержит АТРазный центр и четыре
актин-связывающих центра. Шейка обладает
эластическими свойствами и представляет
собой шарнирное соединение, поэтому
головка поперечного мостика может
поворачиваться вокруг своей оси.
П
 ри
взаимодействии две первые молекулы
миозина, выступающие впоследствии в
качестве «центра конденсации», имеют
противоположную ориентацию головок.
Подобная ориентация сохраняется и в
ходе дальнейшей сборки филамента. Такая
структура оказывается биполярной, с
«голой» (без миозиновых головок)
центральной областью, где соединяются
противоположно направленные пучки
миозиновых хвостов. Миозиновый филамент
оказывается симметричным относительно
«голой зоны». Глобулярные головки
миозина взаимодействуют с актином,
образуя поперечные мостики между
толстыми и тонкими филаментами.
ри
взаимодействии две первые молекулы
миозина, выступающие впоследствии в
качестве «центра конденсации», имеют
противоположную ориентацию головок.
Подобная ориентация сохраняется и в
ходе дальнейшей сборки филамента. Такая
структура оказывается биполярной, с
«голой» (без миозиновых головок)
центральной областью, где соединяются
противоположно направленные пучки
миозиновых хвостов. Миозиновый филамент
оказывается симметричным относительно
«голой зоны». Глобулярные головки
миозина взаимодействуют с актином,
образуя поперечные мостики между
толстыми и тонкими филаментами.
Толстый миозиновый филамент. Электронная микрофотография толстого филамента из мышцы морского гребешка и схема строения. «Голая» зона в центре содержит только хвосты миозина.
Актин и актиновые (тонкие) филаменты.
Актин.
Актин имеется у всех эукариот, включая одноклеточных (например, у дрожжей). Гены актина эволюционно крайне консервативны, так что актины весьма далеких друг от друга организмов в опытах in vitro функционально взаимозаменяемы. Актин обладает сильно выраженной способностью к агрегации, протекающей с образованием надмолекулярных структур в виде суперспирализованных длинных двойных нитей.
G-актин (G – глобулярный).
Одиночная полипептидная цепь актина длиной в 375 аминокислотных остатков (Mr ≈ 48000Да) сворачивается в глобулярную третичную структуру, с которой нековалентно связана одна молекула АТР. Такой актин называют глобулярным, или G-актином. Глобулы G-актина способны к полимеризации в мультимер, образуя фибриллярную четвертичную структуру с неопределенным числом мономеров – F-актин.
F-актин (F – фибриллярный).
При полимеризации G-актина связанный АТР гидролизуется, отщепляя концевой фосфат, а актин образует филаменты F-актина. По своей структуре F-актин внешне похож на две нитки бус, в которых бусинками служат однотипно ориентированные мономеры G-актина. Они обладают полярностью, т. е. два их конца различны. Эта полярность играет важную роль в осуществлении подвижности клеток и легче всего обнаруживается в ориентированных комплексах, которые каждый актиновый мономер образует с миозином. Зрительно нити закручены друг вокруг друга в плотную спиральную структуру с шагом 36-38 нм и толщиной около 7 нм.
П
 олимеризацию
можно вызвать, просто повысив концентрацию
соли до уровня, близкого к физиологическому;
при этом раствор G-актина,
лишь ненамного более вязкий, чем вода,
быстро «густеет» по мере образования
филаментов F-актина.
Хотя в процессе полимеризации и происходит
гидролиз связанного АТР, сама полимеризация
энергии не требует. Она идет, даже если,
с актином связан ADP.
Однако гидролиз АТР оказывает существенное
влияние на динамическое поведение
актиновых филаментов; это проявляется
в тех видах клеточной активности,
которые (в отличие от мышечного сокращения)
зависят от контролируемой полимеризации
и деполимеризации актина, например –
в кортексе цитоскелета.
олимеризацию
можно вызвать, просто повысив концентрацию
соли до уровня, близкого к физиологическому;
при этом раствор G-актина,
лишь ненамного более вязкий, чем вода,
быстро «густеет» по мере образования
филаментов F-актина.
Хотя в процессе полимеризации и происходит
гидролиз связанного АТР, сама полимеризация
энергии не требует. Она идет, даже если,
с актином связан ADP.
Однако гидролиз АТР оказывает существенное
влияние на динамическое поведение
актиновых филаментов; это проявляется
в тех видах клеточной активности,
которые (в отличие от мышечного сокращения)
зависят от контролируемой полимеризации
и деполимеризации актина, например –
в кортексе цитоскелета.
Актиновые филаменты
F-актин – основной, но не единственный компонент тонких (7 нм в диаметре) филаментов. Помимо актина в их состав входят тропомиозин и тропонин.
Тропомиозин (назван из-за внешнего сходства с миозином на рентгеновских дифрактограммах) – жесткая стержневидная молекула длиной 41нм. Как и хвост миозина, тропомиозин представляет собой димер, состоящий из двух одинаковых α-спиральных цепей по 284 аминокислоты в каждой. Цепи обвиваются друг около друга. Тропомиозин связан с F-актином. Каждая молекула тропомиозина охватывает семь G-актиновых глобул, причем соседние его молекулы немного перекрываются между собой, так что образуется непрерывная тропомиозиновая цепь, идущая вдоль F-актинового волокна. Поскольку F-актин состоит из двух ниток, с ним связаны и две тропомиозиновые цепочки.
Тропонин – еще один важный вспомогательный белок тонких нитей, участвующий в регулировании функции скелетных мышц позвоночных ионами кальция. Он представляет собой комплекс из трех полипептидов – тропонинов Т, I и С (названных так за свои тропомиозин-связывающие, ингибиторные и Са2+- связывающие свойства соответственно). Тропониновый комплекс имеет более или менее глобулярную, несколько удлиненную форму, причем субъединицы С и I образуют глобулярную головку, а тропонин Т – хвост.
Хвост тропонина Т связывается с одной молекулой тропомиозина и определяет положение всего комплекса на тонком филаменте через правильные промежутки, равные примерно 38 нм. Таким образом, в актиновом филаменте на каждые семь мономеров актина приходится одна молекула тропомиозина и один тропониновый комплекс.
Тропонин I присоединяется к актину, и, опосредованно ингибирует его взаимодействие с миозином: в покоящейся мышце связывание тропонина I с актином ведет к перемещению тропомиозина на актиновом филаменте в то самое место, с которым в сокращающейся мышце контактируют миозиновые головки, и в результате взаимодействие актина с миозином подавляется.
Т
 ропонин
С способен
связывать четыре иона Са2+,
а в комплексе с Са2+
он ослабляет ингибирующее действие
других компонентов на связывание миозина
с актином (см. далее). Тропонин
С – близкий «родственник» белка
кальмодулина,
который участвует в Са2+-
зависимых ответах всех клеток, в том
числе в активации миозина в гладких
мышцах.
ропонин
С способен
связывать четыре иона Са2+,
а в комплексе с Са2+
он ослабляет ингибирующее действие
других компонентов на связывание миозина
с актином (см. далее). Тропонин
С – близкий «родственник» белка
кальмодулина,
который участвует в Са2+-
зависимых ответах всех клеток, в том
числе в активации миозина в гладких
мышцах.
Расположение тропомиозина и тропонина на актиновом филаменте.
Каждая молекула тропомиозина имеет семь регулярно расположенных участков с гомологичной последовательностью. Каждый такой участок связывается с мономером актина. Обратите внимание, что концы соседних молекул тропомиозина слегка перекрываются, как если бы они полимеризовались вдоль актинового филамента «головой к хвосту»
Молекулярные механизмы мышечного сокращения:
А. Электрохимическое преобразование:
1. Генерация ПД на сарколемме (плазмалемме мышечного волокна).
Передача возбуждения с двигательного мотонейрона на мышечное волокно происходит с помощью медиатора ацетилхолина (АХ). Взаимодействие АХ с холинорецепторами концевой пластинки (постсинаптической мембраны нервно-мышечного синапса) приводит к активации АХ-чувствительных Na+-каналов и деполяризации концевой пластинки. По достижении значения порогового потенциала, эта область концевой пластинки становится источником раздражающего тока для потенциал-зависимых Na+-каналов сарколеммы, и на участках, прилегающих к концевой пластинке, возникает ПД, который распространяется в обе стороны со скоростью примерно 3-5 м/с при температуре 36 oС. Таким образом, генерация ПД является первым этапом мышечного сокращения.
2. Распространение ПД по Т-системе.
Вторым этапом является распространение ПД внутрь мышечного волокна по поперечной системе Т-трубочек, которая служит связующим звеном между поверхностной мембраной и сократительным аппаратом мышечного волокна.
3. Выброс ионов Са2+ из цистерн саркоплазматического ретикулума в межфибриллярное пространство.
Т-система тесно контактирует с терминальными цистернами саркоплазматической сети, которые окружают каждую миофибриллу на участке двух соседних саркомеров подобно сетчатому чулку. Электрическая стимуляция места контакта приводит к активации ферментов, расположенных в месте контакта и образованию посредника – инозитолтрифосфата. Инозитолтрифосфат активирует (открывает) кальциевые каналы мембран терминальных цистерн, что приводит к выходу ионов Са2+ из цистерн и повышению межфибриллярной внутриклеточной концентрации Са2+ с 107до 105 M.
Система мембран, передающая сигнал к сокращению от плазматической мембраны мышечной клетки ко всем ее миофибриллам.
На электронной микрофотографии видны две Т-трубочки и большие каналы для выброса Са2+ в мембране саркоплазматического
ретикулума, которые выглядят как прямоугольные «ножки», соединенные с мембраной соседней Т-трубочки.

Таким образом, на первых трех этапах происходит преобразование электрического сигнала ПД в химический – повышение внутриклеточной концентрации Са2+, т. е. электрохимическое преобразование.
Б. Хемомеханическое преобразование:
4. Взаимодействие ионов Са2+ с тропонином приводит к освобождению активных центров на актиновых филаментах.
При повышении уровня Са2+ тропонин С, связав четыре Са2+ на молекулу, меняет свою конформацию и заставляет тропонин I «отцепиться» от актина. Это позволяет тропомиозину, в свою очередь изменив конформацию, сместиться в желобок между нитями актина, при этом на актиновых нитях открываются участки, с которыми могут взаимодействовать поперечные мостики миозина.
Следовательно, участие ионов Са2+ в механизме взаимодействия актина и миозина опосредовано через тропонин и тропомиозин.
5. Взаимодействие миозиновой головки с актином, вращение головки и развитие механической тяги.
С
 ледующим,
пятым, этапом электромеханического
сопряжения является присоединение
головки поперечного мостика к первому
из нескольких последовательно
расположенных свободных центров
актинового филамента – образование
комплекса, именуемого актомиозином.
При этом миозиновая головка поворачивается
вокруг своей оси, поскольку имеет четыре
активных центра, которые последовательно
взаимодействуют с соответствующими
центрами на актиновом филаменте (каждый
последующий центр в ходе реакции
приобретает все большее сродство к
актину). Вращение головки приводит
к увеличению упругой эластической тяги
шейки поперечного мостика и увеличению
напряжения. В каждый конкретный момент
в процессе развития сокращения одна
часть головок поперечных мостиков
находится в соединении с актиновым
филаментом, другая свободна, т. е.
существует последовательность их
взаимодействия с актиновым филаментом.
Это обеспечивает плавность процесса
сокращения.
ледующим,
пятым, этапом электромеханического
сопряжения является присоединение
головки поперечного мостика к первому
из нескольких последовательно
расположенных свободных центров
актинового филамента – образование
комплекса, именуемого актомиозином.
При этом миозиновая головка поворачивается
вокруг своей оси, поскольку имеет четыре
активных центра, которые последовательно
взаимодействуют с соответствующими
центрами на актиновом филаменте (каждый
последующий центр в ходе реакции
приобретает все большее сродство к
актину). Вращение головки приводит
к увеличению упругой эластической тяги
шейки поперечного мостика и увеличению
напряжения. В каждый конкретный момент
в процессе развития сокращения одна
часть головок поперечных мостиков
находится в соединении с актиновым
филаментом, другая свободна, т. е.
существует последовательность их
взаимодействия с актиновым филаментом.
Это обеспечивает плавность процесса
сокращения.
Каждая молекула актина в составе актинового филамента способна связать одну миозиновую головку. Образующиеся при этом актомиозиновые комплексы выдают структурную полярность актиновых филаментов.
Поскольку миозиновые головки имею наклон 120˚, в электронном микроскопе препараты миозиновых филаментов имеют весьма характерный вид: каждая миозиновая головка образует боковой выступ, и все множество этих выступов создает впечатление, что на филамент справа и слева от голой зоны симметрично нанизаны наконечники стрел. Поскольку миозиновые головки присоединяются к каждой субъединице актина в одинаковой ориентации, такая картина означает, что все актиновые молекулы тоже ориентированы вдоль оси филамента в одном направлении. Таким образом, два конца актинового филамента структурно различаются. Их назвали соответственно минус-концом (или заостренным концом, т. е. тем, к которому направлены острия стрел) и плюс-концом (или оперенным концом, к которому обращены хвосты стрел). Плюс-концы каждого актинового филамента закреплены в Z-диске, а минус-концы направлены в сторону толстых филаментов. Миозиновые головки «шагают» по актиновому филаменту в направлении к плюс-концу.

Тонкие и толстые филаменты в саркомере перекрываются, причем их полярность симметрична относительно средней линии саркомера.
Таким образом, на четвертом и пятом этапах происходит хемомеханическое преобразование.
6. Отделение головки поперечного мостика миозина сопряжено с гидролизом АТР.
На завершеющей стадии поворота миозиновой головки активизируется работа ее АТР-азного центра. АТР (связанная с АТРазным центром на миозиновой головке) гидролизуется и освобожденная при этом энергия запасается в виде конформационного изменения в молекуле миозина. Миозиновая головка отходит, выпрямляясь на шейке, и затем вновь готова присоединиться к следующему центру, расположенному по длине актинового филамента, и повторить цикл. Во время одиночного сокращения каждый поперечный мостик по мере своего продвижения к Z–пластинке вдоль актинового филамента прикрепляется, подтягивается и отсоединяется множество раз.
Миозин и сам по себе действует как АТР-аза, но он не может освободится от продуктов гидролиза – ADP и неорганического фосфата (Pi). Оставаясь связанными с его АТР-азным центром, они препятствуют присоединению и последующему гидролизу новых молекул АТР. В лабораторных условиях в присутствии актиновых филаментов АТРазная активность миозина резко возрастает. Каждая молекула миозина начинает гидролизовать от 5 до 10 молекул АТР в секунду, что сравнимо со скоростью гидролиза в сокращающейся мышце. Это объясняется тем, что связывание миозина с актиновым филаментом ведет к быстрому отделению ADP и Рi от АТР-азного центра головки миозина, в результате чего последняя может связывать новые молекулы АТР и возобновлять цикл.
7. Скольжение нитей актина и миозина относительно друг друга.
Последовательная реакция соединения и разъединения головок поперечных мостиков с актиновым филаментом приводит к скольжению тонких и толстых нитей относительно друг друга, уменьшению размеров саркомера и общей длины мышцы, что является последним этапом. На каждом толстом филаменте сидит около 500 миозиновых головок, и каждая головка при быстром сокращении мышцы проходит примерно 5 рабочих циклов за секунду; в результат скорость скольжения тонких филаментов относительно толстых достигает 15 мкм/с.
Так как время прохождения сигнала от плазматической мембраны через Т-трубочки и саркоплазматический ретикулум до каждого из саркомеров измеряется миллисекундами, сокращение всех миофибрилл в клетке происходит одновременно. Повышение концентрации Са2+ в цитозоле кратковременно, поскольку ионы Са2+ быстро перекачиваются обратно в саркоплазматический ретикулум Са2+-АТРазой (белковым насосом), которой в его мембране очень много. Обычно возвращение концентрации Са2+ в цитозоле к уровню покоя происходит за 30 мс, что приводит к расслаблению миофибрилл.
Между структурой саркотубулярной системы и функцией мышцы существует интересная связь. Те мышцы, которые сокращаются и расслабляются очень быстро, имеют высокоразвитый СР и обширную сеть Т-трубочек. А те мышцы, сокращение и расслабление которых происходит медленно, соответственно имеют менее развитый СР. Различные скорости сокращения и расслабления, по-видимому, коррелируют с эффективностью СР в регуляции изменений концентрации кальция, которые в свою очередь запускают и останавливают сократительный механизм.
Совокупность описанных процессов составляет молекулярные основы теории скольжения нитей.
Особенности энергообеспечения мышечного сокращения.
Скелетная мышца превращает химическую энергию в механическую работу с весьма высокой эффективностью – в виде тепла теряется всего лишь 30-50% (для сравнения: тепловые потери при работе автомобильного двигателя составляют обычно 80-90% всей энергии, выделяющейся при сжигании бензина).
Н
 еобходимую
для мышечного сокращения энергию
поставляет гидролиз АТР, однако содержание
АТР в покоящейся и в активно работающей
мышце на первых этапах различается
мало, так как в мышечных клетках работает
чрезвычайно эффективная система
регенерации АТР.
еобходимую
для мышечного сокращения энергию
поставляет гидролиз АТР, однако содержание
АТР в покоящейся и в активно работающей
мышце на первых этапах различается
мало, так как в мышечных клетках работает
чрезвычайно эффективная система
регенерации АТР.
Фермент креатинфосфокиназа катализирует реакцию между креатинфосфатом и ADP, в результате которой образуются АТР и креатин. (Креатинфосфат – вещество с еще большей энергией, чем АТР). После кратковременной вспышки мышечной активности падает внутриклеточный уровень именно креатинфосфата, хотя сам сократительный механизм использует АТР. Таким образом, креатинфосфат играет роль аккумулятора – он запасает энергию, «заряжаясь» за счет новых молекул АТР (синтезируемых при клеточных процессах окисления), когда мышца находится в покое. В течение периода покоя концентрация креатинфосфата в мышечном волокне возрастает до уровня, примерно в пять раз превышающего содержание АТФ. Хотя АТФ образуется за счет креатинфосфата очень быстро посредством единственной ферментативной реакции, его количество лимитируется исходной концентрацией креатинфосфата в клетке. Чтобы мышечное сокращение могло продолжаться дольше 1-2 минут, необходимо участие двух других источников образования АТФ. После начальных секунд/минут сократительной активности, обеспечиваемых за счет использования креатинфосфата, подключаются более медленные, требующие участия многих ферментов пути окислительного фосфорилирования и гликолиза.
У позвоночных есть три основных типа мышц
До сих пор мы рассматривали лишь один из трех главных типов мышц, имеющихся у позвоночных, а именно скелетные мышцы. Два других – это сердечная мышца, которая за среднее время жизни человека успевает совершить около трех миллиардов циклов сокращения и расслабления, и гладкая мускулатура, обеспечивающая более медленное и продолжительное сокращение, характерное для таких органов, как кишечник. Во всех трех типах мышечных клеток, работает механизм скользящих нитей.
Сердечная мышца, подобно скелетным, выглядит исчерченной (поперечнополосатой). Это отражает весьма сходную организацию актиновых и миозиновых филаментов. Молекулярный механизм сокращения так же аналогичен. Однако клетки сердечной мышцы не являются многоядерными и соединены между собой конец в конец специальными вставочными дисками. Вставочные диски выполняют по крайней мере три функции:
1) соединяют при помощи десмосом (особый тип плотных межклеточных контактов) каждую клетку со следующей;
2) они связывают тонкие филаменты, входящие в состав миофибрилл соседних клеток, играя роль, аналогичную роли Z-дисков внутри мышечного волокна;
3) в них находятся щелевые контакты через которые потенциал действия быстро распространяется от клетки к клетке, синхронизируя их сокращение.
Структура сердечной мышцы.
 Сердечная
мышца состоит из множества отдельных
клеток, каждая со своим ядром. Эти клетки
соединены между собой с помощью
специальных контактов, называемых
вставочными дисками. В зоне каждого
вставочного диска актиновые филаменты
саркомеров соседних клеток входят в
плотное вещество, связанное с плазматической
мембраной, как если бы это был Z-диск.
Таким образом, миофибриллы тянутся в
мышце, игнорируя границы клеток.
Сердечная
мышца состоит из множества отдельных
клеток, каждая со своим ядром. Эти клетки
соединены между собой с помощью
специальных контактов, называемых
вставочными дисками. В зоне каждого
вставочного диска актиновые филаменты
саркомеров соседних клеток входят в
плотное вещество, связанное с плазматической
мембраной, как если бы это был Z-диск.
Таким образом, миофибриллы тянутся в
мышце, игнорируя границы клеток.
Гладкомышечная ткань состоит из слоев удлиненных веретенообразных клеток, в каждой из которых одно ядро. В клетках есть и толстые, и тонкие филаменты, но они не организованы в столь упорядоченные структуры, как в скелетной мускулатуре и в сердце. В частности, они не образуют отдельных миофибрилл, хотя в основном они вытянуты вдоль длинной оси клетки, соприкасаясь под косым углом с плазматической мембраной в дисковидных контактах, соединяющих группы клеток вместе.
В
 механизме сокращения гладкой мышцы
имеется особенность, отличающая его от
механизма сокращения поперечнополосатых
мышц. Эта особенность заключается в
том, что прежде чем миозин гладкой мышцы
сможет проявлять свою АТФазную активность,
он должен быть фосфорилирован.
механизме сокращения гладкой мышцы
имеется особенность, отличающая его от
механизма сокращения поперечнополосатых
мышц. Эта особенность заключается в
том, что прежде чем миозин гладкой мышцы
сможет проявлять свою АТФазную активность,
он должен быть фосфорилирован.
Механизм фосфорилирования миозина гладкой мышцы осуществляется следующим образом:
- ион Са2+ соединяется с кальмодулином (кальмодулин — рецептивный белок для иона Са2+);
- возникающий комплекс активирует фермент – киназу легкой цепи миозина;
- киназа легкой цепи в свою очередь катализирует процесс фосфорилирования миозина.
Затем происходит скольжение актина по отношению к миозину, составляющее основу сокращения. Отметим, что пусковым моментом для сокращения гладкой мышцы является присоединение иона Са2+ к кальмодулину, в то время как в скелетной и сердечной мышце пусковым моментом является присоединение Са2+ к тропонину.
Фосфорилирование происходит сравнительно медленно, так что максимальное сокращение развивается нередко за время порядка секунды (в поперечнополосатых мышцах – за несколько миллисекунд).
Миозин этих клеток гидролизует АТР примерно в 10 раз медленнее, чем миозин скелетных мышц, что отражается, естественно, на скорости «шагания» его по актиновым филаментам и быстроте сокращения в целом. Однако не следует рассматривать гладкомышечные клетки как «плохой», медленно работающий вариант клеток скелетных мышц, пригодный на что-то только потому, что к этим клеткам предъявляется меньше требований. Для гладкомышечных клеток быстрая активация сокращения не нужна. Они специально приспособлены для медленного продолжительного сокращения и могут поддерживать напряжение длительное время (способны к тетанусу), гидролизуя при этом в 5-10 раз меньше АТР, чем требовалось бы для выполнения такой же задачи клеткам скелетных мышц.
Сокращение гладкой мышцы активируется в присутствии Са2+ с помощью киназы легких цепей миозина, фосфорилирующей определенный участок одного из двух типов легких цепей в миозине.
Регуляция немышечного миозина осуществляется таким же образом
В немышечных клетках могут временно создаваться сократимые комплексы мышечного типа
Хотя миозин, как и актин есть практически во всех эукариотических клетках, стабильные толстые филаменты он образует только в мышцах. Немышечный миозин легко растворим. По данным электронной микроскопии, каждый миозиновый хвост складывается с самим собой, цепляясь за «липкий участок» на головке. В этой свернутой конформации миозиновые молекулы не способны эффективно образовывать филаменты. Однако в зависимости от обстоятельств, молекулы немышечного миозина могут собираться в некрупные комплексы. Размеры и местоположение этих сократительных систем определяются внутриклеточными сигналами. Важным фактором, регулирующим степень агрегации немышечного миозина, служит механизм его фосфорилирования, сходный с гладкой мышечной тканью.
К
 огда
киназа легких цепей, активизированная
кальмодулином•Са2+,
фосфорилирует головки миозина, они
теряют «липкость», хвосты освобождаются,
распрямляются и могут ассоциировать
друг с другом, образуя биполярные
миозиновые филаменты.
огда
киназа легких цепей, активизированная
кальмодулином•Са2+,
фосфорилирует головки миозина, они
теряют «липкость», хвосты освобождаются,
распрямляются и могут ассоциировать
друг с другом, образуя биполярные
миозиновые филаменты.
Сборка филаментов немышечного миозина контролируется фосфорилированием его легких цепей. Фосфорилирование вызывает два эффекта: оно изменяет конформацию миозиновой головки таким образом, что на ней обнажается актин-связывающий участок, и высвобождает миозиновый хвост из «липкого кармана» на миозиновой головке, тем самым позволяя молекулам миозина объединяться в короткие биполярные филаменты. Точно так же ведет себя гладкомышечный миозин.
Для немышечных
клеток контроль над сборкой и разборкой
миозиновых комплексов имеет особое
значение, так как в них сократительные
структуры из актиновых филаментов и
миозина нередко образуются лишь для
выполнения какой-нибудь специальной
функции, после чего снова разбираются.
В частности, при цитокинезе под мембраной
появляется так называемое сократимое
кольцо –
поясок из актиновых филаментов и миозина.
Именно за счет его сокращения посередине
клетки образуется перетяжк
 а,
что ведет затем к разъединению двух
дочерних клеток.
а,
что ведет затем к разъединению двух
дочерних клеток.
П
 оскольку
сократительное кольцо не является
постоянной клеточной структурой, оно
должно формироваться в начале деления.
Например, в готовых к делению яйцах
морского ежа молекулы миозина вначале
равномерно распределены под плазматической
мембраной, а затем, по мере образования
сократительного кольца, мигрируют в
экваториальную область; распределение
их снова становится дисперсным, когда
деление клетки завершилось.
оскольку
сократительное кольцо не является
постоянной клеточной структурой, оно
должно формироваться в начале деления.
Например, в готовых к делению яйцах
морского ежа молекулы миозина вначале
равномерно распределены под плазматической
мембраной, а затем, по мере образования
сократительного кольца, мигрируют в
экваториальную область; распределение
их снова становится дисперсным, когда
деление клетки завершилось.
Некоторые сократительные структуры на основе актиновых филаментов оказываются более долгоживущими. Таковы, например, актиновые филаменты кортекса или кольцевые пучки актиновых филаментов в опоясывающих десмосомах, расположенных вблизи апикальной поверхности клеток эпителия. Среди прочих функций, эти пучки, видимо, играют важную роль в изгибании эпителиальных пластов в эмбриогенезе.
Белки – ферменты (энзимы).
Из курса химии вам известно, что катализаторы – это вещества ускоряющие протекание химических реакции, но сами в итоге этих реакций не изменяющиеся.
Ферменты (от лат. fermentum – закваска) или энзимы – специфические биологические катализаторы (вещества, увеличивающие скорость биохимической реакции) которые присутствуют во всех живых клетках.
Скорость реакции при этом может возрастать более чем в 106 раз по сравнению со скоростью той же реакции в отсутствие фермента. Обмен веществ организма – совокупность биохимических реакций, катализирующихся соответствующими ферментами. Направляя и регулируя обмен веществ, ферменты играют важнейшую роль во всех процессах жизнедеятельности.
До недавнего времени крылатая фраза биохимиков «Все ферменты – белки, но не все белки ферменты» поражала своей отточенной филигранностью. Однако, как обычно в естественных науках, ее категоричность оказалась неуместна: в 1982 году была открыта каталитическая активность молекул РНК (Чак и др.). Именно РНК является катализатором реакции пептизации в рибосомах. Кроме того, показана способность РНК к автокатализу при самосплайсинге. Однако можно с уверенностью утверждать, что более 99% биологических катализаторов – белки. Обычно именно их называют ферментами или энзимами (синонимы), а катализаторы РНК-овой природы – рибозимами.
История изучения ферментов.
В 1814 химик К. Г. С. Кирхгоф (Россия) открыл каталитическое действие водных вытяжек из проросшего ячменя, расщеплявших крахмал до сахара. Можно считать, что эти работы положили начало энзимологии (ферментологии) как самостоятельному разделу биологической химии.
В 1833 химиками А. Пайеном и Ж. Персо (Франция) впервые был выделен из солода препарат фермента амилазы, что способствовало развитию препаративной химии ферментов.
В середине 19 века разгорелась дискуссия о природе брожения между Л. Пастером, с одной стороны, и Ю. Либихом, П. Э. М. Бертло и К. Бернаром – с другой. Пастер развивал представление о том, что брожение вызывается лишь живыми микроорганизмами и неразрывно связан с их жизнедеятельностью. Либих и его сторонники, отстаивая химическую природу брожения, считали, что оно является следствием образования в клетках микроорганизмов растворимых ферментов, подобных выделяемой из солода амилазе. Однако все попытки выделить из разрушенных дрожжевых клеток растворимый фермент, способный вызвать брожение, долгое время не удавались. В 1897 дискуссия Либиха и Пастера о природе брожения была разрешена Э. Бухнером, который, выделил из дрожжей бесклеточный растворимый ферментный препарат (названный им зимазой), вызывавший спиртовое брожение. Открытие Бухнера утвердило биохимическое понимание природы брожения и имело большое значение для дальнейшего развития как энзимологии, так и всей биохимии.
В начале 20 века Р. Вильштеттер с сотрудниками стал широко применять для выделения и очистки ферментов метод адсорбции (впервые предложен А. Я. Данилевским для разделения ферментов поджелудочной железы). Работы Вильштеттера, имевшие большое значение для характеристики свойств отдельных ферментов, привели вместе с тем к принципиально неправильному выводу, что ферменты не принадлежат ни к одному из известных классов органических соединений.
Выдающимся успехом в выяснении химической природы ферментов были исследования американских биохимиков Дж. Самнера, выделившего в 1926 в кристаллическом виде уреазу, и Дж. Нортропа, получившего в 1930 кристаллы пепсина. Работы Самнера и Нортропа указали путь получения высокоочищенных кристаллических препаратов ферментов и вместе с тем неопровержимо доказали их белковую природу.
В середине 20 века, благодаря развитию методов физико-химического анализа (главным образом хроматографии) расшифрована первичная структура многих ферментов. Так показано, что рибонуклеаза из поджелудочной железы быка состоит из 124 аминокислотных остатков, соединённых в 4 местах дисульфидными связями.
С помощью рентгеноструктурного анализа расшифрована вторичная и третичная структура ряда ферментов (в 1965 Д. Филлипс (Англия) установил трёхмерную структуру лизоцима). Многие ферменты обладают также четвертичной структурой, т. е. их молекула состоит из нескольких идентичных или различных по составу и структуре белковых субъединиц.
Общие принципы работы ферментов.
Субстрат (S) – это молекула(-ы), которая(-ые) после взаимодействия с ферментом (Е) превращается(-ются) в продукт(-ы) (Р).
Активный центр и специфичность ферментов.
Активный центр фермента = субстратный + каталитический центры.
В непосредственный контакт с субстратом вступают определенные участки белковой молекулы. Участок связывания с субстратом называют субстратным центром, а участок, обеспечивающий катализ – каталитическим центром фермента. Обычно они оказываются в единой пространственной области и именуются активным центром.
Активный центр фермента – участок молекулы белка, где может связываться субстрат (или субстраты) с образованием фермент-субстратного комплекса (E-S).
Активный центр часто построен всего лишь из нескольких радикалов аминокислотных остатков. Хотя эти остатки пространственно сближены в третичной структуре, в линейной белковой молекуле они часто далеко отстоят друг от друга. Как правило, формирование Е-S-комплекса происходит без образования ковалентных связей, а осуществляется за счет более слабых, но и более специфических типов взаимодействий, таких как водородные связи, солевые мостики, гидрофобные силы и т.д. Однако известны исключения, когда между ферментом и субстратом формируется ковалентная связь, например при образовании промежуточного продукта в ходе функционирования ферментов, принадлежащих семейству сериновых протеиназ.
Все ферменты разделяются на две большие группы: однокомпонентные (простые), состоящие исключительно из белка, и двухкомпонентные (сложные), состоящие из белка, называемого апоферментом, и небелковой части, называемой простетической группой. Каталитический центр простых (однокомпонентных) ферментов образован уникальным пространственным сочетанием радикалов аминокислотных остатков, а в сложных (двухкомпонентных) ферментах каталитическую функцию обычно исполняет простетическая группа.
Простетические группы многих ферментов представляют собой производные витаминов или нуклеотидов. Так у пируватдекарбоксилазы, катализирующей расщепление пировиноградной кислоты на двуокись углерода и уксусный альдегид (CH3COCOOH → CH3CHO + CO2), простетическая группа образована молекулой витамина B1 (тиамина) и двумя остатками фосфорной кислоты.
Многие ферменты содержат металлы, без которых фермент не активен. Эти металлы называются кофакторами. Так, пероксидаза и каталаза содержат железо, аскорбинатоксидаза, катализирующая окисление аскорбиновой кислоты, – медь, алкогольдегидрогеназа, окисляющая спирты в соответствующие альдегиды, – цинк.
Каталаза катализирует реакцию разложения перекиси водорода на воду и кислород. Каталитическое действие этого фермента может быть воспроизведено с помощью ионов трёхвалентного железа. Эти ионы обладают, однако, очень малой каталитической активностью, которая может быть усилена, если железо входит в состав гема. Хотя гем обладает уже значительным каталазным действием, его каталитическая активность всё же в несколько миллионов раз меньше активности каталазы, в которой гем в качестве простетической группы этого фермента связан со специфическим белком. Таким образом:
Соединение простетической группы с белком приводит к резкому возрастанию её каталитической активности.
От природы белка зависит не только каталитическая активность, но и специфичность действия фермента, поскольку он формирует субстратный центр.
Прочность связи простетической группы и апофермента различна у разных ферментов. У некоторых ферментов эта связь является непрочной. Такие ферменты легко распадаются на простетическую группу и апофермент. Простетические группы, легко отделяющиеся от белковой части фермента, называются коферментами.
Специфичность действия ферментов.
Действие фермента, в отличие от неорганических катализаторов, строго специфично. Под специфичностью фермента понимают его способность отличать свой «истинный» субстрат от других молекул. Такая избирательность обусловлена высокой специфичностью фермент-субстратных взаимодействий. Специфичность узнавания у разных ферментов может варьировать – некоторые ферменты катализируют реакцию с участием только одного субстрата, тогда как другие – с несколькими химически родственными веществами. Ранняя модель фермент-субстратных взаимодействий, называемая моделью «замка и ключа», была предложена в 90-х годах XIX в. Фишером: к субстрату (замку) подходит лишь свой фермент (ключ). В настоящий момент она дополнена идеей «индуцированного соответствия».
Гипотеза
«индуцированного соответствия»
(иногда именуемая моделью
«перчатка – рука»)
для
объяснения специфичности ферментов
была высказана Кошландом в 1959г. Согласно
этой ныне общепринятой гипотезе,
связывание ферментом «правильного»
субстрата индуцирует в белке-ферменте
конформационные изменения. В результате
этих изменений каталитические группы
фермента ориентируются таким образом,
что становится возможным превращение
субстрата в продукт. Иными словами,
каталитический центр может формироваться
после связыв
 ания
субстрата с субстратным центром фермента.
ания
субстрата с субстратным центром фермента.
Дальнейшее развитие модели индуцированного соответствия связано с учетом того, что конформация субстрата при связывании с ферментом также может изменяться. В этом случае говорят о напряжении в молекуле субстрата. Таким образом, субстрат – это больше, чем просто «замок». «Перчатка» и «рука» взаимно «подгоняются» друг под друга (меняют конкормацию) в момент взаимодействия.
Гипотеза о существовании конформационных изменений в ферменте и субстрате при их связывании друг с другом объяснила тот факт, что молекулы, очень похожие по форме на субстрат, могут связываться с ферментом, но не превращаются в продукт, т. е. действуют как ингибиторы.
Ингибиторами называются молекулы, которые, связываясь с ферментом, блокируют какую-то стадию ферментативной реакции. Ингибиторы бывают необратимыми и обратимыми.
Необратимый ингибитор разрушает или модифицирует молекулы фермента, в результате чего они полностью или частично теряют свою активность.
Обратимое ингибирование подразделяется на конкурентное, неконкурентное и бесконкурентное.
Конкурентный ингибитор – это молекула, настолько похожая по своей структуре на молекулу субстрата, что фермент не может различить их. В результате связывания конкурентного ингибитора с субстратным центром фермента падает концентрация истинных Е-S-комплексов и, следовательно, уменьшается скорость реакции. Ингибитор в продукт не превращается.
Неконкурентный ингибитор – это молекула, связывающаяся не с субстратным центром, а с каким-то другим участком фермента, изменяя его конформацию. Поскольку связывание с неконкурентным ингибитором не мешает ферменту образовывать Е-S-комплекс, этот ингибитор не понижает концентрацию таких комплексов, а влияет на эффективность превращения S в Р.
Бесконкурентный ингибитор – это молекула, которая связывается только с фермент-субстратным комплексом и не может связаться со свободным ферментом. В односубстратных ферментных системах этот тип ингибирования редок.
Стадии и принципы ферментативного катализа.
Как всякие катализаторы, ферменты снижают энергию активации, необходимую для осуществления той или иной химической реакции, направляя её обходным путём – через промежуточные реакции, которые требуют значительно меньшей энергии активации.
Переходное
состояние, или активированный комплекс,
– это высокоэнергетическая промежуточная
структура, которая образуется во время
реакции. Разность свободных энергий
исходных реагентов (т. е. субстратов) и
переходного состояния называется
свободной энергией активации. Скорость
реакции зависит от величины этой
свободной энергии: чем она меньше, тем
больше скорость р
 еакции,
и наоборот.
еакции,
и наоборот.
Фермент увеличивает скорость реакции следующими способами:
Понижая свободную энергию переходного состояния путем стабилизации активированного комплекса.
Увеличивая энергию субстрата, когда тот связывается с ферментом при образовании фермент-субстратного (Е-S) комплекса. В итоге уменьшается разность свободных энергий Е-S-комплекса и переходного состояния.
Поддерживая микроокружение активного центра в состоянии, отличном от такового в водной среде. Часто у боковых цепей аминокислотных остатков, находящихся в области активного центра, способность приобретать электрический заряд изменяется по сравнению с тем случаем, когда эти цепи целиком погружены в водную среду. В результате боковые цепи могут обладать «повышенной реактивностью».
Располагая атомы функциональных групп в правильной ориентации и на необходимом расстоянии, так чтобы обеспечить оптимальное протекание реакции. Столкновения атомов этих групп в отсутствие фермента далеко не всегда приводят к химической реакции, поскольку в этом случае очень редко атомы оказываются в правильной ориентации.
Так, реакция:
S → P1 + P2 (АБ → А + Б)
в присутствии E идёт следующим образом:
S + E → S-E (АБ + E → АБ-E)
и далее
S-E → P1-E + P2 (АБ-E → А-E + Б) и 3) P1-E → P1 + E (А-E → А + E).
Например, для осуществления реакции гидролиза дисахарида сахарозы (S), в результате которого образуются глюкоза (P1)и фруктоза (P2), без участия катализатора требуется 32 000 кал на моль сахарозы. Если же реакция катализируется сахаразой (E), то необходимая энергия активации составляет всего 9400 кал.
Подобное понижение энергии активации под влиянием фермента – следствие перераспределения электронных плотностей и некоторой деформации молекул субстрата, происходящей при образовании промежуточного соединения – фермент-субстратного комплекса (S-E). Эта деформация, ослабляя внутримолекулярные связи, приводит к понижению необходимой энергии активации и, следовательно, ускоряет течение реакции.
Модель Михаэлиса-Ментен.
Кинетические свойства многих ферментов (но не всех) можно объяснить в рамках модели Михаэлиса-Ментен. Согласно этой модели, субстрат S связывается с ферментом Е с константой скорости k1. Образующийся фермент-субстратный комплекс Е-S может либо диссоциировать на Е и S с константой скорости k2, либо с константой скорости k3 превратиться в продукт Р и свободный фермент:
![]()

В модели предполагается, что продукт не может обратно превращаться в субстрат, что справедливо для ранних стадий реакции, когда концентрация продукта низка. Скорость реакции v связана с концентрацией субстрата [S] следующим соотношением:
г![]()
![]() де
Vmax
– максимальная скорость реакции,
достигающаяся в том случае, когда все
молекулы фермента связаны с субстратом,
а
де
Vmax
– максимальная скорость реакции,
достигающаяся в том случае, когда все
молекулы фермента связаны с субстратом,
а
Км, константа Михаэлиса, численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной величины. Км – это мера сродства данного субстрата к ферменту, которое, в свою очередь, отражает прочность связывания субстрата с активным центром.
График зависимости v от [S] представляет собой гиперболу.
Молекулярные механизмы работы ферментов на примере лизоцима.
Лизоцим – это фермент, способный, расщепляя полисахаридные цепи муреина, разрушать бактериальны клеточной стенки. Лишенная жесткой клеточной стенки, бактерия разрывается под действием осмотического шока (высокого тургорного давления), вызываемого быстрым проникновением воды внутрь клетки. Муреин представляет собой полимер, в котором чередуются остатки сахаров двух типов – N-ацетилглюкозамина (NAG) и N-ацетилмурамовой кислоты (NAM).
Сахара, имеющие ß-конфигурацию относительно асимметричного С1- атома, образуют полимерную цепь с помощью ß-гликозидных связей между С1 -атомом одного сахарного кольца и С4-атомом следующего (ß-1→4).
Структура лизоцима. Лизоцим из белка куриного яйца состоит из одной полипептидной цепи, насчитывающей 129 остатков и имеющей четыре дисульфидных мостика. Фермент может связываться с ингибиторами, химически сходными с полисахаридом клеточной стенки. С помощью рентгеноструктурного анализа Филлипсом и др. была определена пространственная структура белка как такового и белка, закристаллизованного вместе с ингибитором. Оказалось, что лизоцим состоит из двух доменов, образующих щель, в которой находится активный центр, способный связать гексосахарид, причем для связывания каждого из шести сахарных колец на ферменте имеется свой участок (эти участки обозначаются буквами А, В, С, D, Е и F).
Р
 асщепление
полисахарида
осуществляется
путем гидролиза гликозидной связи между
сахарными кольцами, располагающимися
в участках D
и Е.
асщепление
полисахарида
осуществляется
путем гидролиза гликозидной связи между
сахарными кольцами, располагающимися
в участках D
и Е.
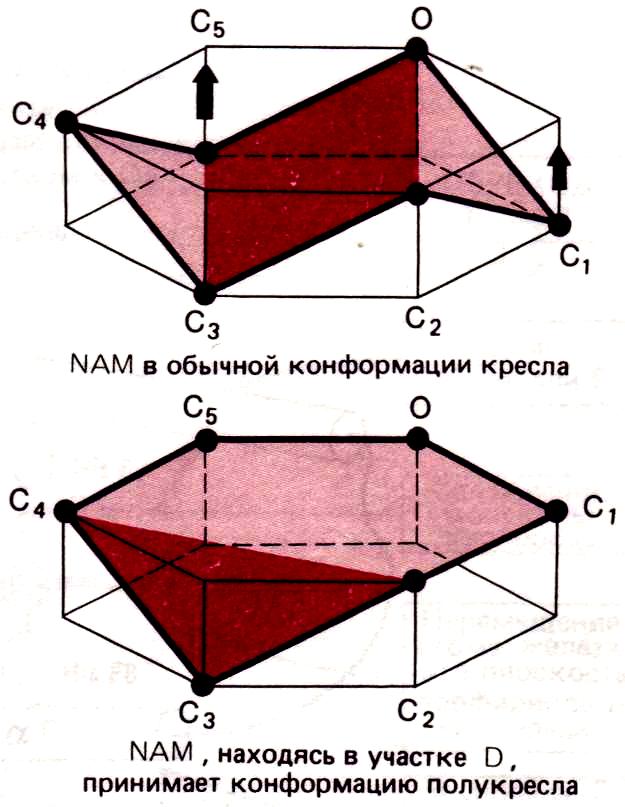
Анализ кристаллографических данных позволил предположить, что непосредственно перед и во время гидролиза сахарное кольцо в участке D имеет не обычную конформацию кресла, а конформацию полукресла, характеризующуюся тем, что в ней пять из шести атомов, образующих сахарное кольцо, лежат практически в одной плоскости – напряженное состояние субстрата (рис. внизу слева).
С
 труктура
молекулы
труктура
молекулы
лизоцима в области активного центра (справа).
К
 оричневым
цветом изображен связанный в активном
центре субстрат (NAG-NAM)3.
Основная цепь белка отмечена точками,
при этом NH-
и СО-группы соответственно заштрихованы
и полностью закрашены. Водородные связи
изображены пунктирными прямыми. Обратите
внимание на близость колец двух
триптофановых остатков Тrр
62 и Тrр
63 к сахарам, располагающимся в участках
А и В. Благодаря вандерваальсовым
контактам и образованию водородных
связей с этими остатками осуществляется
дополнительная фиксация субстрата в
субстратном центре.
оричневым
цветом изображен связанный в активном
центре субстрат (NAG-NAM)3.
Основная цепь белка отмечена точками,
при этом NH-
и СО-группы соответственно заштрихованы
и полностью закрашены. Водородные связи
изображены пунктирными прямыми. Обратите
внимание на близость колец двух
триптофановых остатков Тrр
62 и Тrр
63 к сахарам, располагающимся в участках
А и В. Благодаря вандерваальсовым
контактам и образованию водородных
связей с этими остатками осуществляется
дополнительная фиксация субстрата в
субстратном центре.
Центральную роль в функционировании лизоцима играют остатки глутаминовой кислоты 35 и аспарагиновой кислоты 52. Боковые цепи этих остатков располагаются близко к гликозидной связи (примерно на расстоянии 0,3 нм) между сахарными кольцами, локализованными в участках D и Е. Glu35 находится в неполярном окружении, и поэтому его карбоксильная группа остается протонированной (т. е. находится в форме –СООН). Окружение Asp52, наоборот, полярно, поэтому карбоксильная группа этого остатка депротонирована (т. е. находится в форме –СОО–).
Реакцию гидролиза можно подразделить на несколько этапов.
1. –СООН-группа остатка Glu 35 предоставляет свой протон гликозидному кислороду, что приводит к разрыву связи между этим атомом кислорода и С1-атомом сахарного кольца, располагающегося в участке D. Получившийся в результате фрагмент исходного полисахарида, включающей в себя сахарные кольца, которые находятся в участках Е и F, является продуктом и может освободиться из комплекса с ферментом.
Сахарное кольцо, располагающееся в D-участке, имеет искаженную конформацию, соответствующую конформации переходного состояния. При этом С1-атом оказывается положительно заряженным. Углеродный атом в таком состоянии называется карбоний-ионом (С+). Он стабилизируется с помощью отрицательного заряда близко расположенного остатка Asp 52.
Гидроксильный ион (ОН–), донором которого служит молекула воды из окружающей среды, присоединяется к (C+) – карбоний-иону, после чего второй фрагмент расщепленного полисахарида становится продуктом реакции. Одновременно из-за связывания иона водорода (Н+) протонируется карбоксильная группа Glu 35, переходя в форму –СООН.
Теперь фермент находится в первоначальном состоянии и готов к следующей реакции расщепления полисахарида.
Этот пример позволяет проследить некоторые общие принципы ферментативного катализа
1. Увеличение энергии субстрата за счет искажения структуры сахарного кольца NAM, находящегося в участке D.
2. Наличие необычного окружения Glu 35, обусловливающее появление реакционноспособного протона.
3. Правильная ориентация протона в Glu 35, необходимая для атаки гликозидной связи.
4. Уменьшение свободной энергии переходного состояния за счет стабилизации (С+)-иона карбоксильной группой остатка Asp52.
Регуляция ферментативных процессов.
На уровне биосинтеза белка-фермента
Индуцируемые и конститутивные ферменты.
Конститутивные ферменты – постоянно присутствующие в клетке.
Индуцируемые ферменты – те, которые клетка начинает синтезировать лишь в определенных условиях.
Например, кишечная палочка при росте на питательной среде, содержащей глюкозу, практически не содержит ферментов, позволяющих использовать лактозу (молочный сахар). В присутствии же лактозы и недостатке глюкозы эти ферменты образуются в значительных количествах – до 6-7% от всех содержащихся в клетке белков. Новообразование или усиление синтеза белков под влиянием каких-либо факторов, называются индукцией. Возможен и обратный процесс – подавление синтеза белка определенными факторами, называемое репрессией.
В животном организме индукция и репрессия синтеза ферментов осуществляется не только под влиянием соответствующих субстратов и метаболитов, но и под влиянием гормонов. Так, синтез глюкозо-6-фосфатазы, принимающей участие в синтезе глюкозы в печени, индуцируется гормонами тироксином и кортизоном, но репрессируется инсулином (см. 9 класс, тема «Эндокринная система»). Общая теория индукции и репрессии биосинтеза на генетическом уровне дана французскими учёными Ф. Жакобом и Ж. Моно. Мы познакомимся с механизмами регуляции генной экспрессии позже, в соответствующей теме.
Изозимы (изоферменты)
В одном организме один и тот же фермент может быть представлен различными молекулярными формами, отличающимися сродством к субстрату. Это характерно для ферментов–мультимеров. Такие разнообразные формы фермента, катализирующие одну и ту же реакцию, но различающиеся между собой, называются изозимами (изоферментами). Так лактатдегидрогеназа (ЛДГ) – тетрамер. В организме млекопитающих имеются два различных типа субъединиц ЛДГ (H и M), незначительно различающиеся по аминокислотной последовательности; они могут ассоциировать в тетрамер случайным образом. Поэтому известно 5 различных изоферментов ЛДГ (НННН, НННМ, ННММ, НМММ, ММММ). В мышце сердца содержатся преимущественно тетрамеры, состоящие из Н-субъединиц (H от англ. heart), в ЛДГ печени и скелетных мышц преобладают М-мономеры.
Синтез изоферментов определяется генетическими факторами, но может изменяться под влиянием условий существования.
На уровне созревания белка-фермента
Зимогены – это неактивные предшественники ферментов.
Чтобы зимоген превратился в активный фермент, какая-то часть (или части) его полипептидной цепи должна быть отщеплена. Например, химотрипсиноген и трипсиноген являются зимогенами соответственно химотрипсина и трипсина.
Ковалентной модификацией называется ковалентное присоединение или отщепление от фермента небольшой химической группы, регулирующее его активность. С помощью таких модификаций обычно либо полностью неактивная форма фермента становится активной, либо, наоборот, полностью активный фермент инактивируется. Например, гликогенсинтетаза из клеток млекопитающих, превращающая глюкозу в гликоген, инактивируется после ковалентного присоединения фосфатной группы к боковой цепи одного из сериновых остатков и снова активируется при отщеплении фосфата.
На уровне регуляции активности фермента
Регуляция активности уже имеющегося фермента может осуществляться самыми разными путями, например с помощью ингибирования по типу отрицательной обратной связи, за счет кооперативных или аллостерических эффектов.
Ингибирование по типу отрицательной обратной связи характерно для ферментных систем, в которых субстрат претерпевает несколько последовательных превращений, причем каждая реакция катализируется своим ферментом.
И

 нгибирование
имеет место, если конечный продукт Т
блокирует одну из более ранних стадий
в цепи реакций, а для этого продукт Т
должен быть либо структурно похожим на
Р (т. е. действовать как конкурентный
ингибитор), либо связываться с какой-либо
другой частью фермента, регулируя таким
образом его активность (т. е. выступать
в роли неконкурентного ингибитора).
нгибирование
имеет место, если конечный продукт Т
блокирует одну из более ранних стадий
в цепи реакций, а для этого продукт Т
должен быть либо структурно похожим на
Р (т. е. действовать как конкурентный
ингибитор), либо связываться с какой-либо
другой частью фермента, регулируя таким
образом его активность (т. е. выступать
в роли неконкурентного ингибитора).
Кооперативные эффекты характерны для белков–мультимеров, в том числе и для ферментов. Если имеет место кооперативный эффект, то кинетические свойства фермента уже не описываются уравнением Михаэлиса-Ментен: график зависимости v от [S] в этом случае представляет собой S-образную кривую, а не гиперболу (справа). При этом небольшое увеличение концентрации субстрата будет приводить к значительному возрастанию скорости реакции. Для объяснения этого эффекта были предложены различные модели, из которых наиболее известны модели Моно, Уаймена и Шанжё (симметричная модель), а также Кошланда, Немети и Филмера (последовательная модель).
В симметричной модели предполагается, что каждый мультимерный ферментный комплекс может существовать по крайней мере в двух разных состояниях с неодинаковой четвертичной структурой, причем в каждом состоянии все субъединицы имеют одинаковую третичную структуру. В простейшей модели рассматриваются два состояния, находящиеся в равновесии друг с другом. В одном из них белок имеет высокое сродство к субстрату (R-состояние, от англ. relax - ослаблять), а в другом - низкое (Т-состояние, от англ. tense - напрягать). Добавленный субстрат будет предпочтительно связываться с R-конформерами фермента, а связывание его с Т-конформером приведет к возникновению напряжения в субъединицах фермента, что вызовет одновременный переход всех субъединиц в R-состояние (в котором напряжение отсутствует). При таком согласованном переходе сохраняется молекулярная симметрия каждой мультимерной молекулы. При дальнейшем добавлении субстрата все больше и больше молекул будет переходит из Т- в Rсостояние. Такой сдвиг равновесия в присутствии субстрата представляет собой эффект положительной кооперативности. В результате этого эффекта график зависимости v от [S] будет иметь S-образную форму.
В
 последовательной модели
предполагается что, отдельные субъединицы
мультимерной молекулы могут в одно и в
то же время иметь разные третичные
структуры. При этом связывание субстрата
одной субъединицей может вызывать
изменение третичной структуры соседней
субъединицы и в результате увеличивать
(положительная кооперативность) или
уменьшать (отрицательная кооперативность)
их сродство к субстрату.
последовательной модели
предполагается что, отдельные субъединицы
мультимерной молекулы могут в одно и в
то же время иметь разные третичные
структуры. При этом связывание субстрата
одной субъединицей может вызывать
изменение третичной структуры соседней
субъединицы и в результате увеличивать
(положительная кооперативность) или
уменьшать (отрицательная кооперативность)
их сродство к субстрату.
Аллостерическая регуляция (от греч. аллос – другой и стереос – тело, пространство) представляет собой эффект, наблюдаемый в тех случаях, когда небольшие молекулы (эффекторы), связываясь с ферментом не в области активного центра (с «аллостерическим центром»), изменяют скорость реакции. Подобная регуляция может быть гомотропной, когда молекула субстрата, взаимодействуя с ферментом, изменяет его сродство к молекулам того же субстрата, и гетеротропной, когда сродство к субстрату изменяется при взаимодействии фермента с молекулой, не похожей на молекулы субстрата. Гомотропные и гетеротропные регуляторы могут быть активаторами или ингибиторами. Аллостерический активатор, действующий на фермент, описываемый симметричной моделью, будет связываться предпочтительно с R-конформером, стабилизируя это состояние. В результате активатор будет увеличивать начальную концентрацию R-конформеров по сравнению с концентрацией Т-конформеров и, следовательно, увеличивать сродство фермента к своему субстрату (положительная кооперативность). Аллостерический ингибитор, наоборот, предпочтительно связывает и стабилизирует фермент, находящийся в Т-состоянии, вызывая уменьшение сродства фермента к субстрату (отрицательная кооперативность).
Действие ферментов зависит от температуры, реакции среды (pH) и других факторов.
Оптимальная температура, при которой активность ферментов наиболее высока, находится обычно в пределах 40–50 °С. При более низких температурах скорость ферментативной реакции, как правило, снижается, а при температурах, близких к 0° С, реакция практически полностью прекращается. При повышении температуры выше оптимальной скорость ферментативной реакции также снижается и, наконец, полностью прекращается. Снижение интенсивности действия ферментов при повышении температуры сверх оптимальной объясняется главным образом начинающейся денатурацией белка. В сухом состоянии белки денатурируются значительно медленнее, чем в виде белкового геля или раствора. Поэтому сухие споры бактерий или сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажнённом состоянии.
Отдельные ферменты различаются по оптимальной для их действия величине pH. Так, например, пепсин, содержащийся в желудочном соке, наиболее активен в сильнокислой среде (pH = 1-2); трипсин, выделяемый поджелудочной железой, имеет оптимум действия в слабощелочной среде (pH = 8-9); оптимум действия папаина – растительного протеолитического фермента – находится в слабокислой среде (pH = 5-6).
Примером влияния условий существования организма на активность ферментов может служить эффект Пастера – прекращение брожения под действием кислорода.
Классификация и номенклатура ферментов.
По рекомендации Международного биохимического союза шифр (индекс) каждого фермента содержит 4 числа, разделённых точками. Первая цифра указывает класс, вторая – подкласс, третья – подподкласс, четвёртая – порядковый номер в данном подподклассе. Ферменты разделяют на 6 классов
1) оксидоредуктазы – катализируют окислительно-восстановительные реакции, и разделяется на 14 подклассов в зависимости от природы той группы в молекуле субстрата, которая подвергается окислению (спиртовая, альдегидная, кетонная и т.д.). Подподклассы оксидоредуктаз индексируются в зависимости от типа участвующего в реакции акцептора водорода (электронов) – кофермента, цитохрома, молекулярного кислорода и т.д. Так, например, 1.2.3 обозначают оксидоредуктазу, действующую на альдегид с молекулярным кислородом в качестве акцептора электронов.
2) трансферазы – катализируют реакции переноса групп атомов, подразделяется на 8 подклассов в зависимости от природы переносимых групп, которыми могут быть одноуглеродные или гликозильные остатки, азотистые или содержащие серу группы и т.д. У трансфераз третья цифра характеризует тип переносимых групп.
3) гидролазы – катализируют гидролитическое расщепление различных соединений; разделяются на 9 подклассов в зависимости от типа гидролизуемой связи – сложноэфирной, пептидной, гликозидной и т.д. Третья цифра у гидролаз уточняет тип гидролизуемой связи.
4) лиазы – отщепляющие от субстрата ту или иную группу (негидролитически) с образованием двойной связи или, наоборот, присоединяющие группы к двойным связям. У лиаз 5 подклассов, вторая цифра шифра обозначает тип подвергающейся разрыву связи (углерод – углерод, углерод – кислород и т.д.), а третья – тип отщепляемой группы.
5) изомеразы – катализируют реакции изомеризации, разделяются на 5 подклассов в зависимости от типа катализируемой реакции; третья цифра шифра детализирует характер превращения субстрата.
6) лигазы – катализируют соединение двух молекул, сопряжённое с расщеплением пирофосфатной связи в молекуле АТФ или аналогичного трифосфата. Первая цифра шифра лигаз обозначает тип вновь образуемой связи (углерод – азот, углерод – кислород и т.д.), а вторая – природу образующегося соединения.
Классификация и номенклатура ферментов, кроме шифра, допускает также систематические и тривиальные (рабочие) названия. Так, например, систематическое название карбоксилаза 2-оксокислот соответствует уже упоминавшемуся тривиальному названию пируватдекарбоксилаза, а систематическое название L-apгинин – амидиногидролаза – рабочему название аргиназа.
Практическое значение ферментов.
Ферментативные процессы являются основой многих производств: хлебопечения, виноделия, пивоварения, сыроделия, производства, чая, уксуса и т.п. С начала 20 века по предложению японского учёного Д. Такамине в различных отраслях промышленности началось применение ферментных препаратов, получаемых из плесневых грибов или бактерий. В ряде стран этот способ широко используется для обработки амилазами крахмалистого сырья с целью получения кристаллической глюкозы или его сбраживания на спирт. Концентрированные амилолитические препараты ферментов из плесневых грибов при добавке в тесто приводят к улучшению качества хлеба и ускорению технологического процесса. Препараты протеолитических ферментов, получаемых из микроорганизмов, употребляются в кожевенной промышленности для удаления волос и смягчения сырья, а в сыродельной промышленности – для замены дефицитного сычужного фермента. Препараты микробных пектолитических ферментов широко используют при производстве соков (выход плодового сока повышается на 10–20%).
Всё большее применение очищенные ферментные препараты находят в медицине. В научных исследованиях и в клинической практике высокоочищенные ферментные препараты служат в качестве специфических средств биохимического анализа. Весьма перспективно применение т. н. иммобилизованных ферментов, которые связываются каким-либо носителем и образуют нерастворимый комплекс. При подборе соответствующего носителя можно получить иммобилизованный фермент с высокой активностью, устойчивый по отношению к денатурирующим агентам. Колонка, заполненная иммобилизованным ферментом, может быть многократно использована для проведения соответствующей реакции. Иммобилизованные ферменты находят всё более широкое применение в аналитической практике и биохимической технологии.
Транспортные белки.
Общий обзор.
К этой группе относятся:
а) мембранные белки – встроенные в наружные и внутренние мембраны клеток и обеспечивающие перенос через них разнообразных низко- и высокомолекулярных веществ,
- канальные белки,
- белки-насосы,
- белки, обеспечивающие облегченную диффузию
Повторите тему «трансмембранный транспорт» и приведите конкретные примеры.
б) белки биологических жидкостей – могут находиться как внутри клеток (в цитозоле, в матриксе митохондрий и т.д.), так и в межклеточном веществе (например – в плазме крови). Примеры:
- сывороточный альбумин – транспорт жирных кислот, разнообразных анионов и катионов; так он связывает до 50% кальция, находящегося в крови, служит переносчиком ионов меди из кишечника в печень, является носителем стероидных гормонов.
- церулоплазмин – переносит ионы меди из печени в клеточные органеллы;
- трансферрин – переносит ионы трехвалентного железа;
- ß-липопротеин - переносит липиды, жирорастворимые витамины и гормоны; та же функция свойственна другим липопротеинам сыворотки крови. Липопротеины очень низкой плотности у человека ежесуточно переносят 25-50г эндогенных триглицеридов, а другие их виды – холестерол, ß-каротин, фосфолипиды, углеводороды и ациклические спирты.
Широко известными транспортными белками биологических жидкостей являются дыхательные белки, переносящими кислород:
- гемоглобины позвоночных и ряда низших животных (красные),
- гемоцианины моллюсков, ракообразных, паукообразных и мечехвостов (голубые),
- гемэритрины малощетинковых кольчатых червей (коричневые),
- хлорокруорины многощетинковых кольчатых червей (зеленые),
- гемованадины оболочников (бесцветные белки, содержащие ванадий).
Остановимся подробнее на дыхательных белках человека, к которым относятся гемоглобины и миоглобин.
Глобины
Впервые кроветворение обнаруживается у 19-дневного эмбриона в кровяных островках желточного мешка, которые окружают со всех сторон развивающийся зародыш. Появляются начальные примитивные клетки – мегалобласты. Этот первый кратковременный период гемопоэза, преимущественно эритропоэза, носит название мезобластического, или внеэмбрионального, кроветворения.
Второй (печеночный) период начинается после 6 недели и достигает максимума к 5-му месяцу. Наиболее отчетливо выражен эритропоэз и значительно слабее – лейко- и тромбоцитопоэз. Мегалобласты постепенно замещаются эритробластами. На 3–4-м месяце эмбриональной жизни в гемопоэз включается селезенка. Наиболее активно как кроветворный орган она функционирует с 5-го по 7-й месяц развития. В ней осуществляется эритроцито-, гранулоцито- и мегакариоцитопоэз. Активный лимфоцитопоэз возникает в селезенке позднее – с конца 7-го месяца внутриутробного развития.
К моменту рождения ребенка прекращается кроветворение в печени, а селезенка утрачивает функцию образования клеток красного ряда, гранулоцитов, мегакариоцитов, сохраняя функцию образования лимфоцитов.
На 4-5-м месяце начинается третий (костномозговой) период кроветворения, который постепенно становится определяющим в продукции форменных элементов крови.
Таким образом, в период внутриутробной жизни плода выделяют 3 периода кроветворения. Однако различные его этапы не строго разграничены, а постепенно сменяют друг друга.
Соответственно различным периодам кроветворения (мезобластическому, печеночному и костномозговому) существует три разных типа гемоглобина: эмбриональный (НbE), фетальный (HbF) и гемоглобин взрослого (НbА). Эмбриональный гемоглобин (НbЕ) встречается лишь на самых ранних стадиях развития эмбриона. Уже на 8-10-й неделе беременности, содержание HbF у плода составляет 90-95%, и в этот же период начинает появляться НbА (5-10%). При рождении количество фетального гемоглобина варьирует от 45 до 90%. Постепенно HbF замещается НbА. К году остается 15% HbF, а к 3 годам количество его не должно превышать 2%. Типы гемоглобина отличаются между собой аминокислотным составом определенных участков нерегулярной структуры и сродством к кислороду (НbА < HbF < НbЕ).
Гемоглобин эмбриональный (HbE, гемоглобин E) . Гемоглобин E – белок-тетрамер. Выявлены подтипы эмбрионального гемоглобина Gower 1, Gower 2 и Portland 2. Все эти типы отличаются по строению полипептидных цепей как от более позднего фетального гемоглобина HbF, так и от взрослого типа гемоглобина HbA. В составе эмбрионального гемоглобина обнаружены цепи типов ζ и ε, не встречающиеся в составе других гемоглобинов. Gower 1 имеет состав ζ2ε2, Gower 2 – α2ε2, Portland 2 – ζ2β2.
Синтез эмбрионального гемоглобина начинается уже на 1 неделе жизни эмбриона. С 6-7 недели начинается замещение его фетальным гемоглобином HbF. Однако синтез гемоглобина HbE продолжается до конца беременности, хотя и в незначительных количествах.
Гемоглобин плода (фетальный гемоглобин HbF) отличается от гемоглобина взрослых тем, что в нем две ß-цепи заменены двумя γ-цепями. Гемоглобин плода связывает ДФГ (см. далее) менее сильно, чем дезоксигемоглобин взрослых, и поэтому имеет более высокое сродство к кислороду. В результате, когда кровь плода обогащается кислородом за счет материнской крови, что имеет место в плаценте, кислород переходит от матери к плоду с высокой эффективностью.
Гемоглобин взрослого (НbА) – это белок, переносящий кислород от легких к тканям и осуществляющий транспорт углекислого газа от тканей обратно к легким. Гемоглобин локализован в красных кровяных клетках – эритроцитах. Молекула гемоглобина состоит из четырех полипептидных цепей – двух идентичных α-цепей (обозначаемых α1 и α2) и двух идентичных ß-цепей (обозначаемых ß1, и ß2). Каждая цепь связана с особой группой — гемом.
Миоглобин (Mb) — это белок, переносящий кислород в мышечных клетках. Он состоит из одной полипептидной цепи и имеет один гем. Аминокислотная последовательность миоглобина отличается от последовательностей как α-, так и ß-цепей гемоглобина, однако между всеми тремя последовательностями имеется определенное сходство. В каждой цепи содержится примерно 140-150 остатков.
Очевидно, что для нормального газообмена в тканях, необходимо, чтобы гемоглобин взрослого легко отдавал кислород эмбриональному и фетальному гемоглобину (при беременности) и все три гемоглобина отдавали кислород миоглобину тканей. Иными словами сродство к кислороду этих дыхательных белков должно соответствовать схеме: НbА < HbF и НbЕ < Mb.
Рассмотрим структуру и работу глобинов на примере НbА и Mb.
Структура и работа глобинов.
Простые белки – белки состоящие исключительно из аминокислотной последовательности.
Сложные белки – помимо полипептидной цепи содержат небелковую часть, присоединенную к полипептиду.
Глобины – сложные белки, содержащие в качестве небелковой части гем (см. далее).
Используя метод рентгеноструктурного анализа, Кендрью и Перутц с сотрудниками определили пространственные структуры миоглобина и гемоглобина. Третичная структура α- и ß-цепей гемоглобина и цепи миоглобина оказалась сходной. Во всех трех полипептидах около трех четвертей остатков входит в состав α-спиралей. Все три цепи состоят из шести длинных α-спиральных сегментов, обозначаемых А, В, Е, F, G и Н, в каждом из которых находятся от 10 до 25 остатков. Спирали соединены участками нерегулярной структуры. В области между спиралями В и Е структура цепей различается. В миоглобине имеются две дополнительные α-спирали, С и D, которые в цепях гемоглобина отсутствуют.
(буквы – α-спирали, подчеркнутые точки – соединяющие их участки нерегулярной структуры красным выделен участок различия)
гемоглобин (α- и ß-цепи) миоглобин
… … … … … … …
N-конец…А В •••Е F•••G Н…С-конец N-конец …А В•••С D•••Е F •••G Н…С-конец гем (модель в двух ракурсах и формула)
О

 бщая
укладка α-спиралей во всех цепях настолько
похожа, что принято говорить о «глобиновом
типе сворачивания». В глобинах остатки
обозначаются согласно тому, какое место
по порядку они занимают и в какой
α-спирали. Например,
бщая
укладка α-спиралей во всех цепях настолько
похожа, что принято говорить о «глобиновом
типе сворачивания». В глобинах остатки
обозначаются согласно тому, какое место
по порядку они занимают и в какой
α-спирали. Например,
HisF8 ß-цепи – это восьмой остаток в α-спирали F, ValFG5 – пятый остаток перемычки между α-спиралями F и G, а ТуrНС2 – это второй остаток в С-концевом нерегулярном участке, расположенном за α-спиралью Н.
Г
 ем
состоит из атомов С, N
и H,
образующих плоское порфириновое кольцо
(формула справа). В центре этого кольца
находится Fe+2,
связанный с N-ми
кольца четырьмя из шести своих
возможных координационных связей. Ион
железа Fe+2
имеет
большой диаметр и не до конца помещается
в «отведенное ему место» в плоскости
порфиринового кольца. К нему примыкают
два остатка His.
ем
состоит из атомов С, N
и H,
образующих плоское порфириновое кольцо
(формула справа). В центре этого кольца
находится Fe+2,
связанный с N-ми
кольца четырьмя из шести своих
возможных координационных связей. Ион
железа Fe+2
имеет
большой диаметр и не до конца помещается
в «отведенное ему место» в плоскости
порфиринового кольца. К нему примыкают
два остатка His.
Ближайший гистидин (HisF8) связан с ионом железа через пятую координационную связь (связан с «не поместившейся», выступающей за пределы порфиринового кольца «частью»). По шестой связи к железу может быть присоединен кислород.
Дальний гистидин (HisE7) располагается с противоположной стороны порфиринового кольца по отношению к HisF8 и не образует связи с гемовым железом – здесь должно остаться достаточно свободного пространства для размещения кислорода.
Дезоксигемоглобин – это гемоглобин, не связанный с кислородом. В дезоксигемоглобине Fe+2 находится вне плоскости порфиринового кольца и, кроме того, имеется несколько солевых мостиков и водородных связей, которых нет в оксигенированной форме белка. Некоторые из этих связей образуются между атомами одной и той же цепи (например, водородная связь между ОН-группой ТуrНС2 и карбонильным кислородом ValFG5 ß-цени), другие – между атомами, принадлежащими различным цепям (например, солевой мостик между LysC5 α-цепи и концевой СОО-группой ß-цепи).
Оксигемоглобин – это гемоглобин, связанный с кислородом. Кислород присоединен по шестой координационной связи Fe+2 гема и располагается рядом с дальним остатком гистидина. При связывании кислорода ион железа перемещается в плоскость порфиринового кольца, поскольку кислород оттягивает на себя часть его электронного облака. Одновременно с этим происходят и некоторые другие конформационные изменения, в том числе сдвиг Е- и F-спиралей. Основная перестройка происходит в четвертичной структуре гемоглобина – α- и ß- цепи поворачиваются как единое целое относительно второй пары α- и ß- цепей. В результате всех этих изменений в оксигемоглобине оказывается меньше солевых мостиков, чем в дезоксигемоглобине.
С вязывание
кислорода миоглобином и гемоглобином
можно описать с помощью кривых связывания.
Степень оксигенации гемогрупп зависит
от концентрации присутствующего в среде
кислорода (на графике концентрация
кислорода выражена в виде его
парциального давления). Однако в случае
гемоглобина график имеет S-образную
форму; это говорит о наличии положительных
кооперативных эффектов, т. е. о том, что
после оксигенации одной или большего
числа субъединиц сродство остальных
субъединиц к кислороду возрастает,
поскольку изменяется конформация цепей
и их геммы «приоткрываются», обеспечивая
более активное связывание кислорода.
вязывание
кислорода миоглобином и гемоглобином
можно описать с помощью кривых связывания.
Степень оксигенации гемогрупп зависит
от концентрации присутствующего в среде
кислорода (на графике концентрация
кислорода выражена в виде его
парциального давления). Однако в случае
гемоглобина график имеет S-образную
форму; это говорит о наличии положительных
кооперативных эффектов, т. е. о том, что
после оксигенации одной или большего
числа субъединиц сродство остальных
субъединиц к кислороду возрастает,
поскольку изменяется конформация цепей
и их геммы «приоткрываются», обеспечивая
более активное связывание кислорода.
S-образность кривой связывания кислорода гемоглобином объясняет, каким образом в тканях происходит освобождение кислорода из этого белка. Уменьшение парциального давления кислорода при переходе от артерий к венам приводит к снижению степени оксигенации от почти 100% до примерно 75%. Кислород, диссоциировавший из комплекса с гемоглобином в капиллярах, подхватывается миоглобином, имеющим к нему большее сродство.
Кооперативные эффекты связывания кислорода гемоглобином можно объяснить в рамках симметричной модели Моно, Уаймена и Шанжё. Действительно, как и предполагается в модели, гемоглобин может находиться в двух состояниях, различающихся взаимным расположением субъединиц и числом межсубъединичных контактов. Структура белка в одном из состояний соответствует структуре дезоксигемоглобина, а в другом – структуре оксигемоглобина. В первом состоянии белок обладает меньшим сродством к кислороду и имеет больше солевых мостиков и водородных связей, чем во втором. Согласно модели Моно, Уаймена и Шанжё, первое состояние гемоглобина — это Т-форма (tense-state), а второе — R-форма белка (relaxed-state).
Положение равновесии между Т- и R-формами зависит от концентрации кислорода – чем она выше, тем в большей степени равновесие сдвинуто в сторону R-формы. Пусть какая-то молекулы гемоглобина не связана с кислородом и при этом находится в Т-состоянии. Связывание молекулы кислорода одной из цепей вызывает конформационные изменения в гемогруппе этой цепи и далее во всей субъединице. Эти изменения увеличивают вероятность перехода всей молекулы гемоглобина из Т- в R-состояние. Связывание второй и третьей молекул кислорода еще больше увеличивает эту вероятность. Оказавшись в R-форме, гемоглобин еще легче связывает последнюю, четвертую молекулу кислорода. В результате гораздо более вероятно, что молекула гемоглобина не будет связывать ни одной или связывать четыре молекулы кислорода, чем какое-либо промежуточное их число.
Дифосфоглицерат (ДФГ), обнаруживаемый в эритроцитах, участвует в регуляции процесса присоединения кислорода к гемоглобину. ДФГ легко образует комплекс с дезоксигемоглобином, связываясь в щели между двумя α-цепями, но обладает низким сродством к оксигемоглобину. Поэтому, при падении концентрации кислорода (в капиллярах тканей), ДФГ уменьшает сродство гемоглобина к кислороду и вызывает высвобождение кислорода в ткани.
Миоглобин (Mb) состоит из одной полипептидной цепи и имеет один гем. Для него график связывания кислорода представляет собой гиперболу, что и следует ожидать при простом одноэтапном процессе, поскольку отсутствуют кооперативные эффекты. Аминокислотная последовательность миоглобина отличается от последовательностей как α-, так и ß-цепей гемоглобина на участке между В и Е спиралями, где содержатся два дополнительных α-спиральных участка (С и D). В его третичной структуре щель между E и F спиралями больше, чем в цепях Hb, и более «открытый» гем легче присоединяет кислород. Поэтому в капиллярах миоглобин, имеющий большее сродство к кислороду, «подхватывает» О2, диссоциировавший из комплекса с гемоглобином.
Помимо рассмотренных закономерностей, значимую роль в работе гемоглобина играет эффект Бора, заключающийся в высвобождении протонов при присоединении кислорода к гемоглобину. Это очень важно для транспорта углекислого газа из тканей к легким.
