
- •1) Потенциал действия и его развитие. 2) Синаптическая передача. 19
- •Строение белков
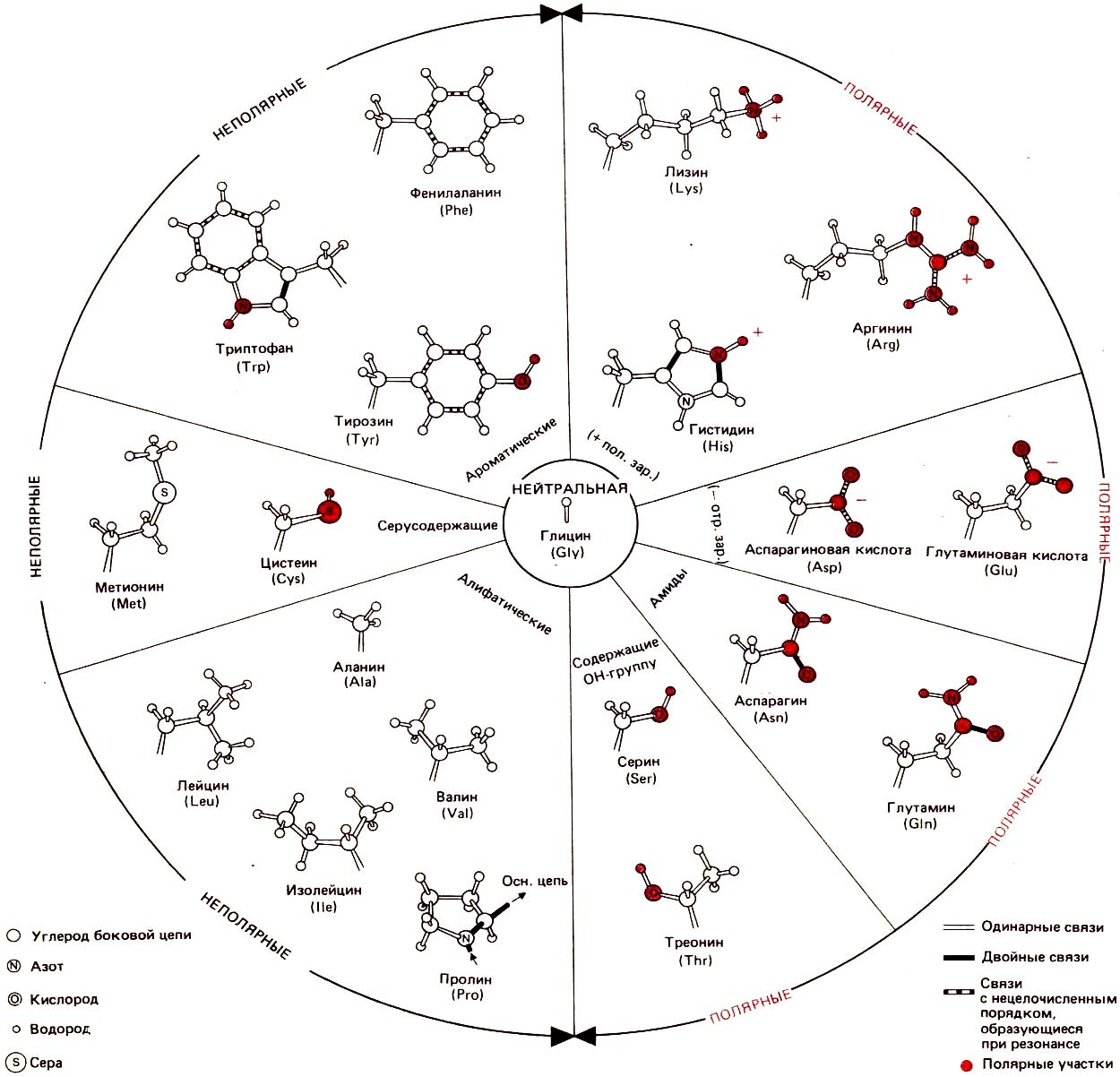
- •3. Полярные (гидрофильные)
- •Биологические функции белков
- •Таким образом, свойства, необходимые этому структурному белку – слабая растяжимость, прочность и гибкость определяются особенностями его строения.
- •1) Потенциал действия и его развитие. 2) Синаптическая передача.
- •Таким образом, свойства, определяющие способность глобинов обратимо связывать кислород и передавать его друг другу, определяются особенностями их строения.
3. Полярные (гидрофильные)
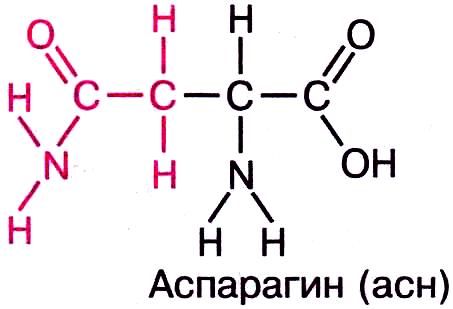
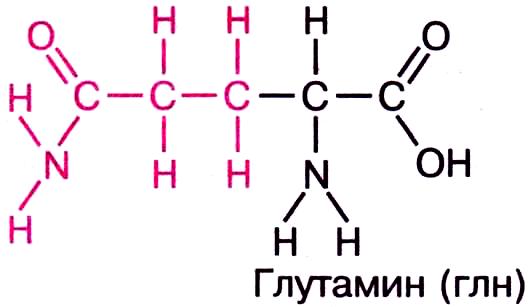
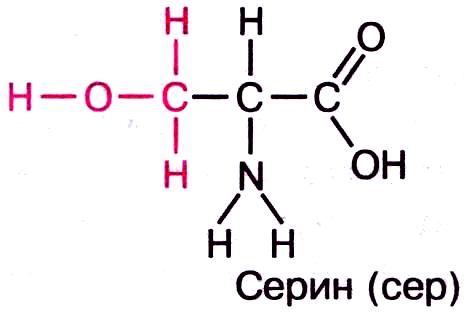
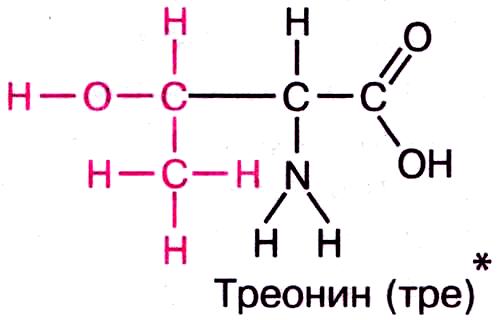
а) полярные незаряженные — Asn, Gln, Ser и Thr — имеют поляризованные ковалентные связи и, следовательно, электроотрицательные и электроположительные участки.
1) амиды 2) с гидроксогруппой
б
 )
полярные отрицательно заряженные
— Asp-
и Glu-
— имеют отрицательно заряженную СОО-
группу.
Будучи в СООН - (т.е. в протонированной)
форме, они могут вести себя как кислоты.
)
полярные отрицательно заряженные
— Asp-
и Glu-
— имеют отрицательно заряженную СОО-
группу.
Будучи в СООН - (т.е. в протонированной)
форме, они могут вести себя как кислоты.

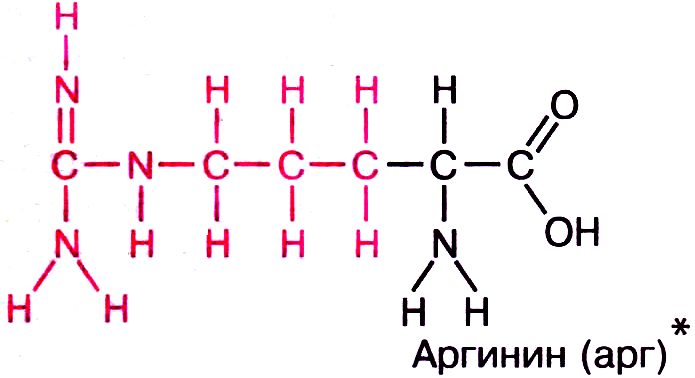
в) полярные положительно заряженные — Lys+, Arg+, и His+— несут положительный заряд вследствие протонирования атома азота. В депротонированной форме они могут проявлять свойства оснований.


Реакция пептизации, пептидная связь, первичная структура белка.
Пептидная связь.
Пептидная связь образуется в результате реакции конденсации между аминогруппой одной свободной аминокислоты и карбоксильной группой другой (или между аминогруппой свободной аминокислоты и карбоксильным концом полипептида). При этом выделяется вода. Таким образом, свободные аминокислоты представляют собой мономеры, из которых путем поликонденсации строится полимер — молекула белка. Белок синтезируется в результате повторяющихся актов образования пептидной связи.
В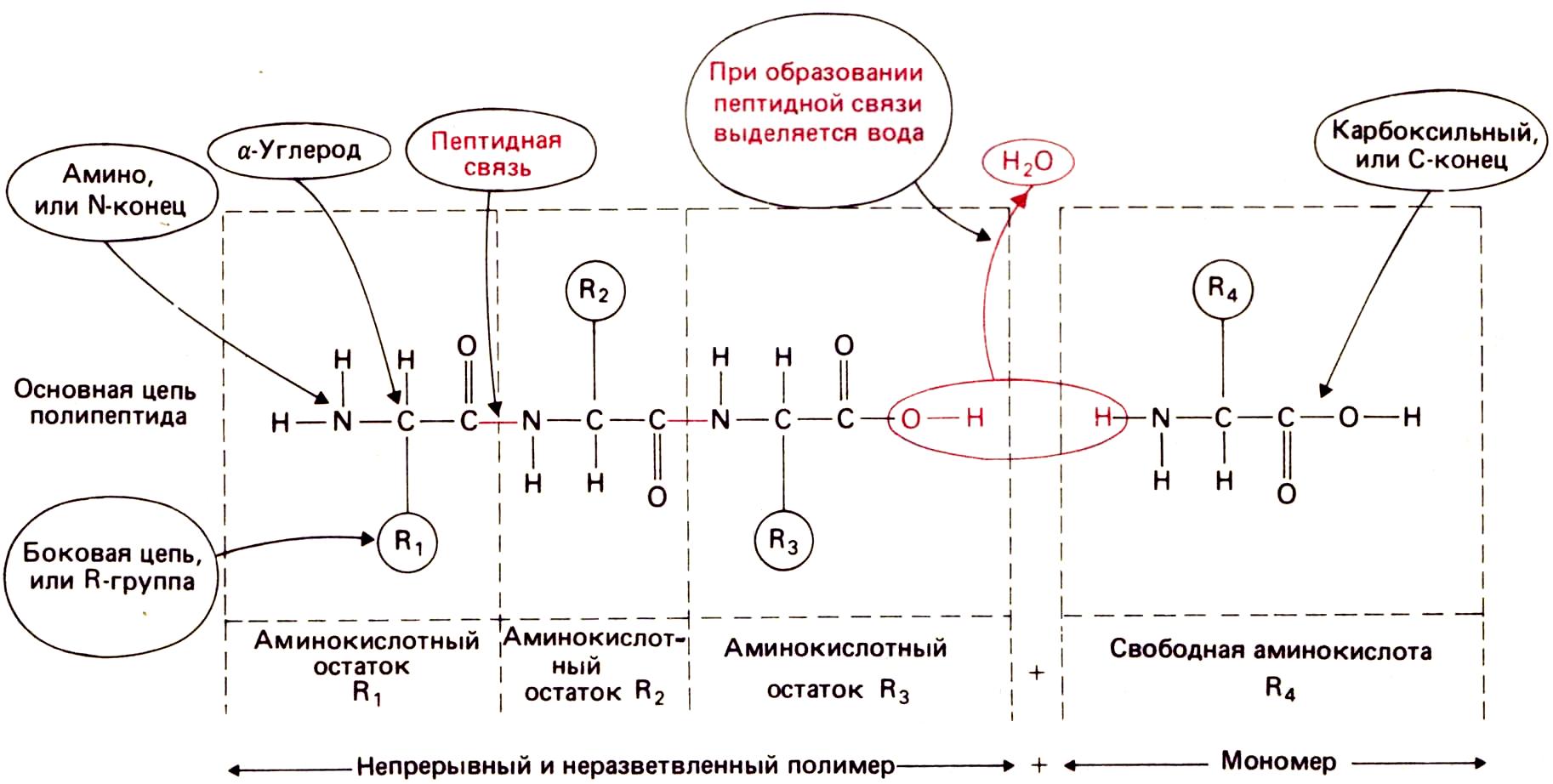 клетке эта реакция в ходе трансляции
катализируется рибосомой, в активном
центре которой в качестве фермента
выступает не белок, а молекула рибосомальной
РНК. Для осуществления реакции пептизации
в лабораторных условиях требуется
нагревание смеси сухих аминокислот до
температуры t°
≈ 200-300° С.
клетке эта реакция в ходе трансляции
катализируется рибосомой, в активном
центре которой в качестве фермента
выступает не белок, а молекула рибосомальной
РНК. Для осуществления реакции пептизации
в лабораторных условиях требуется
нагревание смеси сухих аминокислот до
температуры t°
≈ 200-300° С.
Белки — один из основных классов биологических макромолекул. Значительная вариабельность последовательностей обеспечивает большое разнообразие структур и функций белков. Поскольку полипептиды построены в основном из 20 разных аминокислот, для белка, содержащего 100 остатков, возможно 20100 (т. е. примерно 10130) различных вариантов последовательности.
При описании того или иного белка обычно пользуются терминами первичная, вторичная, третичная и четвертичная структура. Под первичной структурой понимают химическую формулу белка, изображаемую в виде линейной последовательности аминокислотных остатков. Терминами вторичная, третичная и четвертичная структура обозначают различные уровни организации этой линейной последовательности в пространстве.
Глобулярные белки, которые в грубом приближении могут быть представлены в виде сфер, принимают участие в специфических процессах, таких как катализ, транспорт или регуляция. Фибриллярные белки (сильно вытянутые молекулы), например коллаген, кератины и фиброин шелка, из-за присущей им эластичности или жесткости часто играют структурную роль.
Первичная структура белка – последовательность соединения аминокислотных остатков в цепи.
П ервым
исследователем, определившим
аминокислотную последовательность
молекулы белка, был Фред Сэнгер (Fred
Sangcr),
работавший в Кембриджском университете,
в той самой лаборатории, где Уотсон и
Крик определили структуру ДНК. Сэнгер
работал с гормоном инсулином — самым
маленьким белком, какой ему удалось
найти. Работа заняла 10 лет и результаты
се были опубликованы в 1953г. В 1958г. Сэнгер
за эту работу был удостоен Нобелевской
премии (вторую Нобелевскую премию он
получил за изучение структуры нуклеиновых
кислот). В молекулу инсулина входит
51 аминокислота. Молекула состоит из
двух полипептидных цепей, удерживаемых
вместе дисульфидными мостиками. В
настоящее время большая часть работ по
определению аминокислотных
последовательностей автоматизирована,
и теперь первичная структура известна
уже более, чем для сотни тысяч белков,
и все они построены из одних и тех же 20
мажорных аминокислот.
ервым
исследователем, определившим
аминокислотную последовательность
молекулы белка, был Фред Сэнгер (Fred
Sangcr),
работавший в Кембриджском университете,
в той самой лаборатории, где Уотсон и
Крик определили структуру ДНК. Сэнгер
работал с гормоном инсулином — самым
маленьким белком, какой ему удалось
найти. Работа заняла 10 лет и результаты
се были опубликованы в 1953г. В 1958г. Сэнгер
за эту работу был удостоен Нобелевской
премии (вторую Нобелевскую премию он
получил за изучение структуры нуклеиновых
кислот). В молекулу инсулина входит
51 аминокислота. Молекула состоит из
двух полипептидных цепей, удерживаемых
вместе дисульфидными мостиками. В
настоящее время большая часть работ по
определению аминокислотных
последовательностей автоматизирована,
и теперь первичная структура известна
уже более, чем для сотни тысяч белков,
и все они построены из одних и тех же 20
мажорных аминокислот.
Первичная структура лизоцима. Лизоцим — это фермент, обнаруженный во многих тканях и секретах человеческого тела, в растениях и яичном белке. Этот фермент катализирует разрушение клеточных стенок бактерии. Молекула лизоцима состоит из одной полипептидной цепи, в которую входят 129 аминокислотных остатков. В молекуле имеется четыре внутрицепочечных дисульфидных мостика.
Каждый остаток имеет константную (т. е. одинаковую для всех остатков) часть и, за исключением двух концевых остатков, связан с двумя другими таким образом, что формируется непрерывная, неразветвленная цепь, которая называется основной цепью белковой молекулы. К каждому α-углеродному атому (α-углероду, или Сα) основной цепи присоединены вариабельные части аминокислотных остатков (радикалы, или R-группы).
На одном конце цепи находится свободная —NH2 группа (это N-конец – начало белковой цепи), а на другом — свободная —СООН-группа (это С-конец). Первичной структурой белка (аминокислотной последовательностью) называется порядок расположения остатков вдоль полипептидной цепи. Обычно в белковых молекулах насчитывается более 40 остатков. Встречаются полипептиды, состоящие из 1000 и более аминокислотных остатков.
Белок |
Молекулярная масса* |
Число аминокислотных остатков |
Число полипептидных цепей |
Рибонуклеаза |
12640 |
124 |
I |
Лизоцим |
13930 |
129 |
1 |
Миопюбин |
16890 |
153 |
1 |
Гемоглобин |
64500 |
574 |
4 |
ВТМ (вирус табачной мозаики) |
≈40 000000 |
≈336 500 |
2130 |
* Наиболее крупные белковые молекулы находят у вирусов, для которых молекулярные массы, превышающие 40 000 000 - величины вполне обычные. |
|||
Свободная аминокислота отличается от аминокислотного остатка наличием дополнительного атома водорода на одном конце (а следовательно, присутствием аминогруппы —NH2) и дополнительной гидроксильной группы (—ОН) на другом конце (а следовательно, наличием карбоксильной группы —СООН.
Особенности пептидной связи.
П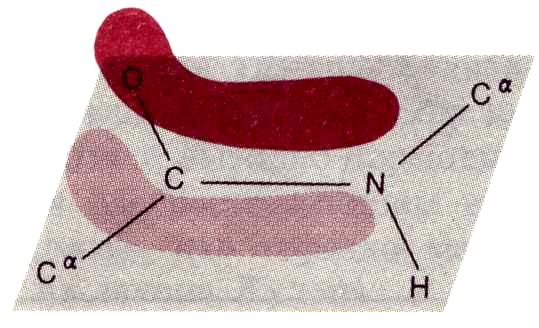 ептидная
связь (С—N
-связь) вопреки ожиданиям не
является одинарной,
а в силу резонанса оказывается частично
двойной (C……N).
При этом соответственно уменьшается
порядок двойной связи С=0. Такое изменение
порядка связей вызвано тем, что одна
пара электронов связи С=0 распределяется
между атомами О, С и N. Вследствие этого
перераспределения атомы О, С, N,
Н (пептидная группа) и связанные с ними
ковалентно два Сα-атома
оказываются лежащими в одной плоскости,
называемой амидной,
а вращение вокруг связи С—N становится
запрещенным. Предположение о планарности
пептидной группы было высказано Полингом
и Кори. Они заметили, что длина пептидной
связи (0,132 нм) имеет промежуточное
значение между длиной одиночной С—N
-связи (0,149 нм) и двойной C=N
-связи (0,127 нм).
ептидная
связь (С—N
-связь) вопреки ожиданиям не
является одинарной,
а в силу резонанса оказывается частично
двойной (C……N).
При этом соответственно уменьшается
порядок двойной связи С=0. Такое изменение
порядка связей вызвано тем, что одна
пара электронов связи С=0 распределяется
между атомами О, С и N. Вследствие этого
перераспределения атомы О, С, N,
Н (пептидная группа) и связанные с ними
ковалентно два Сα-атома
оказываются лежащими в одной плоскости,
называемой амидной,
а вращение вокруг связи С—N становится
запрещенным. Предположение о планарности
пептидной группы было высказано Полингом
и Кори. Они заметили, что длина пептидной
связи (0,132 нм) имеет промежуточное
значение между длиной одиночной С—N
-связи (0,149 нм) и двойной C=N
-связи (0,127 нм).
Конформациями молекулы называются такие варианты расположения в пространстве составляющих молекулу атомов, которые могут быть получены один из другого вращением вокруг одинарных ковалентных связей. В противоположность этому, конфигурации – это такие варианты взаимного расположения атомов молекулы, переходы между которыми требуют разрыва и образования ковалентных связей. Так, D- и L-изомеры аминокислотных остатков представляют собой различные конфигурации, а α-спираль и коллагеновая спираль (см. далее) – различные конформации полипептидной цепи.
Трансконфигурация пептидной группы.
С α-атомы,
примыкающие с двух сторон к одной
пептидной группе, находятся
в транс-конфигурации
по отношению друг к другу. При этом не
происходит
внутренней компенсации ( в пределах
одной амидной плоскости) частичных
зарядов >N—Нδ+
и >С=Оδ—
-групп, что крайне существенно для
организации вторичной структуры белковой
цепи.
α-атомы,
примыкающие с двух сторон к одной
пептидной группе, находятся
в транс-конфигурации
по отношению друг к другу. При этом не
происходит
внутренней компенсации ( в пределах
одной амидной плоскости) частичных
зарядов >N—Нδ+
и >С=Оδ—
-групп, что крайне существенно для
организации вторичной структуры белковой
цепи.
Альтернативная цис-конфигурация невыгодна из-за слишком сильного сближения объемных групп, присоединенных к Сα - атомам.
Почему в этом случае речь идет о цис- и транс-конфигурациях, а не о конформациях?
Конформации пептидов. Карта Рамачандрана. Вторичная структура белка.
Сα-атом, являющийся общим для двух соседствующих амидных плоскостей, связан одинарными связями с N-атомом одной пептидной группы и с С- карбоксильным атомом следующей. Вокруг этих одинарных связей возможно относительно свободное вращение. Получается, что амидные плоскости, связанные своими углами, могут вращаться друг относительно друга, а Сα –атом является центром этого вращения.
Углы ф и ψ («фи» и «пси»). Для описания вращения вокруг связей N— Сα и Сα —С используются соответственно углы ф (фи) и ψ (пси). Угол ф задает положение всех атомов, которые лежат в амидной плоскости, предшествующей Сα -атому, а угол ψ определяет положение всех атомов амидной плоскости, следующей за Сα -атомом.
Некоторые пары значений ф и ψ запрещены, поскольку при этом имеют место стерические ограничения из-за сближения двух атомов на расстояние, меньшее, чем сумма их контактных (т.е. вандерваальсовых) радиусов. Например, при ф = 0°, ψ = 180° возникают стерические контакты между двумя атомами кислорода.

Конформационная карта Рамачандрана, или (ф, ψ)-карта, показывает, какие пары значений ф и ψ разрешены.
Эта карта названа именем индийского ученого, рассчитавшего допустимые значения углов ф и ψ. Каждая точка на карте соответствует определенной паре значений ф и ψ и показывает, является ли данное взаимное расположение атомов двух амидных плоскостей и радикалов, присоединённых к Сα-атому, энергетически выгодньм.
Приведенная выше (ф, ψ) -карта характерна для большинства боковых цепей, за исключением глицина и пролина.
В случае полностью разрешенных конформаций нежелательные контакты между атомами отсутствуют.
Запрещенные углы (например, ф = 0°, ψ = 180°) соответствуют конформациям, в которых отдельные атомы находятся друг от друга на расстоянии, меньшем суммы их контактных радиусов. Необходимо отметить, что, поскольку атомы не являются жесткими сферами, возможно сближение их на расстояние, несколько меньшее суммы контактных радиусов. Хотя подобное сближение нежелательно, оно тем не менее может иметь место, а соответствующие конформации называются частично разрешенными (например, ф = — 180°, ψ = 180°).
Если каждую полностью разрешенную пару значений ф и ψ представить на карте темнокоричневой точкой, то получающиеся в результате темно-коричневые участки будут представлять собой полностью разрешенные области значений углов ф и ψ. Частично разрешенные области значений углов ф и ψ отмечены на карте светло-коричневым цветом.
Следует подчеркнуть, что (ф, ψ)-карты указывают разрешенные пары значений ф и ψ для данного конкретного остатка. Боковая цепь глицина, состоящая лишь из одного атома водорода, по размеру меньше, чем у любого другого остатка. Поэтому на (ф, ψ)-карте для глицина больше разрешенных областей, чем на картах других остатков. Напротив, в случае пролина ограничения, налагаемые ковалентной связью между атомом углерода боковой цепи и атомом азота основной цепи, приводят к значительному уменьшению размеров разрешенных областей.
В
 торичная
структура белка – пространственная
конформация участка основной цепи
белковой молекулы, без учета конформаций
и взаимодействий радикалов аминокислот.
торичная
структура белка – пространственная
конформация участка основной цепи
белковой молекулы, без учета конформаций
и взаимодействий радикалов аминокислот.
Если у нескольких соседних вдоль цепи амидных плоскостей значения ф и ψ окажутся соответственно одинаковыми (ф1=ф2=ф3=…= фn, ψ1=ψ2=ψ3=…=ψn), то в пределах этого участка у каждого Сα- атома основная цепь будет поворачиваться на один и тот же угол. В результате получится регулярная вторичная структура. Если такого взаимного соответствия углов не наблюдается, принято говорить, что фрагменту характерна нерегулярная (но не случайная!) структура. Регулярные структуры могут быть либо спиральными (α-спираль и коллагеновая спираль и др.), либо складчано-листовыми (параллельный и антипараллельный ß-слои). Значения углов ф и ψ, соответствующие этим типам регулярной вторичной структуры, можно найти на карте Рамачандрана. Вторичная структура, обычно стабилизирована водородными связями между >N—Нδ+ и >С=Оδ— – группами основной цепи.
Основные регулярные вторичные структуры.
Спиральные регулярные структуры.
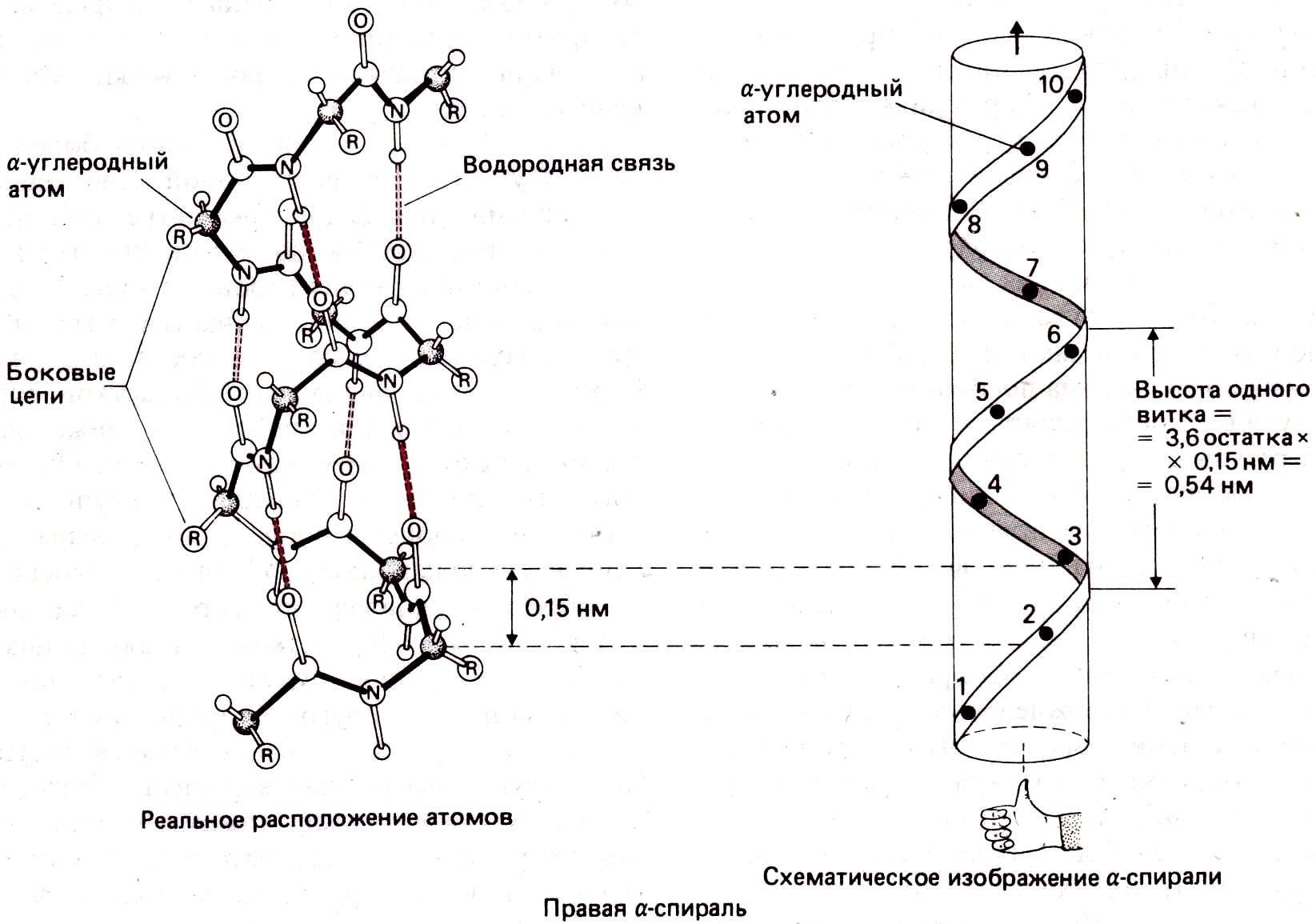
Поскольку основная цепь у каждого Са-атома поворачивается на один и тот же угол, то образующуюся структуру можно рассматривать как результат наматывания цепи на боковую поверхность воображаемого цилиндра – спираль. Спираль характеризуется числом повторяющихся единиц (остатков), приходящихся на один виток (обозначается п), и расстоянием между соседними остатками вдоль оси спирали (d). Высота одного витка (р) равна произведению п на d. Спирали могут быть правыми и левыми. Утверждение, что какая-то спираль является правой, означает, что если вытянутый вперед большой палец правой руки направить вдоль оси спирали, то расположенные перпендикулярно ему зажатые в кулак остальные пальцы будут указывать направление хода цепи. В природе значительно более распространены правые спирали белковых цепей, чем левые.
α -Спираль
(Полинг
и Кори, 1951г)
(стабильная
форма):
-Спираль
(Полинг
и Кори, 1951г)
(стабильная
форма):
п равозакрученная
равозакрученная
ф = –57°, ψ = –47°
n = 3,6 (число остатков на виток)
d = 0,15 нм (расстояние между соседними остатками вдоль оси спирали),
р = 0,54 нм (3,6х 0,15 нм) (высота одно витка).
Каждая >С=Оδ- группа образует водородную связь с четвертой по ходу цепи >N—Нδ+ группой. Таким образом, все >N—Нδ+ и >С=Оδ- группы, за исключением находящихся на концах спирали, могут образовывать водородные связи (стабильная форма).
α-Спираль по форме напоминает прутик, в котором стебель — это основная цепь, а торчащие в разные стороны ветки – R-группы.
(слева – вид с боку, справа – вид с торца; зеленые линии – внутреннее напряжение спирали,
пунктиром обозначены водородные и сопряженные связи)
α
 -Спирали
обычно состоят из 6-24 остатков,
соответственно длина их варьирует от
0,9 до 2,4 нм. Значения углов ф и ψ в спирали
всегда немного отличаются от стандартных.
-Спирали
обычно состоят из 6-24 остатков,
соответственно длина их варьирует от
0,9 до 2,4 нм. Значения углов ф и ψ в спирали
всегда немного отличаются от стандартных.
Зеркально-симметричная правой α-спирали левая α-спираль встречается в природе крайне редко, хотя энергетически возможна.
Коллагеновая спираль (стабильная форма):
левозакрученная (единственная из стабильных, представленная в природе)
ф = –60°, ψ = 140°
n = 3 (число остатков на виток)
d = 0,29 нм (расстояние между соседними остатками вдоль оси спирали),
р = 0,87 нм (3 х 0,29 нм) (высота одно витка).
В такой конформации находится основная часть полипептидной цепи фибриллярного белка коллагена. Этот белок имеет весьма специфический аминокислотный состав: 1/3 глицина, 1/3 пролина, а значительную долю последней трети составляют миноры – гидроксипролин и гидроксилизин. Между атомами основной цепи одиночного полипептида водородных связей не образуется (из-за растянутости спирали). Тем не менее такая конформация (значительно более вытянутая, чем α-спираль, у которой расстояние между остатками составляет 0,15 нм) оказывается предпочтительной для полипептидной цепи, содержащей радикалы пролина и гидроксипролина, ограничивающие вращение вокруг ф- угла (модель справа).
Спираль - 310 (не стабильная форма):
Иногда несколько остатков принимают конформацию спирали 310, отличную от конформации α-спирали. Это правая спираль, на один виток которой приходится 3 аминокислотных остатка, а водородные связи образуются между (n) и (n – 3) по ходу цепи остатками, т.е. у каждого 10 атома цепи.
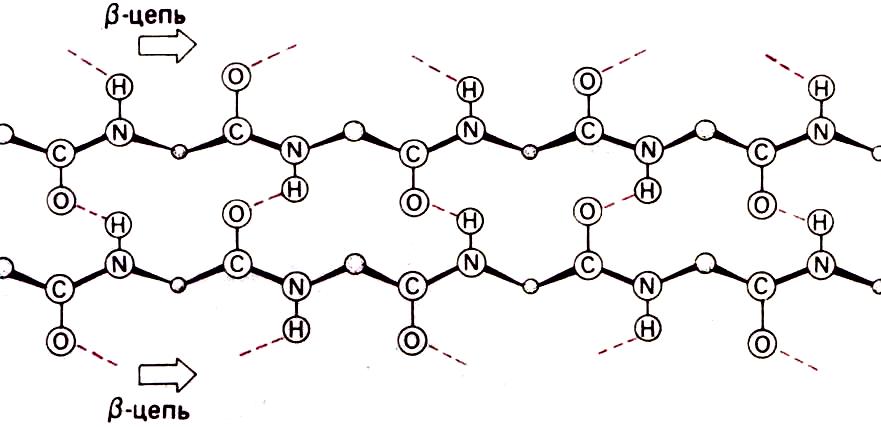
Складчато-листовые регулярные структуры – ß -слои (Полинг и Кори, 1951г) (стабильнае структуры).
ß-Слой формируется из двух или более структурных участков полипептидной цепи, называемых ß- участками. В каждом ß- участке полипептидная цепь почти полностью вытянута; при этом >N—Нδ+ и >С=Оδ- группы ориентированы примерно перпендикулярно направлению ß- участка и могут образовывать водородные связи с соседними участками.
Антипараллельный (↑↓) ß-слой
В
 результате из нескольких ß-участков
образуется структура, которая в грубом
приближении оказывается плоской,
напоминающей лист. Однако из-за того
что плоскости пептидных групп в каждом
ß -участке наклонены поочередно в разные
стороны относительно направления ß-
участка, плоский ß-слой приобретает
складчатую форму. Если двигаться вдоль
одного из ß- участков, составляющих
ß-слой, то радикалы будут выступать по
очереди то с одной, то с другой стороны
ß-слоя. Существуют два разных варианта
образования водородных связей между
тяжами в составе ß-слоя – параллельный
(↑↑) ß-слой
и антипараллельный (↑↓) ß-слой.
Каждому варианту соответствует свои
значения углов ф и ψ.
результате из нескольких ß-участков
образуется структура, которая в грубом
приближении оказывается плоской,
напоминающей лист. Однако из-за того
что плоскости пептидных групп в каждом
ß -участке наклонены поочередно в разные
стороны относительно направления ß-
участка, плоский ß-слой приобретает
складчатую форму. Если двигаться вдоль
одного из ß- участков, составляющих
ß-слой, то радикалы будут выступать по
очереди то с одной, то с другой стороны
ß-слоя. Существуют два разных варианта
образования водородных связей между
тяжами в составе ß-слоя – параллельный
(↑↑) ß-слой
и антипараллельный (↑↓) ß-слой.
Каждому варианту соответствует свои
значения углов ф и ψ.
Антипараллельный (↑↓) ß-слой
ф = –139°, ψ= 135°
соседние ß-участки цепи направлены в противоположные стороны.
Параллельный (↑↑) ß-слой
ф = –119°, ψ = 113°
соседние ß-участки цепи направлены в одну сторону.
Участки ß-слоя, как правило, состоят из 3—10 остатков и имеют длину от 1,0 до 3,3 нм. Параллельный ß-слой.
Т
 ипичный
ß-слой содержит от 2 до 10 ß-участков.
Иногда в одном и том же слое присутствуют
оба типа укладки. Так же как и в случае
α-спирали, реальная конформация ß-слоя
может несколько отличаться от стандартной.
ипичный
ß-слой содержит от 2 до 10 ß-участков.
Иногда в одном и том же слое присутствуют
оба типа укладки. Так же как и в случае
α-спирали, реальная конформация ß-слоя
может несколько отличаться от стандартной.
α-Спираль и ß-структура являются энергетически наиболее выгодными конформациями, поскольку обе они стабилизированы водородными связями между >N—Нδ+ и >С=Оδ- группами основной цепи. Кроме того, и α-спираль, и ß-структура дополнительно стабилизируются благодаря плотной упаковке атомов основной цепи, которые подогнаны друг к другу, как кусочки пазла. Большинство глобулярных белков имеет α-спиральные и/или ß-структурные участки, перемежающиеся участками нерегулярной структуры.
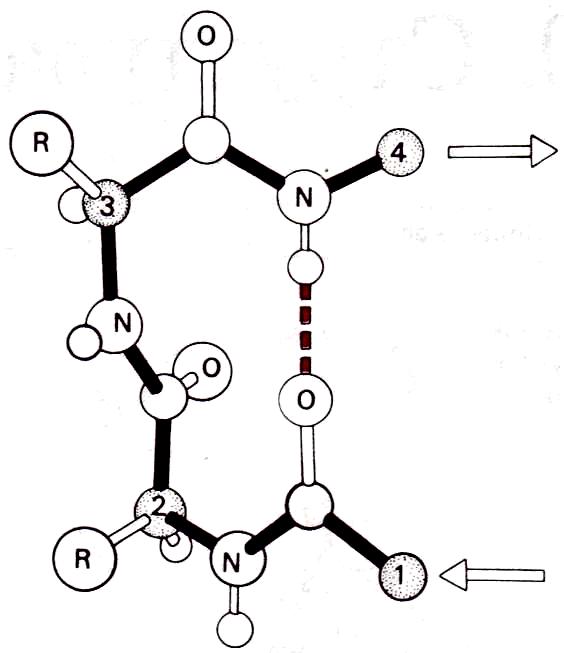
ß-Изгиб – это тип нерегулярной вторичной структуры, встречающийся во многих глобулярных белках в тех местах, где направление полипептидной цепи меняется на противоположное. Данная структура часто рассматривается как связующее звено между двумя уложенными антипараллельно ß-участками в составе ß-слоя. На рисунке приведен пример ß-изгиба из четырех остатков с одной водородной связью между >С=Оδ- группой остатка 1 и >N—Нδ+ группой остатка 4. В белках обнаруживаются и другие типы ß-изгибов. В отличие от α-спирали, коллагеновой спирали и ß-слоя в ß-изгибе значения углов ф и ψ у разных остатков неодинаковы. ß-Изгибы обычно находятся у поверхности белковой глобулы.
ß-Изгиб.
Предсказать, какие участки молекулы глобулярного белка будут иметь регулярную вторичную структуру, основываясь на данных об их аминокислотной последовательности, можно с точностью около 70%. Одни остатки (например, Glu, Met, Ala и Leu) часто встречаются в α-спиралях, в то время как другие (Gly и Pro) — значительно реже. Что касается пролина (Pro), то этот остаток может находиться в α-спирали лишь в одном из первых трех положений, поскольку в остальных позициях наличие ковалентной связи между боковой цепью пролинового остатка и атомом азота основной цепи не позволяет >N—Н -группе образовать водородную связь. Некоторые остатки предпочтительно встречаются в ß-участках (например, Val, Ile, Туr и Phe), тогда как остатки Asp и Glu принимают эту конформацию довольно редко. Такие данные о встречаемости различных остатков в разных типах вторичной структуры используются при предсказании локализации в белке α- и ß-участков.
Третичная и четвертичная структуры белка.
Т ретичная
структура белка
– полная пространственная укладка
одиночной белковой цепи, с учетом
конформаций и взаимодействия радикалов.
ретичная
структура белка
– полная пространственная укладка
одиночной белковой цепи, с учетом
конформаций и взаимодействия радикалов.
Если общая конфигурация свернутой молекулы такова, что отношение длины к ширине меньше 10 (а/b < 10), белок называют глобулярным, если a/b > 10 – фибриллярным.
Некоторые белки состоят из нескольких полипептидных цепей. Каждая цепь — это одна субъединица, или мономер. Димеры содержат две полипептидные цепи (тубулин), тетрамеры – четыре (гемоглобин), октамеры – восемь (гистоны нуклеосомы) и т.д. Цепи белков-мультимеров не всегда одинаковы. Так молекулы гемоглобина представляет собой типичный тетрамер, в котором имеются две идентичные α-цепи и две идентичные ß-цепи*. Крайне редко встречаются мультимеры с нечетным числом глобул.
Четвертичная структура белка – взаимное расположение в пространстве мономеров, формирующих молекулу белка, который состоит из нескольких субъединиц (полипептидных цепей, каждая из которых свернута в третичную структуру).
Итак, четвертичная структура характерна не всем белкам, а только белкам-мультимерам. Согласно экспериментальным данным, критическими точками являются относительные молекулярные массы (Mr) белков:
Mr < 40 000 – белки, которым не характерна четвертичная структура,
Mr > 100 000 – белки-мультимеры
40 000 < Mr < 100 000 – мелкие мультимеры и крупные мономерные белки.
Взаимодействия радикалов.
Силы, способствующие формированию и поддержанию третичной и четвертичной структуры белков, единообразны. Это:
а) минимизация энергии при конформации (иначе – энергетически выгодная конформация основных цепей и радикалов),
б) R-R взаимодействия,
в) водородные связи между разными участками основной (-ых) цепи (-ей) (если не все >N—Нδ+ и >С=Оδ- -группы основной цепи были задействованы при укладке вторичной структуры).
Из указанных сил мы с вами не рассматривали возможные варианты взаимодействия радикалов аминокислот. Исходя из структуры этих радикалов, можно предположить возможность образования и существования:
1) ковалентных связей: |
а) пептидной связи: |
а.к.–R–СOOH + NH2–R–а.к. → а.к.–R–CO–NH–R–а.к. + H2O |
б) эфирной связи: |
а.к.–R–ОН + НО–R–а.к. → а.к.–R–О–R–а.к. + H2O |
|
в) сложноэфирной связи |
а.к.–R–С–OH + НО–R–а.к. → а.к.–R–С–О–R–а.к. + H2O ║ ║ О О |
|
г) дисульфидной связи |
а.к.–R–S–H + H – S–R–а.к. → а.к.–R–S–S–R–а.к + 2Н• (на носителе) |
|
2) ионных связей: |
между полярными разноименно заряженными радикалами |
|
3) водородных связей: |
между полярными незаряженными радикалами |
|
4) гидрофобных взаимодействий (т.н. «жирная капля»): |
обособление гидрофобных радикалов в гидрофильной среде. Этот тип взаимодействий относится, скорее, не к химическому, а к физическому типу: молекулы воды, не имея возможности контактировать с неполярными радикалами, образуют вокруг них единую «стягивающую» пленку, минимизируя ее площадь (аналог пленки поверхностного натяжения). Таким образом, это не гидрофобные радикалы слипаются между собой, а их прижимает друг к другу общая водная пленка. |
|

Подберите пары аминокислот, радикалы которых потенциально способны к каждому из указанных типов взаимодействия. Там, где возможно, запишите уравнения реакций.
Как мы видим, наиболее многообразны варианты формирования ковалентных связей. Тем не менее, далеко не все они с равной вероятностью реализуются в природе: так пептидная связь между радикалами аминокислот практически не встречается (объясните, почему; при затруднении вернитесь к условиям образования пептидной связи). Наиболее значимым, из ковалентных связей, является образование дисульфидного мостика.
Д
 исульфидным
мостиком называется ковалентная связь,
соединяющая либо две части одной и той
же полипептидной цепи, либо два разных
полипептида. Дисульфидный мостик
образуется при окислении двух остатков
цистеина (т. е. при отщеплении водорода
от двух реакционноспособных сульфгидрильных
групп —SH). Новый остаток носит название
цистин.
исульфидным
мостиком называется ковалентная связь,
соединяющая либо две части одной и той
же полипептидной цепи, либо два разных
полипептида. Дисульфидный мостик
образуется при окислении двух остатков
цистеина (т. е. при отщеплении водорода
от двух реакционноспособных сульфгидрильных
групп —SH). Новый остаток носит название
цистин.
Основные типы R-R взаимодействий.
Двойная изогнутая ливня обозначает основную цепь.
а-электростатическое взаимодействие;
б-водородные связи;
в-взаимодействие неполярных боковых цепей, вызванное вталкиванием гидрофобных радикалов в «сухую зону» молекулами растворителя (так называемая «жирная капля»);
г-дисульфидные связи.
_______________________________________________
* - название α- и ß-цепей гемоглобина не имеет отношения к α-спиралям и ß-участкам. Это только нумерация цепей.
Упаковка субъединиц в мультимерном (состоящем из нескольких субъединиц) белке осуществляется благодаря взаимодействиям того же типа, что и при образовании третичной структуры белка. Обычно субъединицы бывают упакованы довольно симметрично (хотя не всегда имеет место полная симметрия), как, например, в молекуле гемоглобина, где четыре субъединицы располагаются в вершинах тетраэдра.
Особенности третичной структуры глобулярных белков.
С помощью рентгеноструктурного анализа белковых кристаллов расшифрована трехмерная структура более ста различных белков. Положение большинства атомов, за исключением атомов водорода, может быть определено с точностью 0,1 нм. В основном это водорастворимые глобулярные белки, поэтому все, что будет сказано далее, касается именно этого класса белков.
Н
 а
поверхности
белковой глобулы сосредоточены в
основном полярные группы и заряженные
атомы, предпочитающие взаимодействовать
с водным окружением. Сюда относятся
полярные группы >N—Нδ+
и >С=Оδ-
основной цепи, заряженные атомы боковых
цепей остатков Glu-,
Asp-,
Lys+
и Arg+
и полярные боковые цепи таких остатков,
как Ser,
Thr,
Asn,
Gln
и др. Между противоположно заряженными
группами (например, между Glu-
и Lys+)
на поверхности белковой глобулы иногда
образуются ионные связи, которые
называются солевыми мостиками. Кроме
того, на поверхности имеется некоторое
количество неполярньгх атомов.
а
поверхности
белковой глобулы сосредоточены в
основном полярные группы и заряженные
атомы, предпочитающие взаимодействовать
с водным окружением. Сюда относятся
полярные группы >N—Нδ+
и >С=Оδ-
основной цепи, заряженные атомы боковых
цепей остатков Glu-,
Asp-,
Lys+
и Arg+
и полярные боковые цепи таких остатков,
как Ser,
Thr,
Asn,
Gln
и др. Между противоположно заряженными
группами (например, между Glu-
и Lys+)
на поверхности белковой глобулы иногда
образуются ионные связи, которые
называются солевыми мостиками. Кроме
того, на поверхности имеется некоторое
количество неполярньгх атомов.
Внутренняя часть белковой глобулы представляет собой неполярную среду, защищенную от контактов с окружающим растворителем благодаря плотной упаковке атомов. Гидрофобное ядро образовано неполярными группами, входящими главным образом в состав алифатических и ароматических боковых цепей Ala, Val, Ile, Leu, Met, Phe и Тrр. Полярной или заряженной группе энергетически невыгодно находиться в таком гидрофобном окружении, если она при этом не взаимодействует с другой полярной группой или с атомом, имеющим противоположный заряд. Поэтому оказавшиеся внутри глобулы >N—Нδ+ и >С=Оδ- группы основной цепи образуют между собой водородные связи, формируя в результате α-спирали и ß-слои. Точно так же находящиеся внутри глобулы противоположно заряженные группы (например, Glu- и Lys+) образуют ионные связи – солевые мостики.
Одни участки полипептидной цепи, находящиеся внутри свернутой белковой глобулы, являются α- спиралями или же (ß-структурами, другие принимают нерегулярные, но вполне определенные конформаций (coil-участки). Полипептидная цепь, образующая белковую глобулу, свернута довольно сложным образом.
Домены.
В крупных белках при сворачивании полипептидной цепи часто образуются две или более пространственно разделенные области, называемые доменами. По своей структуре каждый домен напоминает отдельный небольшой белок. Обычно в одном домене содержится от 40 до 300 остатков. Все домены можно подразделить на четыре класса: α/α, ß/ß, α/ß и α+ß, в зависимости от взаимного расположения в цепи α-спиральных и ß-структурных участков.
П
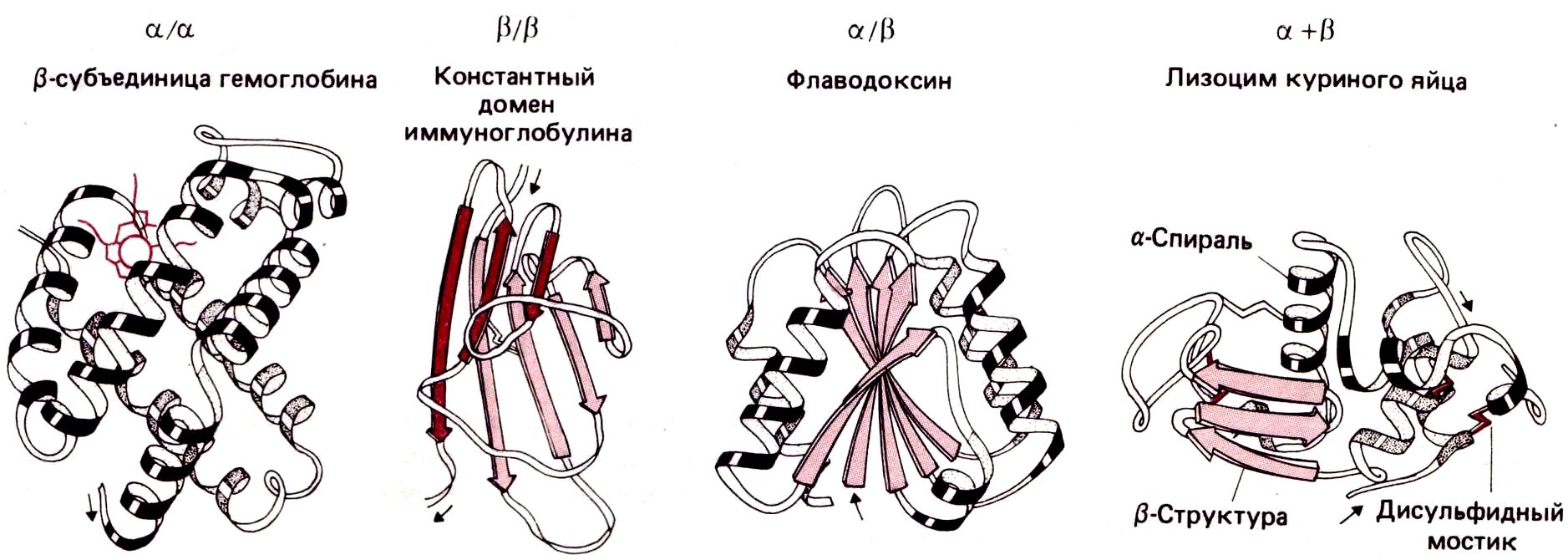 римеры
доменов каждого класса приведены на
рисунке;
полипептидная
цепь изображена в виде ленты, при этом
α-спиральные участки представлены
спиралями, ß-структурные — стрелками,
а нерегулярные — светлыми петлями.
Боковые цепи не показаны, хотя во всех
белках пространство между атомами
основной цепи заполнено атомами боковых
цепей.
римеры
доменов каждого класса приведены на
рисунке;
полипептидная
цепь изображена в виде ленты, при этом
α-спиральные участки представлены
спиралями, ß-структурные — стрелками,
а нерегулярные — светлыми петлями.
Боковые цепи не показаны, хотя во всех
белках пространство между атомами
основной цепи заполнено атомами боковых
цепей.
α/α-домены состоят в основном из α-спиралей, ß-участки в них практически отсутствуют. α-Спирали упакованы таким образом, что неполярные боковые цепи оказываются спрятанными внутрь.
В ß/ß-доменах имеется несколько ß-цепей и нет (или почти нет) α-спиралей. Этот класс доменов представлен на рисунке константным доменом молекулы иммуноглобулина, состоящим из двух упакованных вместе ß- слоев. На схеме видно, что ß-слои не плоские, а слегка скручены.
В α/ß-доменах α- и ß-участки чередуются вдоль цепи. Часто ß участки образуют параллельный ß-слой, окруженный α- спиралями.
В α+ß -доменах α- и ß-участки обычно располагаются в разных сегментах полипептидной цепи.
Белки – очень крупные молекулы, выполняющие в организме самые разнообразные функции. При этом непосредственно в выполнении функции участвует небольшой участок этой огромной молекулы – активный центр белка. Остальные участки необходимы для его формирования, или выполняют дополнительные функции (например – «заякоревание» белка в мембране). Чаще всего, активный центр формируется в щелях между доменами, и его формирование и доступность определяются правильной конфигурацией третичной структуры – нативной структурой белка.
Активный центр формируется при укладке третичной структуры, следовательно, белки-мультимеры имеют несколько активных центров (обычно – по числу цепей).
Компьютерная модель ренина – белка-регулятора давления крови (реальное соотношение и расположение атомов, а также схема образованных связей). На схеме связей синим цветом выделен активный центр ренина.

Внутренняя подвижность белков.
Из экспериментов известно, что белки не являются жесткими структурами: отдельные их части перемещаются друг относительно друга, что позволяет говорить о внутренней подвижности белков. Во многих глобулярных белках, атомы основной цепи способны смещаться на 0,01 нм относительно среднего положения, а боковые цепи, находящиеся на поверхности белковой глобулы, имеют еще большую подвижность.
Эксперименты по ренатурации показывают, что биологически активный белок после денатурации может самопроизвольно свернуться в исходную конформацию с восстановлением своей активности (если не была нарушена первичная структура!!!). Следовательно, при физиологических условиях состояние белка, имеющего нативную трехмерную структуру, термодинамически стабильно, т. е. соответствует минимуму свободной энергии. Более того, эти эксперименты говорят о том, что информация, необходимая для сворачивания белка в нативную конформацию, заложена в его аминокислотной последовательности (определяется первичной структурой).
Поэтому в принципе можно теоретически предсказать трехмерную структуру любого белка, исходя из его аминокислотной последовательности. Это было бы полезно в тех случаях, когда нельзя определить конформацию молекулы кристаллографическим методом. Хотя точность предсказания вторичной структуры белка теперь довольно высока, предсказание третичной структуры остается не до конца решенной проблемой молекулярной биологии.
Сворачивание молекулы белка (фолдинг) из развернутого состояния должно осуществляться либо одним, либо очень немногими путями. Пусть белковая молекула состоит из 50 остатков, каждый из которых может принимать 10 разных конформаций (как вы догадываетесь, в реальности конформаций неизмеримо больше – см. карту Рамачандрана) . Тогда общее число возможных конформаций составит 1050, и если характерное время молекулярных перестроек составляет 10-13с, то для того чтобы перепробовать все конформации хотя бы по одному разу, потребуется примерно 1037с (~1030лет). Эту цифру стоит соотнести со временем существования жизни на Земле – около 3,5•109.
Следовательно, должен существовать направленный путь сворачивания белка, ограничивающий этот перебор. Одно из предположений заключается в том, что начальные участки белковой молекулы, например α-спирали, формируемые в первую очередь, служат как бы центрами конденсации для остальных частей молекулы. Однако последние годы, стало очевидно, что за фолдинг белков отвечают особые белки – шапероны. Эта же группа белков отвечает за последующее поддержание стабильности нативной структуры.
Фибриллярные белки, имеют сильно вытянутую форму. Благодаря присущей этим белкам жесткости или эластичности они часто выполняют в живых организмах структурные функции. Конформацию полипептидной цепи большинства фибриллярных белков можно отнести к одному из трех типов регулярной вторичной структуры: к коллагеновой спирали, ß-слою, обнаруженному во многих разновидностях шелка, и к α-спиральной структуре, характерной для α-кератинов и тропомиозина. О некоторых особенностях их строения мы поговорим при обсуждении функций белков.
