
- •1Часть іі. Углеводороды
- •6.1. Номенклатура неразветвленных (линейных) алканов.
- •6.2. Изомерия алканов
- •6.3. Названия алкильных радикалов
- •6.4. Номенклатура разветвленных алканов.
- •6 .5. Получение алканов.
- •6.6. Физические свойства алканов.
- •6.7. Химические свойства алканов.
- •6.8. Циклоалканы.
- •7.1. Гомологический ряд, номенклатура, изомерия.
- •7.2. Методы получения.
- •8.1. Классификация и номенклатура.
- •8.2. Методы синтеза.
- •8.3. Химические свойства.
- •9.1. Гомологический ряд алкинов. Номенклатура.
- •9.2. Методы получения алкинов.
- •9.3. Химические свойства ацетиленов.
- •10.1. Введение.
- •10.2. Понятие об ароматичности.
- •10.3. Одноядерные арены. Гомологический ряд бензола.
- •11.1. Полиядерные арены с изолированными бензольными ядрами.
- •11.2. Конденсированные ароматические соединения.
9.1. Гомологический ряд алкинов. Номенклатура.
Алкины, содержащие одну тройную связь, составляют гомологический ряд ацетиленов с общей формулой СnH2n-2. Родоначальник ряда ацетилен НССН.
По номенклатуре ИЮПАК название алкина образуется по обычной схеме:
а
 лкан
алкин.
Главная углеродная цепь должна иметь
тройную связь, даже если она не самая
длинная. Нумерацию цепи, как обычно,
производят таким образом, чтобы локанты,
обозначающие положение кратных связей,
были наименьшими. По рациональной
номенклатуре алкины называют как
производные ацетилена:
лкан
алкин.
Главная углеродная цепь должна иметь
тройную связь, даже если она не самая
длинная. Нумерацию цепи, как обычно,
производят таким образом, чтобы локанты,
обозначающие положение кратных связей,
были наименьшими. По рациональной
номенклатуре алкины называют как
производные ацетилена:
трет-бутилметилацетилен,
4,4-диметилпентин-2.
9.2. Методы получения алкинов.
9.2.1. Карбидный метод.
Карбид кальция, взаимодействуя с водой, образует ацетилен:
СаС2 +2Н2О Са(ОН)2 + С2Н2 .
Карбид кальция получают нагреванием смеси кокса с негашеной известью в электропечах при 2500 оС:
СаО + 3С СаС2 + СО .
9.2.2.Пиролиз метана.
1500 оС
 2СН4
С2Н2
+ 3Н2
.
2СН4
С2Н2
+ 3Н2
.
9.2.3. Дегидрогалогенирование дигалогеналканов.
КОН(спирт)
С Н3СН=СН2 + Br2 СН3СНBrСН2Br СН3ССН .
-2KBr, -2H2O
9.2.4. Реакции алкилирования ацетиленидов металлов.
Ацетилениды металлов типа RCCNa легко взаимодействуют в алкилгалогенидами, образуя производные ацетилена. Примеры:
RCCNa + ClCH2R NaCl + RCCCH2R
NaCCNa + 2CH3Br 2NaBr + CH3CCCH3 .
9.3. Химические свойства ацетиленов.
Молекула ацетилена линейна, ибо степень гибридизации атома углерода в нем sp, атомы углерода связаны одной - и двумя взаимно перпендикулярными
-связями.
Сравним энергии связей СС в алканах, алкенах и алкинах:
Связь |
СС |
C=C |
CC |
Гибридизация |
sp3 |
sp2 |
sp |
Энергия связи, кДж/моль |
331 |
592 |
813 |
Энергия одной -связи, кДж/моль |
- |
261 |
241 |
Как видим, -связи в ацетилене слабее, чем в этилене, поэтому гидрирование винилацетилена и присоединение к нему НCl идет исключительно по тройной связи:
катализ
 СН2=СНССН
+ Н2
СН2=СНСН=СН2
(бутадиен-1,3),
СН2=СНССН
+ Н2
СН2=СНСН=СН2
(бутадиен-1,3),
СН2=СНССН + НCl СН2=СНСCl=СН2 (хлорпрен).
Что же касается СН ацетиленовой связи, то ее электроны сильнее притянуты к sp-гибрирдному, более электроотрицательному атому углерода, поэтому, с одной стороны, связь СН+ становится существенно поляризованной в сравнении с этиленом и этаном и способной отщеплять протон, что объясняет слабые кислотные свойства ацетилена и его однозамещенных гомологов RCCН. Но, с другой стороны, это же затрудняет отщепление одного электрона вместе с протоном в виде Н по радикальному механизму, поэтому замещение ацетиленового водорода (скажем, на галоген) по радикальному механизму невозможно.
Возникает вопрос о степени кислотности ацетилена и его однозамещенных гомологов. Например, имеет место реакция с амидом натрия:
RCСН+ + NaNH2 NH3 + RCСNa+ .
более сильная соль более более слабая соль более сильной
кислота слабой к-ты кислота кислоты
Но образовавшийся алкилацетиленид натрия реагирует с водой, образуя щелочь и алкин:
RCСNa + H2O RCСH + NaOH
более сильная более слабая
кислота кислота
Таким образом, имеет место ряд кислотности:
NH3 RCСН H2O.
Еще одна особенность соединений ряда ацетилена, характерная только для них, но не для алкенов, - это нуклеофильные реакции присоединения, правда, сопровождаемые в случае слабых нуклеофилов электрофильным катализом катионами Hg2+ , Cu+ и др. Для алкенов такой катализ не наблюдается.
Таким образом, вследствие особенностей тройной связи для алкинов характерны реакции присоединения по радикальному, электрофильному и нуклеофильному механизмам, окисления, полимеризации и замещения ацетиленового (кислого) атома водорода на металл.
И еще одну особенность необходимо отметить для ацетилена. Он термодинамически неустойчив и может взрываться от детонации, нагрева, искры и даже без всяких причин, особенно под давлением. Поэтому работа с ним требует особенной осторожности.
9.3.1.Реакции гидрирования.
Присоединение водорода происходит под действием катализаторов, причем, в зависимости от природы катализатора реакцию можно остановить на алкене:
Катализ Н2
RCСR + H2 RCН=СНR RCН2СН2R
9.3.2.Реакции электрофильного присоединения.
9.3.2.1. Реакции галогенирования.
 Механизм
аналогичен тому, который имеет место
для алкенов. Реакции протекают в две
стадии, различающиеся по скорости:
первая стадия быстрая, вторая – медленная.
При этом на первой стадии имеет место
анти-присоединение:
Механизм
аналогичен тому, который имеет место
для алкенов. Реакции протекают в две
стадии, различающиеся по скорости:
первая стадия быстрая, вторая – медленная.
При этом на первой стадии имеет место
анти-присоединение:
9.3.2.2. Присоединение галогенводородов (НBr, HCl и HJ).
 При взаимодействии с однозамещенными
алкинами присоединение происходит по
правилу Марковникова:
При взаимодействии с однозамещенными
алкинами присоединение происходит по
правилу Марковникова:
9.3.3.Реакции нуклеофильного присоединения.
Присоединение нуклеофильных реагентов (воды, спиртов, анионов карбоновых кислот) происходит в присутствии таких катализаторов, как соли меди Cu+ или ртути Hg2+. Роль катализатора сводится к образованию -комплекса, который активирует тройную связь. Присоединение происходит по правилу Марковникова.
9.3.3.1. Гидратация алкинов.
Н

 2С=СНОН
СН3СОН
(правило Ельтекова, уксусный альдегид)
2С=СНОН
СН3СОН
(правило Ельтекова, уксусный альдегид)
В случае гидратации монозамещенного алкина:
 ( +І )
( +І )
![]() 9.3.3.2. Присоединение спиртов (реакция
Фаворского-Шестаковского).
9.3.3.2. Присоединение спиртов (реакция
Фаворского-Шестаковского).
М еханизм
прост:
еханизм
прост:
В данном случае, когда присоединяется такой сильный нуклеофил, как алкоксид анион, катализ ионами металлов не требуется.
 При
присоединении к виниловому эфиру второй
молекулы спирта образуется ацеталь:
При
присоединении к виниловому эфиру второй
молекулы спирта образуется ацеталь:
ацеталь
9.3.3.3. Присоединение кислот.
Присоединение уксусной кислоты:
Hg2+
НССН + НОСОСН3 Н2С=СНОСОСН3 (винилацетат).
Образуется мономер винилацетат, который используется для получения ПВА (поливинилацетата).
При присоединении синильной кислоты получают другой важный винильный мономер – акрилонитрил:
Сu2+
НССН + НCN Н2С=СНCN
9.3.4. Ацетилениды металлов.
Как уже отмечалось, ацетиленовый водород достаточно кислый, чтобы замещаться на металл:
 НССН
+ 2 Ag(NH3)2OH
AgССAg
+ 2H2O
+ 4NH3
.
НССН
+ 2 Ag(NH3)2OH
AgССAg
+ 2H2O
+ 4NH3
.
Образование белого осадка ацетиленида серебра является качественной реакцией на ацетилен и его монозамещенные производные RССН. Качественной реакцией на те же вещества является также их взаимодействие с одновалентной медью в аммиачном растворе, выпадает красный осадок ацетиленида меди:
RССН + CuCl RССCu + HCl.
Ацетилен и его однозамещенные гомологи RССН в эфирном растворе образуют магнийорганические соединения:
СН3ССН + СН3MgI CH4 + СН3CCMgI.
Ацетилениды металлов вступают в реакцию нуклеофильного присоединения с формальдегидом (синтез Реппе):
I
 MgCCMgI
+ 2Н2С=О
IMgОСН2СССН2О
MgI
MgCCMgI
+ 2Н2С=О
IMgОСН2СССН2О
MgI
2Н2О (2Mg(OH)I)
НОСН2СССН2ОН.
Реакция с ацетоном уже рассматривалась в лекции № 8 (реакция Фаворского), реакция с углекислым газом идет по схеме:
Н2О (Mg(OH)I)
С
 Н3СCMgI
+ О=С=О
СН3СCСООMgI
Н3СCMgI
+ О=С=О
СН3СCСООMgI
СН3СCСООН (бутин-2-овая кислота)
9.3.5. Олигомеризация алкинов (олигос – мало).
9.3.5.1. Образование линейных продуктов.
Это реакция Ньюленда, катализируется она Сu2Cl2:
С2Н2
2 НССН НСССН=СН2 Н2С=СНСССН=СН2 (тример)
димер дивинилацетилен
9.3.5.2. Образование циклических продуктов.
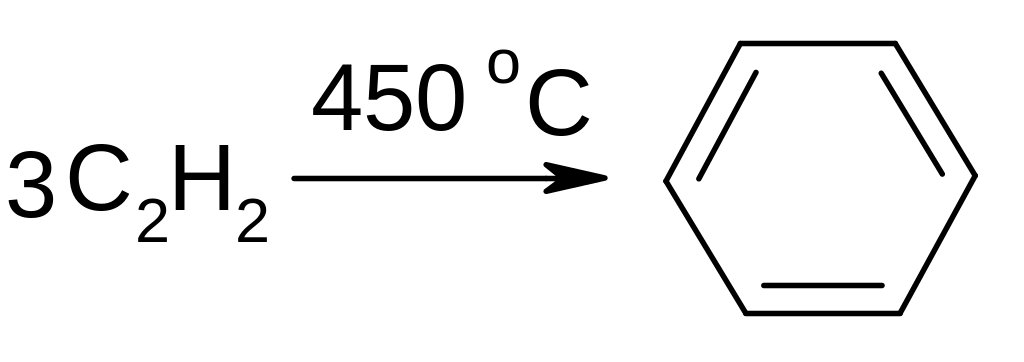 В
присутствии активированного угля
образуется бензен:
В
присутствии активированного угля
образуется бензен:
В присутствии дицианида никеля Ni(CN)2
происходит тетрамеризация ацетилена
с образованием циклооктатетраена-1,3,5,7:
присутствии дицианида никеля Ni(CN)2
происходит тетрамеризация ацетилена
с образованием циклооктатетраена-1,3,5,7:
9.3.6. Полимеризация ацетилена.
9.3.6.1. Радикальное инициирование.
n НССН (CH=CH)n (полупроводник полиен).
9.3.6.2. Окислительная полимеризация ацетилена.
В присутствии солей меди (І) и окислителей ацетилен полимеризуется с образованием полиацетилена – карбина:
n НССН Н(CC)nН или С=(С=С)n1=С (карбин).
Считают, что карбин является третьей аллотропной формой углерода наряду с алмазом и графитом. Карбину приписывают кумулированную структуру макромолекул.
Лекция № 10. АРЕНЫ
