
- •1Часть іі. Углеводороды
- •6.1. Номенклатура неразветвленных (линейных) алканов.
- •6.2. Изомерия алканов
- •6.3. Названия алкильных радикалов
- •6.4. Номенклатура разветвленных алканов.
- •6 .5. Получение алканов.
- •6.6. Физические свойства алканов.
- •6.7. Химические свойства алканов.
- •6.8. Циклоалканы.
- •7.1. Гомологический ряд, номенклатура, изомерия.
- •7.2. Методы получения.
- •8.1. Классификация и номенклатура.
- •8.2. Методы синтеза.
- •8.3. Химические свойства.
- •9.1. Гомологический ряд алкинов. Номенклатура.
- •9.2. Методы получения алкинов.
- •9.3. Химические свойства ацетиленов.
- •10.1. Введение.
- •10.2. Понятие об ароматичности.
- •10.3. Одноядерные арены. Гомологический ряд бензола.
- •11.1. Полиядерные арены с изолированными бензольными ядрами.
- •11.2. Конденсированные ароматические соединения.
8.1. Классификация и номенклатура.
Эти соединения с открытой углеродной цепью, содержащие две двойных связи, с общей формулой СnН2n – 2. По положению двойных связей диены делятся на кумулированные, сопряженные и изолированные. По номенклатуре ИЮПАК их названия образуются заменой окончания «ан» на «адиен». Нумерация цепи производится таким образом, чтобы локанты положения двойных связей имели наименьшие номера. Примеры.
Кумулированные диены:
СН2=С=СН2 – пропадиен (аллен),
СН3СН2СН=С=СНСН3 – гексадиен-2,3.
Сопряженные диены:
СН2=СНСН=СН2 – бутадиен-1,3 ,
СН2=С(СН3)СН=СН2 – изопрен или 2-метилбутадиен-1,3 ,
СН3СН=СНСН=СН2 – пентадиен-1,3.
Изолированные (не сопряженные) диены:
СН2=СНСН2СН=СН2 – пентадиен-1,4 ,
СН2=СНСН2СН2СН=СН2 – гексадиен-1,5.
Сопряженные диены имеют большое промышленное применение для получения каучуков.
8.2. Методы синтеза.
8.2.1. Дегидрирование бутана и изопентана.
Это каталитические реакции, идущие при нагревании:

8.2.2. Дегидратация спиртов
 Реакцию
дегидратации этанола по Лебедеву с
образованием бутадиена сейчас не
используют из-за дороговизны сырья, а
для получения изопрена сейчас используют
реакцию Фаворского, т.е. получение
непредельного спирта, который затем
превращают в изопрен:
Реакцию
дегидратации этанола по Лебедеву с
образованием бутадиена сейчас не
используют из-за дороговизны сырья, а
для получения изопрена сейчас используют
реакцию Фаворского, т.е. получение
непредельного спирта, который затем
превращают в изопрен:
8.2.2. Получение хлорпрена (катализ Cu2Cl2 ):
2 НССН Н2С=СНССН (винилацетилен)
Н 2С=СНССН + HCl Н2С=СНСCl=СН2 (хлорпрен или 2-хлорбутадиен-1,3)
8.3. Химические свойства.
8.3.1. Общая характеристика.
 Для
диенов наиболее характерны реакции
присоединения и полимеризации.
Кумулированные и несопряженные диены
по своим свойствам отличаются от
сопряженных диенов. Для кумулированных
и изолированных
диенов возможно только
1,2-присоединение:
Для
диенов наиболее характерны реакции
присоединения и полимеризации.
Кумулированные и несопряженные диены
по своим свойствам отличаются от
сопряженных диенов. Для кумулированных
и изолированных
диенов возможно только
1,2-присоединение:
 Для
сопряженных же диенов происходит
присоединение как в положение 1,2, так и
в положение 1,4:
Для
сопряженных же диенов происходит
присоединение как в положение 1,2, так и
в положение 1,4:
П![]() ричем,
сопряженные диены более реакционноспособны,
чем несопряженные вследствие сопряжения:
ричем,
сопряженные диены более реакционноспособны,
чем несопряженные вследствие сопряжения:
 Реакция
присоединения воды к аллену
(1,2-присоединение) в конечном итоге
приводит к образованию ацетона:
Реакция
присоединения воды к аллену
(1,2-присоединение) в конечном итоге
приводит к образованию ацетона:
Здесь выполняется правило Эльтекова: НО- группа при двойной связи не существует, ибо протон перемещается к соседнему атому углерода (явление кето-енольной таутомерии, причем, кетон устойчивее енола, о чем свидетельствует то обстоятельство, что в ацетоне содержится всего 0,0002 % енола).
В случае кумулированных диенов 1,3-присоединение невозможно, ибо здесь -связи не перекрываются (не сопряжены), поскольку взаимно перпендикулярны, так как начинаются на одном и том же общем атоме углерода.
8.3.2. Реакции сопряженных диенов.
8.3.2.1. Электрофильное присоединение (по Ингольду AE, по ИЮПАК
AE + АN).
По этому механизму идет реакция бромирования. При этом при – 80 оС образуется 80% 1,2-продукта и 20% 1,4-продукта присоединения (кинетический контроль), но уже при + 40 оС имеет место термодинамический контроль и образуется 20% продукта 1,2-присоединения и 80% продукта 1,4-присоединения.
Объяснить это обстоятельство можно различным состоянием при разных температурах, отличающихся на целых 120 оС, промежуточных ионов, образующихся и реагирующих по схеме:

При разных температурах имеют место и различные свободные энергии активации, соотношение между которыми можно объяснить при помощи энергетических диаграмм на стадии реакции промежуточного карбокатиона с противоанионом, показанных на следующей стрпнице.
Продукт присоединения 1,4 устойчивее, чем продукт присоединения 1,2, ибо в первом с двойной связью связано два заместителя, а во втором – один. При
t = – 80 оС энергия броуновского движения небольшая, и ее недостаточно, чтобы
образовавшаяся при присоединении бромид катиона в положение 1 ионная пара (см. раздел 5.5.2 в лекции № 5) диссоциировала на свободные ионы, и бромид анион может присоединиться преимущественно к ближайшему катионному центру в положении 2. Чтобы присоединиться к положению 4, анион должен преодолеть притяжение к этому центру, вследствие чего свободная энергия активации присоединения в положение 1,4 выше, а скорость ниже, чем в случае 1,2-присоединения. Последнего продукта образуется больше, а реакция является кинетически контролируемым процессом.
При + 40 оС кинетическая энергия броуновского движения достаточно большая, чтобы преодолеть притяжение катиона и аниона в ионной паре и она диссоциировала на свободные ионы, ничто не препятствует атаке аниона ни на 4-е, ни на 2-е положение, а свободная энергия переходного состояния на стадии

образования продуктов будет определяться, как и для конечных состояний, стабилизацией этих состояний за счет гиперконьюгации заместителей с образующейся двойной связью. Поэтому благодаря принципу Хеммонда (см. раздел 6.7.1.1 и рис. 6.1) имеет место соответствие между свободной энергией активации и свободной энергией реакции: чем экзотермичнее реакция (чем ниже G), тем реагентоподобнее переходное состояние (и меньше G). Другими словами, поскольку G14 G12, то и G14 G12, и процесс фактически является термодинамически контролируемым.
8.3.2.2. Радикальное присоединение галогенов.
При освещении или в присутствии инициаторов (пероксид ацетила) идет радикальное присоединение AR:

Поскольку радикалы не заряжены и отсутствует всякое электростатическое взаимодействие, энергия активации на второй стадии (взаимодействие промежуточного радикала с Cl2) небольшая, играет роль только термодинамический контроль, вследствие чего преобладает более стабильный продукт присоединения 1,4.
8.3.3. Присоединение галогеноводородов.
Схема присоединения:
 СН3СНХСН=СН2
(1,2-присоединение)
СН3СНХСН=СН2
(1,2-присоединение)
Н Х
+ СН2=СНСН=СН2
Х
+ СН2=СНСН=СН2
СН3СН=СНСН2Х (1,4-присоединение).
Механизм может быть как AdE, так и AdR, поэтому наблюдается та же картина, что и при присоединении галогенов.
8.3.4. Диеновый синтез (реакция Дильса-Альдера).
 Это
одностадийная реакция циклоприсоединения
сопряженных алкадиенов по положениям
1,4 к производным алкенов или алкинов с
образованием циклических соединений.
Такие производные алкенов или алкинов
называются диенофилами. Сам этилен
является слабым диенофилом, поэтому
реакция с его участием происходит в
жестких условиях. Введение
электроноакцепторных заместителей в
диенофил приводит к существенному
увеличению скорости реакции:
Это
одностадийная реакция циклоприсоединения
сопряженных алкадиенов по положениям
1,4 к производным алкенов или алкинов с
образованием циклических соединений.
Такие производные алкенов или алкинов
называются диенофилами. Сам этилен
является слабым диенофилом, поэтому
реакция с его участием происходит в
жестких условиях. Введение
электроноакцепторных заместителей в
диенофил приводит к существенному
увеличению скорости реакции:
г де
Х: NO2,
CN,
COOH
и др. Наиболее активным диенофилом
является тетрацианэтилен и малеиновый
ангидрид. Уравнение реакция с участием
малеинового ангидрида (кипячение в
бензоле):
де
Х: NO2,
CN,
COOH
и др. Наиболее активным диенофилом
является тетрацианэтилен и малеиновый
ангидрид. Уравнение реакция с участием
малеинового ангидрида (кипячение в
бензоле):
Эта реакция используется для количественного определения диенов, поскольку образующийся ангидрид 1,2,3,6-тетрагидрофталевой кислоты выделяется практически с количественным выходом и имеет индивидуальную температуру плавления.
8.3.5. Реакции полимеризации.
8.3.5.1. Природный каучук.
Природный каучук образуется в растениях путем полимеризации изопрена: существует два вида природного каучука.
 Гуттаперча
– смола гуттаперчевого дерева –
натуральный полимер изопрена исключительно
транс-струкутры:
Гуттаперча
– смола гуттаперчевого дерева –
натуральный полимер изопрена исключительно
транс-струкутры:
 Латекс,
выделяющийся из коры деревьев южного
полушария, представляет водную суспензию
полимера изопрена с цис-структурой
(натуральный каучук):
Латекс,
выделяющийся из коры деревьев южного
полушария, представляет водную суспензию
полимера изопрена с цис-структурой
(натуральный каучук):
8.3.5.2. Искусственный, синтетический каучук.
Этот каучук получают в промышленности полимеризацией диенов. Полимеризация диенов отличается от полимеризации алкенов тем, что в первом случае образуется продукт с большим числом изолированных двойных связей, а во втором – алкан.
 Полимеризация
осуществляется по радикальному и ионному
механизмам. При полимеризации диенов
предпочтительно образуется продукт
1,4-присоединения. Общая схема реакции:
Полимеризация
осуществляется по радикальному и ионному
механизмам. При полимеризации диенов
предпочтительно образуется продукт
1,4-присоединения. Общая схема реакции:
В промышленности полимеризацию диенов
инициируют органическими пероксидами,
щелочными металлами или металлоорганическими
соединениями типа катализатора
Циглера-Натта.
промышленности полимеризацию диенов
инициируют органическими пероксидами,
щелочными металлами или металлоорганическими
соединениями типа катализатора
Циглера-Натта.
Реакция полимеризации изопрена:
продолжение полимеризации
П о
причине большей стабильности третичного
радикала (І) (или аналогичного карбокатиона
при ионной полимеризации) по сравнению
со вторичным (ІІ) и большей стерической
доступности крайней группы СН2
полимеризация здесь идет по типу “голова
к хвосту”:
о
причине большей стабильности третичного
радикала (І) (или аналогичного карбокатиона
при ионной полимеризации) по сравнению
со вторичным (ІІ) и большей стерической
доступности крайней группы СН2
полимеризация здесь идет по типу “голова
к хвосту”:
Основные виды каучуков:
Бутадиеновые каучуки – продукты полимеризации бутадиена в присутствии пероксидных инициаторов или катализаторов анионной полимеризации. Это каучуки общего назначения.
Изопреновый каучук получают полимеризацией изопрена в присутствии катализатора Циглера-Натта. Их строение стереорегулярно, это цис-полиизопрен-1,4. По своим качествам этот изопреновый каучук не уступает натуральному.
Хлорпреновый каучук (неопрен) получают радикальной полимеризацией хлорпрена:
n CH2=CClCH=CH2 (CH2CCl=CHCH2)n
Хлорпреновый каучук находит широкое применение благодаря устойчивости к органическим растворителям и к кислороду воздуха для изготовления мягких водопроводных и лабораторных шлангов и в других случаях, когда необходимы устойчивые к маслам и к бензину каучуки.
Большое практическое значение имеют сополимеры алкадиенов-1,3 с различными винильными мономерами: стирола (С6Н5СН=СН2), акрилонитрила (СН2=СНСN).
8.3.5.3. Вулканизация каучука.
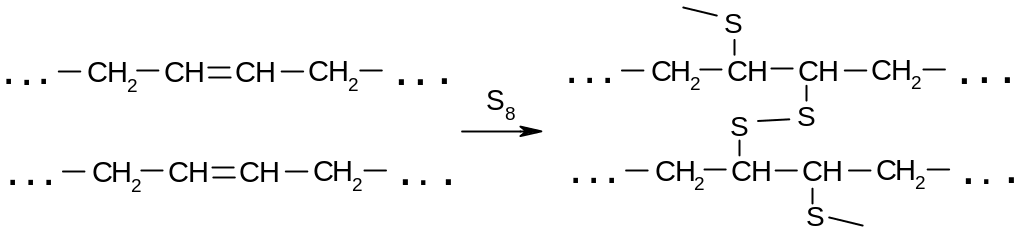 Вулканизацию
(превращение в резину), как правило,
осуществляют при помощи серы или других
соединений (пероксидов, азосоединений
и др.). Суть вулканизации состоит в
образовании мостиковых (поперечных)
связей между полимерными макромолекулами:
Вулканизацию
(превращение в резину), как правило,
осуществляют при помощи серы или других
соединений (пероксидов, азосоединений
и др.). Суть вулканизации состоит в
образовании мостиковых (поперечных)
связей между полимерными макромолекулами:
Резины, в отличие от каучуков, не растворяются в органических растворителях, проявляют меньшую эластичность и большую механическую прочность.
Часть ІІ. УГЛЕВОДОРОДЫ
Лекция № 9. АЛКИНЫ
