
- •1Часть іі. Углеводороды
- •6.1. Номенклатура неразветвленных (линейных) алканов.
- •6.2. Изомерия алканов
- •6.3. Названия алкильных радикалов
- •6.4. Номенклатура разветвленных алканов.
- •6 .5. Получение алканов.
- •6.6. Физические свойства алканов.
- •6.7. Химические свойства алканов.
- •6.8. Циклоалканы.
- •7.1. Гомологический ряд, номенклатура, изомерия.
- •7.2. Методы получения.
- •8.1. Классификация и номенклатура.
- •8.2. Методы синтеза.
- •8.3. Химические свойства.
- •9.1. Гомологический ряд алкинов. Номенклатура.
- •9.2. Методы получения алкинов.
- •9.3. Химические свойства ацетиленов.
- •10.1. Введение.
- •10.2. Понятие об ароматичности.
- •10.3. Одноядерные арены. Гомологический ряд бензола.
- •11.1. Полиядерные арены с изолированными бензольными ядрами.
- •11.2. Конденсированные ароматические соединения.
7.1. Гомологический ряд, номенклатура, изомерия.
Непредельные соединения с одной двойной связью составляют гомологический ряд этилена с общей формулой CnH2n (как и у циклоалканов), родоначальником ряда является этилен С2Н4 , особенности строения которого уже рассмотрены в лекции № 2. Алкены еще называют олефинами, номенклатура их рассмотрена в лекции № 3, необходимо лишь подчеркнуть, что главная углеродная цепь должна иметь двойную связь, даже если эта цепочка не самая длинная.
Пространственная изомерия алкенов (-диастереомерия или геометрическая изомерия) рассмотрена в лекции № 4. Здесь же необходимо отметить, что геометричесская изомерия (или цис- и транс-изомерия) появляется уже для одного из трех структурных изомеров бутена, а именно для бутена-2:
К
 ак
все диастереомеры, геометрические
изомеры имеют различные физические и
химические свойства. Так, температуры
плавления и кипения (физические свойства)
транс- и цис-бутена-2 различны, что же
касается химических свойств, то при
нагревании (облучении) цис-изомеры, как
менее устойчивые вследствие стерического
отталкивания алкильных заместителей,
изомеризуются в более устойчивые
транс-изомеры:
ак
все диастереомеры, геометрические
изомеры имеют различные физические и
химические свойства. Так, температуры
плавления и кипения (физические свойства)
транс- и цис-бутена-2 различны, что же
касается химических свойств, то при
нагревании (облучении) цис-изомеры, как
менее устойчивые вследствие стерического
отталкивания алкильных заместителей,
изомеризуются в более устойчивые
транс-изомеры:
Цис- и транс- изомеры алкенов оптически неактивны, ибо имеют плоское строение, т.е. имеют в качестве элемента симметрии плоскость симметрии.
7.2. Методы получения.
7.2.1. Дегидрогенизация алканов (рассмотрена в свойствах алканов).
7.2.2. Дегидратация спиртов.
В газовой фазе спирты дегидратируют в присутствии Al2O3 (катализатор), в жидкой в присутствии концентрированной H2SO4 :
Al2O3, 350 oC
 RCH2CH2OH
RCH=CH2
+ H2O,
RCH2CH2OH
RCH=CH2
+ H2O,
95% H2SO4, 170 oC
 CH3CH2OH
CH2=CH2
+ H2O.
CH3CH2OH
CH2=CH2
+ H2O.
 Легче
всего дегидратируют третичные спирты:
Легче
всего дегидратируют третичные спирты:
7.2.3. Отщепление галогенводородов от алкилгалогенидов.
Под действием спиртового раствора щелочи идет элиминирование галогенводорода, например:
КОН, спирт
 (СН3)2СНСН2Cl (СН3)2С=СН2
(СН3)2СНСН2Cl (СН3)2С=СН2
- HCl
 7.2.4.
Отщепление 2-х атомов галогенов цинком
от 1,2-дигалогеналканов:
7.2.4.
Отщепление 2-х атомов галогенов цинком
от 1,2-дигалогеналканов:
7.3 Химические свойства.
- Связи в алкенах слабее -связи, -электроны легко поляризуются и отдаются, поэтому алкены легко вступают в реакции присоединения (механизмы AR и AE). И вообще, алкенам присуща высокая реакционная способность: кроме реакций присоединения, алкены вступают в реакции окисления, полимеризации, в определенных условиях возможны реакции замещения в -положение по отношению к двойной связи.
7.3.1. Реакции гидрирования.
Гидрирование молекулярным водородом происходит в присутствии катализаторов (чаще всего металлы Pt, Pd, Ni):
СН2=СН2 + Н2 СН3СН3
7.3.2. Реакции галогенирования.
Галогены легко присоединяются к двойной связи:
Х2 + RCH=CHR’ RCHXCHXR’ .
C реакционной способностью здесь те же проблемы, что и в случае галогенирования алканов, фтор реагирует со взрывом и с деструкцией алкенов вплоть до сажи, иодирование идет очень медленно и с образованием неустойчивых продуктов, хлор реагирует менее энергично, чем фтор, образуются только продукты присоединения, но при освещении реакция идет со взрывом, что свидетельствует о цепном радикальном механизме. Бром реагирует медленнее хлора, но достаточно быстро, чтобы его реакция в четыреххлористом углероде была качественной на алкен, но в ряде случаев требуется нагревание.
Вследствие того, что связь BrBr слабее, чем связь ClCl, и намного легче поляризуется, для него становится характерным электорофильный механизм присоединения. Что же касается хлора, то для него характерен радикальный механизм. По мнению ряда исследователей можно создать условия, при которых хлорирование олефинов будет идти по електрофильному механизму (AE), а бромирование по радикальному (AR).
С хема
механизма электрофильного присоединения
брома по двойной связи:
хема
механизма электрофильного присоединения
брома по двойной связи:
 В
-комплексе
(КПЗ) происходит поляризация связи BrBr
и частичный перенос зарядов (отсюда
название – КПЗ: комплекс с переносом
заряда). Присоединение бромид-аниона
на второй стадии происходит в
анти-положение, т.е. с противоположной
стороны по отношению к уже присоединившемуся
катиону Br+.
Поэтому реакция стереоспецифична: из
цис-бутена-2 образуются энантиомеры, из
транс-бутена-2 – мезоформа:
В
-комплексе
(КПЗ) происходит поляризация связи BrBr
и частичный перенос зарядов (отсюда
название – КПЗ: комплекс с переносом
заряда). Присоединение бромид-аниона
на второй стадии происходит в
анти-положение, т.е. с противоположной
стороны по отношению к уже присоединившемуся
катиону Br+.
Поэтому реакция стереоспецифична: из
цис-бутена-2 образуются энантиомеры, из
транс-бутена-2 – мезоформа:
То обстоятельство, что реакция при AE механизме (AE + AN) двухстадийна, подтверждается образованием побочного продукта – бромгидрина за счет присоединения воды к промежуточному карбокатиону:
B rCH2CH2+ + H2O Н+ + BrCH2CH2ОН (бромгидрин, бромоспирт)
При радикальном механизме стереоспецифичность отсутствует, поскольку атака молекулы галогена на плоский промежуточный карборадикал равновероятна с обеих сторон, при этом всегда образуется рацемическая смесь.
7.3.3. Реакции присоединения галогенводородов НХ.
7.3.3.1. Реакции в отсутствие перекисных соединений.
![]() Механизм
реакции электрофильный (AE
или AE
+ AN):
Механизм
реакции электрофильный (AE
или AE
+ AN):
По активности галогенводороды располагаются в ряд:
HJ HBr HCl HF (cовпадает с рядом кислотности).
Для несимметричных алканов присоединение НХ происходит по правилу Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода. Причиной является все тот же гиперконьюгационный (в дополнение к индуктивному) эффект. Механизм:
![]() Присоединение происходит
против правила Марковникова, если вместо
алкильного радикала в алкене стоит
электроноакцепторная группа (CCl3,
CF3,
NC,
O2N),
проявляющая I
или М
эффекты. Например:
Присоединение происходит
против правила Марковникова, если вместо
алкильного радикала в алкене стоит
электроноакцепторная группа (CCl3,
CF3,
NC,
O2N),
проявляющая I
или М
эффекты. Например:
![]() +
+
+
+
+
+
7.3.3.2. Перекисный эффект Хараша.
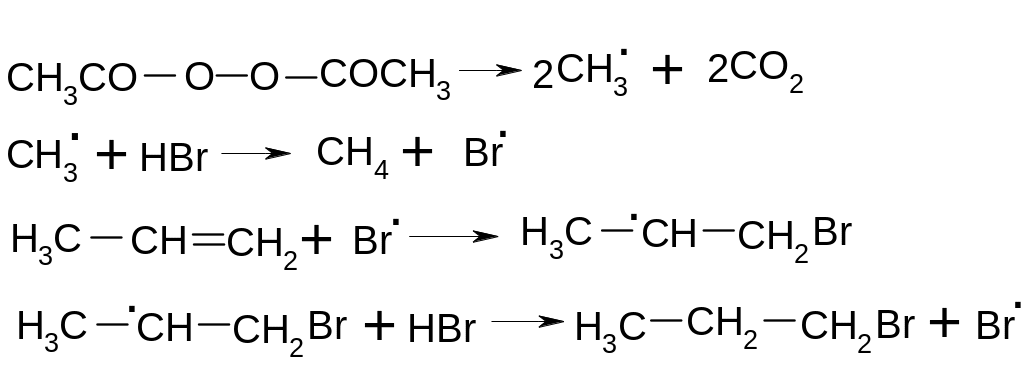 Если
в случае реакции с участием НBr в
реакционную среду добавить перекись
(например, перекись ацетила СН3СОООСОСН3),
то присоединение идет против правила
Марковникова, поскольку электрофильный
механизм меняется на радикальный (AdR):
Если
в случае реакции с участием НBr в
реакционную среду добавить перекись
(например, перекись ацетила СН3СОООСОСН3),
то присоединение идет против правила
Марковникова, поскольку электрофильный
механизм меняется на радикальный (AdR):
Вторичный радикал СН3СНСН2Br стабильнее первичного СН3СНBr СН2 вследствие той же гиперконьюгации.
7.3.4. Реакции присоединения воды.
Присоединение воды к олефинам идет в кислой среде, например в присутствии Н2SО4. Механизм AdE / AE + AN:

7.3.5. Реакции окисления перманганатом.
 При
окислении алкенов разбавленным водным
раствором KMnO4 в
слабощелочной среде образуются гликоли
(диолы, реакция Вагнера). Механизм:
При
окислении алкенов разбавленным водным
раствором KMnO4 в
слабощелочной среде образуются гликоли
(диолы, реакция Вагнера). Механизм:
При окислении алкена концентрированным раствором KMnO4 в жестких условиях при нагревании в кислой среде происходит разрыв двойной связи с образованием кетонов и (или) карбоновых кислот:
[O]
R 2C=CHR RCOR + RCOOH
Эта реакция, как и следующая реакция озонирования, используется для установления строения алкена и положения двойной связи в нем.
7.3.6. Реакции озонирования.
Реакция протекает мягче и более однородно, чем при применении других окислителей, поэтому ее применяют для определения строения алкенов:
Е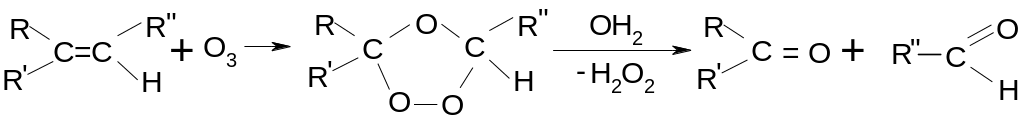 сли
атом углерода при двойной связи связан
с двумя радикалами – образуется кетон,
если с одним – альдегид, если конечная
группа СН2
– образуется формальдегид.
сли
атом углерода при двойной связи связан
с двумя радикалами – образуется кетон,
если с одним – альдегид, если конечная
группа СН2
– образуется формальдегид.
7.3.7. Реакции присоединения формальдегида.
Эта реакция (реакция Принса) происходит в кислой среде:
Н2С=О + Н+ +СН2ОН
С Н3+СН=СН2 + +СН2ОН СН3+СНСН2СН2ОН
Н

 СН2=СНСН2СН2ОН
Н2О
+ СН2=СНСН=СН2
(бутадиен)
СН2=СНСН2СН2ОН
Н2О
+ СН2=СНСН=СН2
(бутадиен)
+ НО
СН3СН(ОН)СН2СН2ОН
![]() + Н2СО
- Н
+ Н2СО
- Н
 +СН2ОСН(СН3)СН2СН2ОН
4-метилдиоксан-1,3
+СН2ОСН(СН3)СН2СН2ОН
4-метилдиоксан-1,3
В кислой среде отщепление воды от первых двух продуктов, а от третьего и воды и формальдегида, приводит к образованию бутадиена, исходного мономера для получения бутадиенового каучука.
7.3.8. Реакции замещения в аллильное положение: галогенирование.
При температуре 500 оС пропилен хлорируется в аллильное положение с образованием хлористого аллила (реакция Львова):
СН3СН=СН2 + Cl2 HCl + ClСН2СН=СН2 .
Механизм:
Cl2 2 Cl
 Cl
+ СН3СН=СН2
НCl + СН2СН=СН2
СН2=СНСН2
Cl
+ СН3СН=СН2
НCl + СН2СН=СН2
СН2=СНСН2
СН2=СНСН2 + Cl2 СН2=СНСН2Cl + Cl
Образующийся аллильный радикал стабилизирован сопряжением с -связью в отличие от радикала, который образуется при присоединении Cl к двойной связи:
 Cl
+ СН3СН=СН2
СН3СНСН2Cl
Cl
+ СН3СН=СН2
СН3СНСН2Cl
Этот радикал очень нестабилен и сразу распадается на исходные частицы.
В более мягких условиях бромирование (SR) в аллильное положение можно осуществить при помощи N-бромсукцинимида:

7.3.9. Реакции полимеризации.
При определенных условиях молекулы алкенов присоединяются одна к другой по -связи с образованием полимеров (поли – многочисленный). В качестве мономеров для получения полимеров используют в промышленности этилен, пропилен и изобутилен. Образующиеся полимерные молекулы имеют молекулярный вес от 10 000 до 100 000 и выше. Общее уравнение реакции:
nCН2=СН2 [CН2СН2]n (полиэтилен),
где n – степень полимеризации или число остатков молекул мономера в молекуле полимера. Для осуществления этих процессов используют высокое давление, нагревание и различные инициаторы.
Как все цепные реакции, процессы полимеризации состоят из 3 стадий:
инициирование (зарождение) цепи,
развитие цепи,
обрыв цепи.
Механизмы полимеризации – радикальный и ионный, чаще всего катионный. Инициаторы радикальной полимеризации: пары активных металлов (Na), кислород воздуха (ОО), пероксиды (например, пероксид ацетила). Катализаторы (инициаторы) катионной полимеризации – кислоты Льюиса (AlCl3, BF3 и т.д.). Пример радикальной полимеризации:
N a + СН2=СН2 NaСН2СН2 (зарождение цепи)
+(n – 2)CН2=СН2
N
 aСН2СН2
+ СН2=СН2
NaСН2СН2СН2СН2
aСН2СН2
+ СН2=СН2
NaСН2СН2СН2СН2
Na, обрыв цепи
Na(СН2СН2)n -1СН2СН2 Na(СН2СН2)n Na.
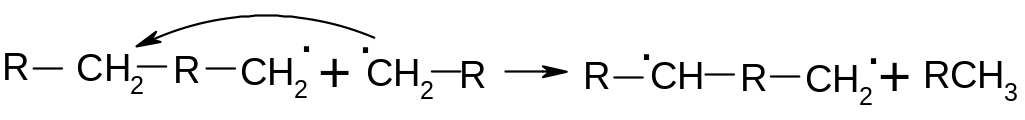 Один
радикал может отрывать водород от
другого, образуя при єтом бирадикал:
Один
радикал может отрывать водород от
другого, образуя при єтом бирадикал:
О бразование
таких бирадикалов приводит к разветвлению
цепи. Катионная полимеризация происходит
с образованием промежуточных карбокатионов,
которые стабилизируются гиперконьюгацией,
причем, третичный катион сильнее
стабилизируется, чем первичный:
бразование
таких бирадикалов приводит к разветвлению
цепи. Катионная полимеризация происходит
с образованием промежуточных карбокатионов,
которые стабилизируются гиперконьюгацией,
причем, третичный катион сильнее
стабилизируется, чем первичный:
Полимеры, получаемые этими методами, имеют недостатки:
1. Они являются частично разветвленными, что обуславливает их плохие
механические качества.
2. Плохие механические качества обуславливаются также стереонерегулярным
 (атактическим) строением полимера,
образующегося, например, из пропилена:
(атактическим) строением полимера,
образующегося, например, из пропилена:
В полипропилене симметричные и асимметричные атомы углерода чередуются, причем, конфигурация асимметричных центров случайная, что и обуславливает атактический характер строения этого полимера, полученного традиционным способом
С 1953 года стали применять катализатор Циглера-Натта, который намного повысил качество получаемых полимеров. В катализатор Циглера-Натта входит триэтилалюминий и TiCl4. В результате их взаимодействия образуется действующее начало:
A l(C2H5)3 + 3 TiCl4 AlCl3 + 3C2H5TiCl3 (этилтрихлортитан).
Это соединение образует -комплекс с алкеном, который затем превращается в -соединение:

Таким образом, благодаря образованию -комплекса с очередной молекулой этилена образуются исключительно линейные молекулы полимера.
Из пропилена при всех способах полимеризации раньше получался только атактический полимер. Однако, расположение метильных групп в полипропилене может быть и стереорегулярным, причем, возможны две конфигурации – изотактическая (метильные группы только с одной стороны) и синдиотактическая (метильные группы поочередно переходят с одной стороны молекулы на другую):
 изотактическая конфигурация,
изотактическая конфигурация,
 синдиотактическая конфигурация.
синдиотактическая конфигурация.
Катализатор Циглера-Натта позволяет получать как стереорегулярные, так и атактические полимеры. Если катализатор нанесен на кристаллическое вещество-носитель, получается изотактический полимер, если носитель – аморфное вещество, получается атактический, но не разветвленный полимер.
Изотактический полимер представляет собой кристаллическое высоко плавящееся вещество, из которого делают высоко прочные волокна, тогда как атактический полимер плавится на 200 оС при более низкой температуре, чем изотактический. Причина такого различия свойств – более плотная упаковка молекул изотактического полимера, которые к тому же закручены в спираль.
Лекция № 8. АЛКАДИЕНЫ
