
- •1Часть іі. Углеводороды
- •6.1. Номенклатура неразветвленных (линейных) алканов.
- •6.2. Изомерия алканов
- •6.3. Названия алкильных радикалов
- •6.4. Номенклатура разветвленных алканов.
- •6 .5. Получение алканов.
- •6.6. Физические свойства алканов.
- •6.7. Химические свойства алканов.
- •6.8. Циклоалканы.
- •7.1. Гомологический ряд, номенклатура, изомерия.
- •7.2. Методы получения.
- •8.1. Классификация и номенклатура.
- •8.2. Методы синтеза.
- •8.3. Химические свойства.
- •9.1. Гомологический ряд алкинов. Номенклатура.
- •9.2. Методы получения алкинов.
- •9.3. Химические свойства ацетиленов.
- •10.1. Введение.
- •10.2. Понятие об ароматичности.
- •10.3. Одноядерные арены. Гомологический ряд бензола.
- •11.1. Полиядерные арены с изолированными бензольными ядрами.
- •11.2. Конденсированные ароматические соединения.
11.2. Конденсированные ароматические соединения.
11.2.1. Общие представления о строении и свойствах.
К онденсированные
арены – это те, в молекулах которых
циклы имеют общие атомы углерода,
например:
онденсированные
арены – это те, в молекулах которых
циклы имеют общие атомы углерода,
например:
нафтален антрацен фенантрен
Для обозначения положения используют также греческие буквы. В нафталине - это положения 1,4,5 и 8, - положения 2,3,6 и 7. В антрацене - это положения 1,4,5 и 8, - положения 2,3,6 и 7, - это положения 9 и10.
 Все
они имеют ароматические свойства, т.е.
стабилизированы за счет резонанса.
Сравним энергию резонанса бензола и 3
указанных выше аренов:
Все
они имеют ароматические свойства, т.е.
стабилизированы за счет резонанса.
Сравним энергию резонанса бензола и 3
указанных выше аренов:
Энергия резонанса кДж/моль 152 255 352 387
Энергия резонанса на 1 цикл 152 127,5 117,3 129
Число резонансных структур на 1 цикл 2 1,5 1,33 1,66
Р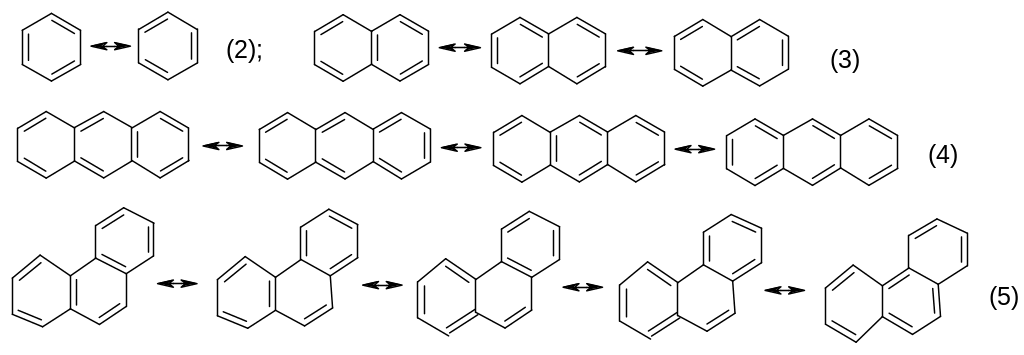 езонансные
структуры:
езонансные
структуры:
Как энергия резонанса, так и количество резонансных структур на 1 кольцо свидетельствуют, что в приведенном ряду наибольшей ароматичностью обладает бензол, при переходе к фенантрену ароматичность понижается, еще меньшая ароматичность наблюдается у нафталина, тогда как наименьшей ароматичностью обладает антрацен.
11.2.2. Методы получения.
В промышленности конденсированные арены выделяют из каменноугольной смолы. Лабораторных методов синтеза много. В качестве примера можно привести несколько:
 11.2.2.1.
Получение нафталена конденсацией
бензола с ацетиленом в металлических
трубках при нагревании:
11.2.2.1.
Получение нафталена конденсацией
бензола с ацетиленом в металлических
трубках при нагревании:
 11.2.2.2.
Получение антрацена алкилированием по
Фриделю-Крафтсу:
11.2.2.2.
Получение антрацена алкилированием по
Фриделю-Крафтсу:
 11.2.2.3.
Получение фенантрена реакцией
дегидрогенизации:
11.2.2.3.
Получение фенантрена реакцией
дегидрогенизации:
11.2.3. Химические свойства.
Поскольку конденсированные арены менее ароматичны, они легче вступают в реакцию присоединения, чем бензол. В случае нафталина, поскольку кольца имеют заметную диеновую структуру, присоединение идет в положение 1,4. В случае антрацена и фенантрена крайние кольца по структуре напоминают бензол, поэтому к ним присоединение не происходит, наименее устойчивым является среднее кольцо. В случае антрацена это кольцо имеет диеновую структуру, поэтому присоединение здесь идет в положения 9,10 (по сути в п-положение). В случае фенантрена среднее кольцо в положениях 9,10 напоминает этилен, поэтому присоединение здесь тоже идет в положение 9,10.
11.2.3.1. Реакции гидрирования.
 Для
гидрирования фенантрена, как наиболее
ароматичного, требуется катализатор:
Для
гидрирования фенантрена, как наиболее
ароматичного, требуется катализатор:
9,10-дигидрофенантрен
Для нафталена и антрацена, наименее ароматичных соединений, гидрирование происходит легко, без катализа, с участием атомарного водорода:
 1,4-дигидронафтален
1,4-дигидронафтален
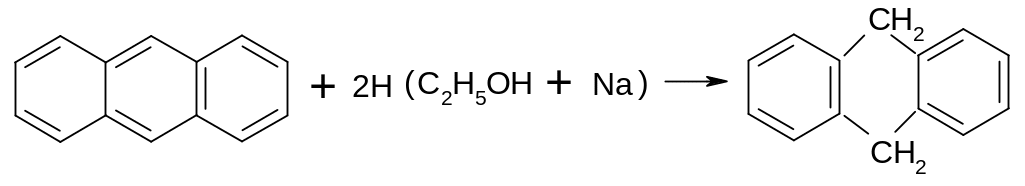 9,10-дигидроантрацен
9,10-дигидроантрацен
 В
жестких условиях (катализ и нагревание)
происходит полное гидрирование,
вследствие чего образуются:
В
жестких условиях (катализ и нагревание)
происходит полное гидрирование,
вследствие чего образуются:
Декагидронафтален (декалин) пергидрофенантрен
11.2.3.2. Реакции галогенирования.
 Реакции
идут без электрофильного катализа, т.е.
легче, чем в случае бензола, причем,
осуществляется механизм
присоединения-отщепления:
Реакции
идут без электрофильного катализа, т.е.
легче, чем в случае бензола, причем,
осуществляется механизм
присоединения-отщепления:
11.2.3.3. Реакции окисления.
 При
окислении хромовой смесью (K2Cr2O7
+ H2SO4)
образуются хиноны – из нафталена –
1,4-нафтохинон, из антрацена –
9,10-антрахинон, из фенантрена –
9,10-фенантренхинон:
При
окислении хромовой смесью (K2Cr2O7
+ H2SO4)
образуются хиноны – из нафталена –
1,4-нафтохинон, из антрацена –
9,10-антрахинон, из фенантрена –
9,10-фенантренхинон:
При окислении 2-метилнафталена образуется 2-метилнафтохинон (витамин К3):

11.2.3.4. Реакции электрофильного замещения.
 11.2.3.4.1.
Нитрование нафталена.
11.2.3.4.1.
Нитрование нафталена.
З амещение
идет в основном в -положение,
поскольку образующийся -комплекс
в этом случае более стабилен, чем при
замещении в -положение:
амещение
идет в основном в -положение,
поскольку образующийся -комплекс
в этом случае более стабилен, чем при
замещении в -положение:
 Реакции
электрофильного замещения в нафтален
идут легче, чем в бензен, поскольку
кольца в нафталене слегка напоминают
диен. Здесь -положения
более реакционноспособны, чем ,
вследствие сопряжения:
Реакции
электрофильного замещения в нафтален
идут легче, чем в бензен, поскольку
кольца в нафталене слегка напоминают
диен. Здесь -положения
более реакционноспособны, чем ,
вследствие сопряжения:
Нитрогруппа, как и любой акцептор, дезактивирует первое кольцо, поэтому введение второй нитрогруппы происходит во второе в более жестких условиях в основном в -положение, т.е. в 5 или 8, по указанной выше причине..
11.2.3.4.1. Сульфирование нафталена.
 Реакции
сульфирования в отличие от нитрования
обратимы, при этом в зависимости от
температуры образуется или
-нафталенсульфокислота
(А), или -
нафталенсульфокислота (В):
Реакции
сульфирования в отличие от нитрования
обратимы, при этом в зависимости от
температуры образуется или
-нафталенсульфокислота
(А), или -
нафталенсульфокислота (В):
Реакция обратима, потому что атом серы (в отличие от азота нитрогруппы) с кольцом не сопрягается (у нее большой радиус и соответствующие орбитали серы и углерода кольца при боковом перекрывании практически не взаимодействуют (не перекрываются)), вследствие чего нитронафтален (и нитробензен) термодинамически намного стабильнее, чем сульфокислоты. Поэтому нитрование практически необратимо, тогда как сульфирование обратимо. Диаграмма изменения энергии системы при сульфировании представлена на следующей странице.

П ри
этом необходимо учитывать, что
-нафталенсульфоновая
кислота термодинамически менее устойчива,
чем -нафталенсульфоновая
кислота вследствие стерического
отталкивания сульфогруппы и водорода
в 8-положении:
ри
этом необходимо учитывать, что
-нафталенсульфоновая
кислота термодинамически менее устойчива,
чем -нафталенсульфоновая
кислота вследствие стерического
отталкивания сульфогруппы и водорода
в 8-положении:
Поэтому при температуре 80 оС имеет место кинетический контроль (стабильнее --комплекс), при температуре 160 оС – термодинамический контроль.
11.2.4. Высшие полициклические арены.
Для примера приведем четыре соединения:
 Нафтацен
(тетрацен) 1,2,5,6-дибензантрацен
пирен 1,2-бензпирен
Нафтацен
(тетрацен) 1,2,5,6-дибензантрацен
пирен 1,2-бензпирен
Все они применяются как сырье для получения красителей, лекарств, полупроводников и т.д. и т.п.
Ряд представителей играют важную роль в живой природе. Так, антибиотик тетрациклин является производным нафтацена. В живой природе имеется группа
веществ, которые называют стероидами, к ним относятся, например, витамины
группы D. Основой скелета их молекул является циклопентанпергидрофенантрен:

Ряд полиядерных аренов имеют канцерогенные свойства, т.е. содействуют образованию злокачественных опухолей. Прежде всего это 1,2-бензпирен, 1,2,5,6-дибензантрацен и ряд других. 1,2-Бензпирен, например, образуется при неполном сгорании всяких органических соединений или при их пиролизе.
Поэтому очень важными становятся проблемы экологии окружающей среды, возникающие при получении и применении таких соединений, а также при технологических процессах сгорания топлива в автомобильных двигателях и т.п.
