
2. Адсорбція газів на твердих поверхнях. Рівняння Фрейндліха
Величина адсорбції газу залежіть від природи сорбенту та газу, концентрації газу (пари), температури.
Капілярна конденсація
Капілярною конденсацією називається процес конденсації пари речовин в пористих твердих тілах (пара речовин відрізняється від газового стану тим, що знаходиться при тиску, близькому до тиску насиченої пари і температурі, близький до температури кипіння рідини, з якої отриманий пар). Капілярна конденсація − це перший етап адсорбції пари на твердій поверхні.
За умов змочування зрідженою парою стінок капілярів в порах, пара конденсується при тисках Р, менших, ніж тиск насиченої пари над площинними поверхнями рідини при тій самій температурі − Рs. При цьому утворюються угнуті меніски. Якщо спостерігається явище незмочування, то навпаки − тиск конденсації більший, чим тиск насиченої пари над розчином й конденсація не відбувається.
Кількість утриманої капілярними силами рідини залежіть від радіуса кривизни поверхні визначається
Капілярну конденсацію використовують для вловлювання пари пористими сорбентами, в процесах сушки, удержування вологи грунтами, будівельними та ін. матеріалами.
Залежність адсорбції від властивостей газу
А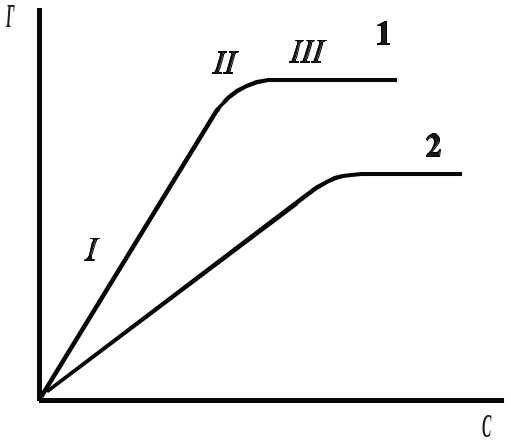 дсорбція
газу залежіть від його природи − він
повинен мати певну спорідненість до
адсорбенту. Газ адсорбується тим краще,
чим легше зріджується, чим вище його
критична температура та температура
конденсації.
дсорбція
газу залежіть від його природи − він
повинен мати певну спорідненість до
адсорбенту. Газ адсорбується тим краще,
чим легше зріджується, чим вище його
критична температура та температура
конденсації.
Рис. 1. Ізотерма адсорбції для газів при Т1 і Т2 (Т1 >Т2)
Залежність адсорбції газу від його концентрації
(t = const) має складний характер. Форма ізотерми ад-сорбції (рис. 1) на твердих тілах залежить від властивостей адсорбента та адсорбата, взаємодії адсорбент-адсорбат, взаємодії молекул адсорбата між собою в газовій фазі та в адсорбованому стані. В області малих тисків (концентрацій) взаємодія між молекулами адсорбата незначна, і залежність описується законом Генрі: величина адсорбції газа прямо пропорційна тиску.
Г = kP; Г= kC ( Р – тиск, С – концентрація).
К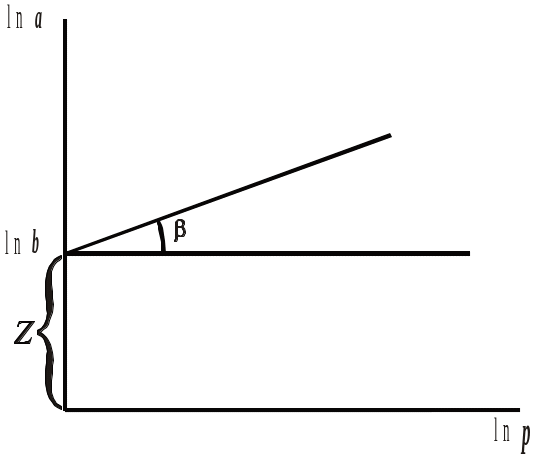 оефіцієнт
пропорційності (коефіцієнт Генрі) k
є мірою інтенсивності адсорбції.
оефіцієнт
пропорційності (коефіцієнт Генрі) k
є мірою інтенсивності адсорбції.
Горизонтальна ділянка показує, що при великих тисках адсорбція практично не залежіть від диску.
Проміжна ділянка ІІ описується емпіричним рівнянням Фрейндліха Г = bP1/n, або Г = bС1/n де b та 1/n константи, що залежать тільки від природи газу. Це рівняння параболи. Для знаходження констант його логарифмують. При логарифмуванні рівняння Фрейндліха переходить у лінійну форму lgГ = lgb + 1/nlgP(С) і в координатах lg Г – lgР ізотерма має вид прямої. Константи знаходяться аналогічно константам в рівнянні Ленгмюра: Z − відрізок, який відсікає пряма на вісі ординат, 1/n = tg − тангенсу кута нахилу прямої до вісі х.
Рис. 2. Графік для визначення констант рівняння адсорбції Фрейндліха; Ізотерма адсорбції в логаріфмічних координатах
Приклад 4. Побудувати ізотерму адсорбції СО2 активованим вугіллям при 231 К і визначити константи емпіричного рівняння Фрейндліха, використовуючи такі експериментальні дані:
[Р] 102, Па 10,0 44,8 100,0 144,0 250,0 452
Г, моль/кг 0,734 1,516 2,186 2,664 3,295 4,023.
Розв’язання:
Рівняння Фрейндліха: Г = bР1/n, де b і п − сталі величини, характерні для процесу адсорбції; Р − рівноважний тиск газу, Па. В логаріфмічній формі lgГ = lgb+ 1/п lgР, графік є прямою.
Знаходимо логарифми рівноважних тисків і відповідних величин адсорбції і будуємо графік ізотерми адсорбції.
[Р] 0,10 0,448 1,00 1,44 2,50 4,52
Г 0,734 1,516 2,186 2,664 3,295 4,023;
lg[Р] −1,0; −0,35; 0,0; 0,16; 0,40; 0,65;
lgГ −0,16; 0,18; 0,34; 0,43; 0,52; 0,60.
Р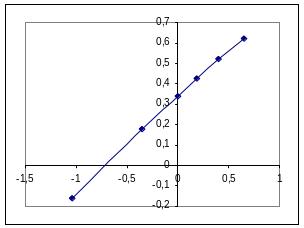 ис.
3. Логаріфмічна ізотерма адсорбції
ис.
3. Логаріфмічна ізотерма адсорбції
За рисунком знаходимо lgb= 0,35, b = 2,2;
1/п = tg = ВС/AC = 0,62:1,5 = 0,42.
Відповідь: b = 2,2; 1/п = 0,42.
Для визначення адсорбції на твердих сорбентах можна також використовувати рівняння Ленгмюра (якщо відбувається мономолекулярна адсорбція), в якому концентрації адсорбованої речовини замінені на рівноважні тиски.
