
Лекція № 5 Адсорбція з розчинів на міжфазній поверхні рідина – газ або рідина − рідина
Рівняння адсорбції Гіббса
Теорія мономолекулярної адсорбції Ленгмюра
При цьому виді адсорбції розчинена речовина з розчину концентрується на поверхні рідини на границі з газом або іншою рідиною. Такі системи мають наступні особливості.
Поверхня рідини однорідна і, відповідно, рівноцінна для адсорбції;
Молекули адсорбата можуть вільно рухатися по поверхні рідини, тобто вони не скріплені з ділянкою поверхні, це означає, що адсорбція делокалізована;
Можна нехтувати впливом газової фази.
Якщо рідини або гази не реагують між собою і взаємно не розчиняються, то на межі поділу між ними не спостерігається зміна поверхневого натягу більш щільної речовини. Якщо будь-яку речовину розчинити в рідкій фазі, то можуть спостерігатися три випадки.
Розчинена речовина концентрується на поверхні розділу фаз (Спов. > Срозч). Тоді спостерігається позитивна адсорбція, Г > 0. Поверхневий натяг розчину зменшується. Таку властивість мають молекули ПАР;
Розчинена речовина концентрується всередині фази, а на поверхні розділу концентруються молекули розчинника (Спов. < Срозч), адсорбція негативна (Г < 0). Поверхневий натяг розчину збільшується. Таку властивість мають молекули поверхнево-інактивних речовин, ПІР;
Розчинена речовина не змінює поверхневий натяг розчину, тому її концентрація по всьому обїєму розчинника стала (поверхнево-неактивні речовини, ПНР).
Рівняння адсорбції Гіббса
Джозеф Гіббс використав закони термодинаміки до повіерхневих явищ і, не виявляючи природи сил, що приводять до адсорбції речовин на границі розділу фаз і механізма явища, вивів рівняння залежності адсорбції від поверхневого натягу при зміні концентрації розчину.
Математичний вираз рівняння Гіббса такий:
Г
= –
![]() ,
,
де Г – надлишок кількості (адсорбція) розчиненої речовини на одиниці поверхні, моль/м2; С – її молярна концентрація, моль/л, – поверхневий натяг розчину, Дж/м2.
Це рівняння використовується для ідеальних розчинів (дуже розбавлених розчинів неелектролітів). Для реальних розчинів замість концентрацій треба вживати активність:
Г
=
−![]() .
.
Для газів замість концентрацій підставляють рівноважні тиски:
Г
=
−![]() .
.
Рівняння Гіббса універсальне і справедливе для всіх адсорбційних процесів, але поверхневий натяг можна визначати тільки для рідин, тому воно використовується саме у випадках адсорбції на поверхні поділу рідина − рідина або рідина − газ.
Приклад 1. Знайти адсорбцію в моль/м2 пеларгонової кислоти С8Н17СООН при 10 °С, якщо активність її в розчині 50 мг/л. Поверхневий натяг води при даній температурі дорівнює 74·10–3 Дж/м2, а розчину вказаної концентрації — 57,0 ·10–3 Дж/м2.
Розв’язання:
Г – ?
Використовуємо формулу рівння Гіббса
Г
=
–
![]() = –
= –
![]() = + 7,2
10−6
моль/м2.
= + 7,2
10−6
моль/м2.
[Г]
=
![]() .
Оскільки Г
> 0
і σ2
< σ1,
то адсорбція позитивна.
.
Оскільки Г
> 0
і σ2
< σ1,
то адсорбція позитивна.
Відповідь: Г = 7,2 10−6 моль/м2.
Приклад 2. При 293 К поверхневий натяг ртуті становить 0,458, а амальгами калію (С = 0,11 моль/л) − 0,393 Дж/м2. Визначити адсорбцію калію на поверхні ртуті.
Розв’язання:
1. Г − ?
В
рівнянні (2) можна замінити похідну
![]() на
на
![]() .
.
Г
=
–
![]() = –
= –
![]() = +
2,66
10−5
моль/м2.
= +
2,66
10−5
моль/м2.
[Г]
=
![]() .
.
Відповідь: Г = 2,66 10−5 моль/м2.
За рівнянням Гіббса можна обчислити адсорбцію розчиненої речовини при різних концентраціях. Для цього будують графік залежності поверхневого натягу від концентрації. Необхідні значення знаходять графічно. Для цього до точок, що
в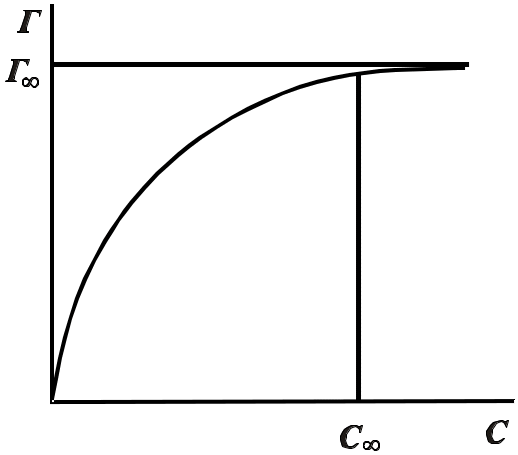 ідповідають
різним концентраціям С1,
С2,
С3
і т.д., проводять дотичні; за кутами
нахилу їх до вісі абсцис визначають
тангенси кутів tg
=
.
ідповідають
різним концентраціям С1,
С2,
С3
і т.д., проводять дотичні; за кутами
нахилу їх до вісі абсцис визначають
тангенси кутів tg
=
.
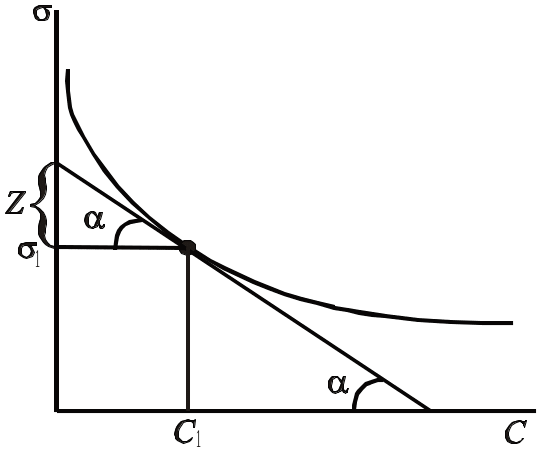 Рис.
1. Визначення надлишкової адсорбції
Рис.
1. Визначення надлишкової адсорбції
Перемноживши одержані значення tg на С/RT одержують Г, за якими можна побудувати повну криву Г= f(C) – ізотерму адсорбції, з якої потім знайти адсорбцію за іншими концентраціями (рис. 1).
Зі збільшенням концентрації адсорбція зростає до певної межі, деякого максимального (граничного) значення Г. За величиною Г можна одержати відомості про будову адсорбційного шару. З рівняння Гіббса випливає, що основною характеристикою адсорбата є величина , але вона змінюється при зміні концентрації. Звичайно використовують її граничне значення при С→ 0, яке називається поверхневою активністю.
g = –( )C→0 (Дж·м/моль).
Чим більше зменшується поверхневий натяг з зростанням концентрації адсорбата, тим більше його поверхнева активність.
Приклад 3. Визначити адсорбцію масляної кислоти на поверхні розділу водний розчин − повітря при 283 K та концентрації С = 0,104 моль/л, використавши наступні експериментальні дані.
Сі, кмоль/м3 0,00 0,021 0,050 0,104 0,246 0,489
і103, Дж/м2 74,01 69,51 64,30 59,85 51,09 44,00
Задачу вирішити розрахунковим та графічним способом.
Розвۥязання:
Розрахунковий спосіб.
1. Г = ?
Г
=
–
= –![]()
![]() = 6,02·10−6
моль/м2.
= 6,02·10−6
моль/м2.
Графічний спосіб.
Сі/і−? Гі =?
tg1
=
![]() = 0,215
= 0,215
tg2
=
![]() = 0,18
= 0,18
tg3
=
![]() = 0,13
= 0,13
tg4
=
![]() = 0,66
= 0,66
tg5
=
![]() = 0,043
= 0,043
Графічні визначення зведені до таблиці
№ |
sі Дж/м2 |
Сі кмоль/м3 |
і/Сі расч |
Сі/RT
|
Гі,расч=
–
|
tgi |
Гі,граф =
–
|
1 |
69,51 |
0,021 |
−0,21 |
0,009 |
1,910−6 |
−0,215 |
1,9310−6 |
2 |
64,30 |
0,050 |
−0,19 |
0,021 |
4,010−6 |
−0,18 |
3,7010−6 |
3 |
59,85 |
0,104 |
−0,136 |
0,044 |
6,010−6 |
−0,13 |
5,7210−6 |
4 |
51,09 |
0,246 |
−0,093 |
0,104 |
1010−6 |
−0,66 |
6,810−6 |
5 |
44,00 |
0,489 |
−0,061 |
0,208 |
1310−6 |
−0,043 |
8,910−6 |

Відповідь: Гтеор = 6,02·10−6 моль/м2, Гграф = 5,72·10−6 моль/м2.
Для жирних кислот (поширених ПАР) на підставі великого експериментального матеріалу було знайдено, що поверхнева активність в водних розчинках зростає у 3÷3,5 рази при збільшенні карбонового ланцюгу на групу СН2 (правило Дюкло −Траубе).
