
3. Лабораторный анализ проб воды
В процессе прохождения практики нами были взяты четыре пробы воды 25.06.2012 для дальнейшего исследования и лаборатории.
Проба №1 – родник
Проба №2 – ручей Должик
Проба №3 – Орловый пруд №1
Проба №4 – Орловый пруд №2
Мы проводили анализы по сокращенной программе, т.е. на определенные показатели.
Для каждой пробы были определены:
- рН
- общая жесткость
- концентрация ионов Са2+
- концентрация ионов Mg2+
- концентрация ионов Cl+
- концентрация ионов NH4+
- концентрация ионов NO2+
Значение рН воды имеет важное значение при формировании химического состава вод. Процессов их очищения, обеспечения условий существования для растительного и животного мира водоема. Например понижение рН способствует увеличению растворимости карбонатов, сульфидов, фосфатов, тяжелых металлов, увеличению их миграции и доступности для усвоения живыми организмами, отравлению.
Наиболее точно рН можно определить при помощи рН-метра, но в эоловых условиях в полнее подойдет индикаторная бумага и по цветной шкале можно удобно и быстро определить рН.
Жесткость воды обусловлена наличием солей кальция и магния. Различают карбонатную и некарбонатную жесткость, первая обусловлена гидрокарбонатами, вторая – хлоридами и сульфатами кальция и магния.
В водоемах с мягкой водой (до 20 мг/л СаСО3) действие ядовитых неорганических соединений проявляется при менее низких концентрациях, чем в водоемах с жесткой водой.
В лаборатории общую жесткость исследуемых проб количественно мы определили комплексонометрическимтитрированием. Титрометрический метод анализа основывается на взаимодействии двух и более растворов определенного объема, концентрация одного из растворов которого известна. Комплексонометрическое титрование основывается на взаимодействии катионов кальция и магния с трилоном Б в аммиачном буферном растворе (рН= 9,5) с образованием комплексных соединений при условии добавления специальных реактивов, в нашем случае хромового темно-синего. Титрование проводилось пипеткой, брались аликвотные части исследуемых проб воды – 10 см3, и титровались до перехода окраски раствора из сиренево-красной в темно-синею.
Жесткость определялась по формуле:
Ж =
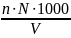 ,
,
Где: n – объем компликсона-3
N – нормальность или концентрация трилона-Б (равняется 0.02 г/дм3)
V – объем пробы (10 см3)
Расчеты представлены ниже в виде таблице 3.1.
Определение концентрации ионов кальция подобно определению жесткости, только в качестве буферного раствора применялся раствор NaOH, а индикатор – мурексид. Титрование проводилось трилоном Б до момента перехода окраски раствора из розового в фиолетовый.
Концентрация ионов кальция определяется по формуле:
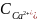 =
=

Где: n – объем компликсона-3
N – нормальность или концентрация трилона-Б (равняется 0.02 г/дм3)
V – объем пробы (10 см3)
Концентрация ионов магния определяется вычитанием из общей жесткости пробы концентрации ионов кальция.
Ионы хлора можно определить характерной реакцией, при добавлении нитрата серебра AgNO3, выподает характерный не растворимый осадок белого цвета. Количественно же концентрацию ионов хлора мы определяли при помощи титрования исследуемых проб воды нитратом серебра (0.02 и концентрированного раствора AgNO3)с добавлением 1% раствора хромата калия до перехода окраски раствора из желтой в буро-оранжевую.
Определяем СCl – по формуле:
СCl =
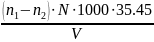 ,
,
Где
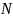 – концентрация AgNO3 (0.02 Н)
– концентрация AgNO3 (0.02 Н)
n1 – объем AgNO3 на титрование пробы, см3
n2 – объем AgNO3на титрование холостой пробы (0,03 см3)
Азот, как и фосфор, является основным компонентом живых организмов. В природе, например в водоемах постоянно происходит круговорот соединений азота. Вследствие разложения белков в водоемах образуется аммиак, который со временем окисляется до нитратов и нитритов.
Для определения нитратов и аммония
применяется фотометрический метод.
Метод основан на способности первичных
ароматических аминов в присутствии
азотистой (нитритной) кислоты давать
интенсивно окрашенные соединения.
Оптическую плотность образованного
соединения определяют при длине волны,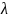 = 536 нм.
= 536 нм.
Вначале приготавливают основной стандартный раствор и рабочий стандартный раствор NaNO2. Растворы готовятся в день определения. Затем в них добавляют сухой реактив Гриеса для определения нитратов и реактив Неселера для аммония. Растворы оставляют на 40 минут, а затем по очереди в порядке возрастания концентрации измеряют оптическую плотность растворов на фотоэлектроколориметре с зеленым светофильтром в кювете с толщиной слоя 5 см относительно холостой пробы. Результаты измерения заносят в рабочий журнал. На результате полученных данных строят калибровочный график, откладывая по оси абсцисс значения концентрации, а по оси ординат – значение оптической плотности.
Содержание нитритов и аммиака в мг/дм3 рассчитывают по формуле:
Сх= С ,
,
где: С – концентрация нитритов и аммиака, найденная по калибровочному графику, мг/дм3;
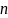 - степень разбавления исследуемой пробы
воды (в случае, если исследуемую пробу
не разбавляют,
- степень разбавления исследуемой пробы
воды (в случае, если исследуемую пробу
не разбавляют,
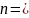 1; а если взято например 10 см3 и
разбавлено до 50 см3,
1; а если взято например 10 см3 и
разбавлено до 50 см3,
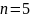 и т.п.).
и т.п.).
Таблица 3.1 – Результаты анализа проб воды
№ пробы |
рН |
Общая жесткость
воды мг |
ССа2+мг/ дм3 |
СMg2+ мг/ дм3 |
СCl+мг/дм3 |
СNH4+мг/дм3 |
СNO2+мг/дм3 |
1 |
7,0 |
15,0 |
200.4 |
60.8 |
196 |
0.34 |
0.03 |
2 |
6,5 |
15,2 |
192.4 |
68 |
338 |
0.75 |
0.72 |
3 |
7,0 |
12,8 |
216.4 |
24.1 |
451 |
0.93 |
0.52 |
4 |
6,0 |
14,8 |
184.4 |
68 |
402 |
0.48 |
0.46 |
ПДК |
6,0-9,0 |
7-10 |
|
|
350 |
0.5 |
0.08 |
Таблица 3.2 – прошлогодниерезультаты анализа проб воды
№ пробы |
рН |
Общая жесткость воды мг экв/дм3 |
ССа2+мг/ дм3 |
СMg2+ мг/ дм3 |
СCl+мг/дм3 |
СNH4+мг/дм3 |
СNO2+мг/дм3 |
1 |
6,8 |
15,0 |
176,4 |
75,4 |
- |
0.28 |
0.03 |
2 |
6,5 |
8,6 |
252,5 |
77,8 |
- |
0.89 |
0.3 |
3 |
6,5 |
15,8 |
204.4 |
68,1 |
- |
0.35 |
0.3 |
4 |
7,0 |
15,0 |
184.4 |
70,5 |
- |
0.48 |
0.28 |
Если сравнивать полученные результаты с прошлогодними, которые представлены в таблице 3.2, то в значениях рН изменения не значительны. Жесткость воды увеличилась в 3 пробах. И превышает ПДК. СMg2+ уменьшилось во всех пробах, СNH4+увеличилось в первой и в третьей пробе, а уменьшилось во второй и четвертой, СNO2+ - увеличилось во всех пробах, кроме №1. В воде родника СNO2+ – не изменилась.
Что касается превышений ПДК, то по содержанию СNH4+наблюдались превышения только лишь по второй пробе, а с течением одного года превышения наблюдались уже в трех пробах.

 экв/дм3
экв/дм3