
2. Розрахунок зміни ентропії в процесах ідеального газу
Знайдемо ентропію для 1 моля ідеального газу. Для нескінченного малого квазістатичного процесу з ідеальним газом маємо:
![]() .
(11)
.
(11)
Звідси
![]() .
(12)
.
(12)
Зміна
ентропії в ізотермічному
процесі.
Застосуємо для визначення формулу (12),
враховуючи, що
![]() .
В ізотермічному процесі енергетичний
стан газу залишається незмінним, а зміни
характеристик зумовлені лише зміною
об’єму. Для цього випадку
.
В ізотермічному процесі енергетичний
стан газу залишається незмінним, а зміни
характеристик зумовлені лише зміною
об’єму. Для цього випадку
![]() .
(13)
.
(13)
З цього випливає
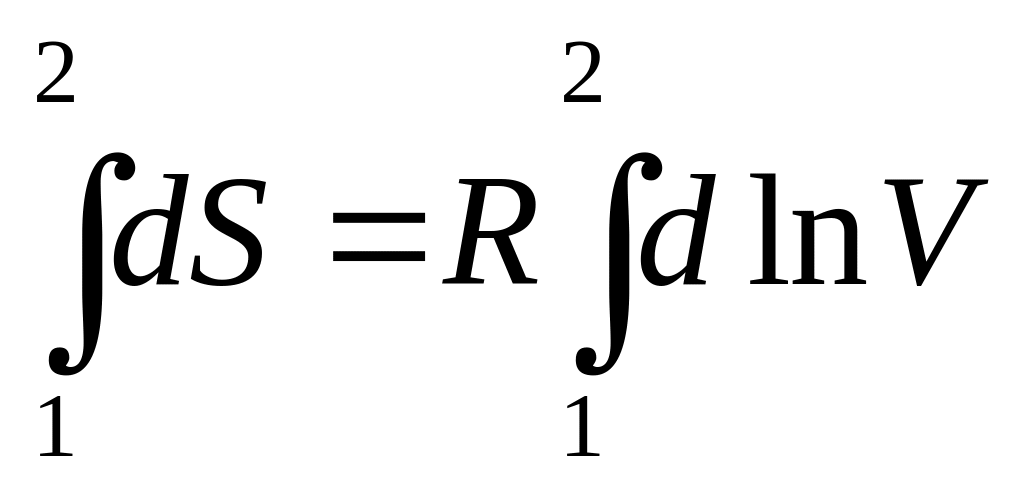 .
(14)
.
(14)
Формула (18) після інтегрування дає
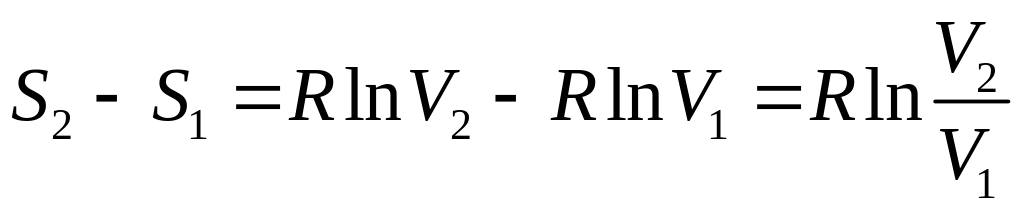 .
(15)
.
(15)
Тобто зі зростанням об’єму ентропія збільшується. Цей результат пояснюється тим, що збільшується кількість мікростанів, в яких може перебувати системи.
Зміна
ентропії при ізохорному
процесі.
При ізохорному процесі
![]()
 .
(16)
.
(16)
Тобто зі зростання температури ентропія збільшується. Цей результат пояснюється тим, що середня енергія частинок зростає зі зростанням температури, а тому збільшується і число можливих енергетичних станів.
Зміна
ентропії при адіабатному
процесі.
При адіабатному процесі
![]() ,
тому
,
тому
![]() .
Це можна показати також із допомогою
(12), враховуючи (15) та (16),
.
Це можна показати також із допомогою
(12), враховуючи (15) та (16),
 ,
(17)
,
(17)
причому
![]() ,
,
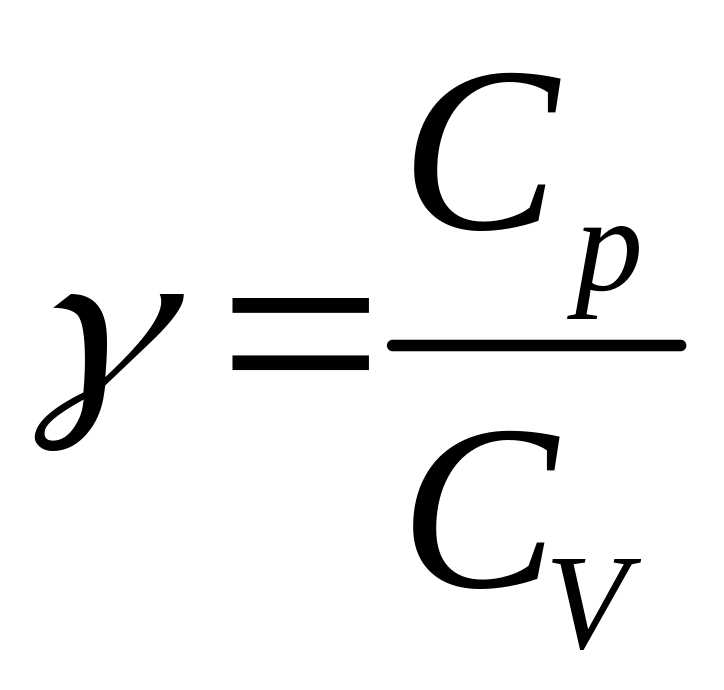 ,
,
тому
 .
.
Тоді формула (21) набуває вигляду
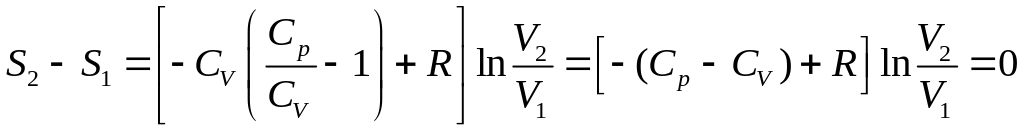 ,
(18)
,
(18)
оскільки
![]() (відповідно
до формули Майера).
(відповідно
до формули Майера).
Таким чином, при адіабатному оборотному процесі ентропія не змінюється. При адіабатичному розширені газу за рахунок збільшення об’єму ентропії зростає, але за рахунок зменшення температури, яке при цьому відбувається, вона зменшується, і ці обидві тенденції повністю компенсують одна одну.
Зміна ентропії при ізобарному процесі. З виразу (12) отримуємо
, (19)
причому
![]() ,
тому
,
тому
 .
.
Формула (20) набуває вигляду
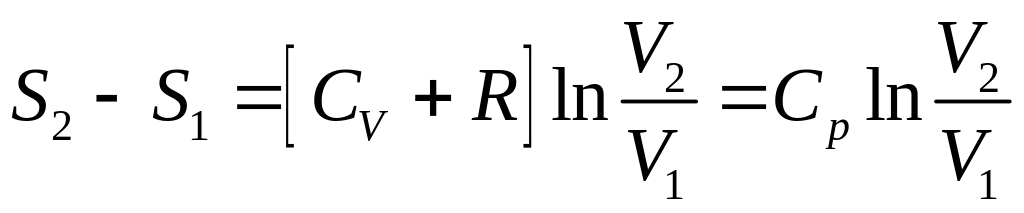 .
.
Таким чином, при ізобарному оборотному процесі ентропія зростає за рахунок збільшення об’єму і зростання температури.
3. Іі закон термодинаміки для нерівноважних процесів. Закон зростання ентропії
З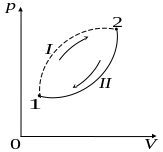 астосуємо
нерівність Клаузіуса для описання
необоротного кругового термодинамічного
процесу, зображеного на рисунку.
астосуємо
нерівність Клаузіуса для описання
необоротного кругового термодинамічного
процесу, зображеного на рисунку.
Нехай
процес
![]() буде необоротним, а процес
буде необоротним, а процес
![]() - оборотним. Тоді нерівність Клаузіса
для цього випадку прийме вигляд
- оборотним. Тоді нерівність Клаузіса
для цього випадку прийме вигляд
 .
(25)
.
(25)
Оскільки процес є оборотним, то
 .
(26)
.
(26)
Підстановка цієї формули в нерівність (25) дозволяє отримати вираз
 .
(27)
.
(27)
П орівнюючи
(15) і (27), можемо записати наступну
нерівність
орівнюючи
(15) і (27), можемо записати наступну
нерівність
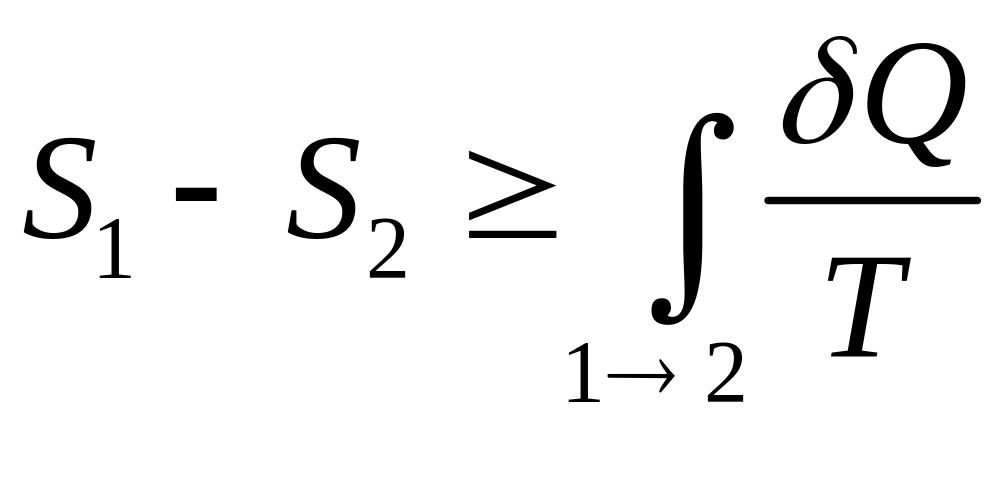 ,
(28)
,
(28)
в якій
знак рівності має місце у випадку, якщо
процес
![]() є оборотним, а знак більше, якщо процес
- необоротний.
є оборотним, а знак більше, якщо процес
- необоротний.
Я кщо
розглядати адіабатно ізольовану
термодинамічну систему, для якої
,
то
кщо
розглядати адіабатно ізольовану
термодинамічну систему, для якої
,
то
![]() .
.
В адіабатично ізольованій термодинамічній системі ентропія не може убувати: вона або зберігається, якщо в системі відбувається тільки оборотні процеси, або зростає, якщо в системі протікає хоча б один необоротний процес.
Записане твердження є ще одним формулюванням другого закону термодинаміки.
Таким чином ентропія вказує напрямок самовільного протікання процесів. Ізольована термодинамічна система прагне максимального значення ентропії, при якому наступає стан термодинамічної рівноваги. Необхідно відзначити, що якщо система не є ізольованою, то в ній можливе зменшення ентропії. Прикладом такої системи може служити, наприклад, звичайний холодильник, всередині якого можливо зменшення ентропії. Але для таких відкритих систем це локальне зменшення ентропії завжди компенсується зростанням ентропії в навколишньому середовищі, яке перевершує її локальне зменшення.
