
4. Розрахунок роботи при ізотермічному, ізохорному та ізобарному процесах.
На рисунку зображені три різних процеси, що переводять газ із стану 1 у стан 2. В усіх трьох випадках газ здійснює різну роботу. Процеси, зображені на рис. 5, можна провести й у зворотному напрямку; тоді робота A просто змінить знак на протилежний.
а) б) в) г)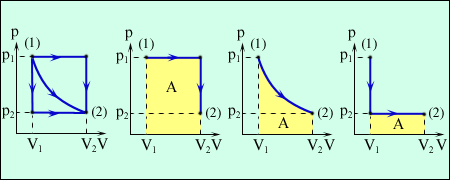
Розглянемо ці процеси і роботу ідеального газу в них.
1) Ізобарний процес: р = const. Графіки ізобарного процесу при розширенні зображені на рисунку б) – процес 1-1, г0 – процес 1-2. Робота молей газу по розширенню від об'єму V1 до об'єму V2 визначається очевидним співвідношенням:
![]()
Перший закон термодинаміки для ізобарного процесу має вигляд:
![]()
При ізобарному розширенні ΔQ>0 – тепло поглинається газом, і газ здійснює позитивну роботу. При ізобарному стискуванні ΔQ<0 – тепло віддається зовнішнім тілам. У цьому випадку A<0. Температура газу при ізобарному стискуванні зменшується, T2<T1; внутрішня енергія убуває, ΔU<0.
2) Ізотермічний процес: Т=const. Графік ізотермічного процесу зображений на рис. в). Робота молей газу по розширенню від об'єму V1 до об'єму V2 визначається:
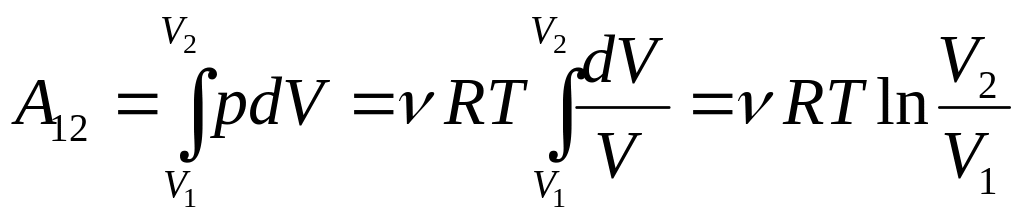
Тут
ми скористалися рівнянням стану
ідеального газу
![]() .
Робота дорівнює площі під кривою ізотерми
від точки
1 до точки
2. В
ізотермічному
процесі
температура
газу не змінюється, отже, не змінюється
і внутрішня енергія газу, ΔU=0.
Перший закон термодинаміки для
ізотермічного процесу виражається
співвідношенням
.
Робота дорівнює площі під кривою ізотерми
від точки
1 до точки
2. В
ізотермічному
процесі
температура
газу не змінюється, отже, не змінюється
і внутрішня енергія газу, ΔU=0.
Перший закон термодинаміки для
ізотермічного процесу виражається
співвідношенням
![]()
Кількість теплоти ΔQ, отриманої газом у процесі ізотермічного розширення, перетворюється в роботу над зовнішніми тілами. При ізотермічному стискуванні робота зовнішніх сил над газом перетворюється в теплоту, що передається навколишнім тілам.
3) Ізохорний процес: V = const. Графіки ізохорного процесу зображені на рисунку б) процес 1-2, г- процес 1-1. Оскільки зміна об'єму дорівнює нулеві dV = 0, то і робота газу дорівнює 0:
А = 0
Отже, оскільки газ роботу не здійснює, то:
![]()
Тут U(T1) і U(T2) – внутрішня енергія газу в початковому і кінцевому станах. Внутрішня енергія ідеального газу залежить тільки від температури (закон Джоуля). При ізохорному нагріванні теплота поглинається газом (Q>0), і його внутрішня енергія збільшується. При охолодженні теплота віддається зовнішнім тілам (Q<0).
