
- •«Приготовление рабочего раствора тиосульфата натрия» (200 мл раствора Na2s2o3 с молярной концентрацией эквивалента 0,02 моль/л)
- •Контрольная работа. Определение % содержания хрома в растворе k2Cr2o7
- •Занятие 5. Приготовление 100 мл 0,05 н стандартного раствора оксалата натрия
- •3. Установление нормальности и титра раствора kMnO4 по раствору оксалата натрия
- •Определение % содержания железа в растворе соли Мора FeSo4·(nh4)2so4·6h2o
- •(Нейтрализации)
- •Определение кислотности молока.
- •Выполнение эксперимента.
- •Колориметрические методы определения рН
- •Выполнение эксперимента.
- •Получив раствор с неизвестным значением рН, сначала с помощью универсального бумажного индикатора определяют ориентировочное значение рН исследуемого раствора см. Табл.1
- •Контрольные вопросы:
- •Определение содержания меди в растворе методом стандартных серий
- •Выполнение эксперимента
- •Контрольные вопросы
- •Контрольные вопросы
- •Расчет рН буферных систем
- •Механизм буферного действия
- •Аммонийная буферная система
- •Фосфатная буферная система. Биологическое значение
- •Гидрокарбонатная буферная система. Биологическое значение
- •Гемоглобиновая буферная система.
- •Белковая буферная система. Биологическое значение
- •Свойства буферных растворов
- •Вопросы:
- •Вопросы к защите работы
- •Выполнение эксперимента.
- •Вопросы к защите работы
- •Занятие 20. Растворы вмс. Определение вязкости с помощью вискозиметра.
- •Теоретическая часть.
- •Опыт 4. Влияние pH на вязкость.
- •Вопросы к защите работы
Контрольные вопросы
Чем отличаются физико-химические методы анализа от химических?
Что такое колориметрический метод анализа?
Как записывается закон Бугера-Ламберта-Бера? Что он выражает?
Что такое визуальный и фотоэлектрический метод колориметрического анализа?
На чем основан принцип работы фотоэлектроколориметра?
Что такое оптическая плотность раствора и как она выражается?
В чем сущность метода стандартных серий?
Как строится калибровочный график?
Каким образом по калибровочному графику можно определить концентрацию исследуемого раствора?
Какой метод колориметрии точнее: визуальный или фотоэлектрический?
Хронометраж 2-часового занятия:
1.Организационный момент – 3 мин.
2. Объяснение нового материала- 30 мин.
3. Выполнение лабораторной работы-40 мин.
4. Письменный тестовый опрос- 15 мин.
5. Задание на дом- 2 мин.
Литература:
1. М.И. Равич-Щербо, В.В. Новиков. Физическая и коллоидная химия.М.1975г., глава IV, с. 88-89.
2. П.М. Маршев. Руководство к практическим занятиям по физической и коллоидной химии. Медиздат, 1954г., с. 54-56.
Занятие 14. СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ
Цель занятия: Изучить классификацию основных буферных систем живых организмов и механизм действия буферных смесей. Научиться готовить буферные системы с заданным значением рН и исследовать звисимость
Теоретическая часть:
Значительную роль в поддержании постоянства рН биологических жидкостей, тканей и органов (кислотно-основного гомеостаза биосистем) и лабораторной диагностике играют буферные растворы.
Буферные растворы – это растворы, рН которых меняется незначительно при разбавлении или при добавлении небольших количеств кислоты или щелочи.
В водных буферных растворах основными компонентами являются донор и акцептор протонов, представляющие собой сопряженную кислотно-основную пару.

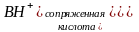


Сопряженные кислотно-основные пары В/ВН+ и А–/НА называют буферными системами.
Буферные системы по составу бывают двух основных типов:
Слабая кислота (донор протонов) и ее соль (акцептор протонов, сопряженное основание), образованная сильным основанием. Например, ацетатный буфер СН3СООН + СН3СООNa.
Слабое основание (акцептор протонов) е его соль (донор протонов), образованная сильной кислотой. Например, аммиачный буфер NH4OH + NH4Cl.
Расчет рН буферных систем
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система и стремиться сохранять при добавлении кислот или щелочей.
Рассмотрим на примере ацетатной буферной смеси, что же определяет ее рН.



Из приведенной схемы видно, что в ацетатном буферном растворе концентрация водородных ионов будет зависеть от степени диссоциации молекул кислоты. Согласно закону действия масс константа диссоциации уксусной кислоты будет
 ,
,
откуда
 . (1)
. (1)
Это равенство справедливо для раствора, в котором содержится только одна уксусная кислота. Добавление к раствору уксусной кислоты ацетата натрия подавляет ее диссоциацию (принцип Ле Шателье), в результате чего концентрацию молекул недиссоциированной СН3СООН можно без больших погрешностей принять равной общей концентрации кислоты, т.е.
[СН3СООН] = Скислота. (2)
Учитывая, что соль СН3СООNa как сильный электролит в водном растворе диссоциирована полностью, можно принять, что общая концентрация аниона СН3СОО– практически равна аналитической концентрации соли в данной буферной смеси, т.е.
[СН3СОО–] = Ссоль. (3)
Подставляя значения (2) и (3) в уравнение константы диссоциации (1), получим:
 .
.
Взяв обратный логарифм от обеих частей этого уравнения и обозначив –lg[H+] как рН, а –lgКа как рКа, получим следующее уравнение, которое характеризует зависимость кислотности буферного раствора от силы кислоты (Ка) и состава раствора соли (Ссоль, Скислота)

или
 . (4)
. (4)
В общем случае для любого буфера уравнение (4) принимает следующий вид:

и носит название уравнения Гендерсона-Гассельбаха.
Для щелочного буфера, каким является, например, аммиачный, соответственно будет:

и
 ,
,
 .
(5)
.
(5)
Из приведенных уравнений видно, что рН буферных смесей зависит от константы диссоциации кислоты или основания и от соотношения концентрации компонентов буферных смесей.
