
- •Глава 15
- •15.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •15.1.3. Нахождение в природе, изотопный состав
- •15.1.4. Краткие исторические сведения
- •15.2. Простые вещества
- •15.2.1. Азот
- •15.2.2. Фосфор
- •15.2.3. Мышьяк
- •15.2.4. Сурьма
- •15.2.5. Висмут
- •15.3. Сложные соединения элементов 15-й группы
- •15.3.1. Кислородные соединения
- •15.3.1.1. Оксиды азота
- •15.3.1.2. Кислородсодержащие кислоты азота и их соли
- •15.3.1.3. Оксиды фосфора
- •15.3.1.4. Кислородсодержащие кислоты фосфора и их соли
- •15.3.1.5. Оксиды мышьяка
- •15.3.1.6. Кислородсодержащие кислоты мышьяка и их соли
- •15.3.1.7. Оксиды сурьмы
- •15.3.1.8. Гидраты оксидов сурьмы и их соли
- •15.3.1.9. Кислородные соединения висмута (III)
- •15.3.1.10. Кислородные соединения висмута (V)
- •15.3.2. Галогениды
- •15.3.2.1. Галогениды азота
- •15.3.2.2. Галогениды фосфора
- •15.3.2.3. Галогениды мышьяка
- •15.3.2.4. Галогениды сурьмы
- •15.3.2.5. Галогениды висмута
- •15.3.3. Водородные соединения и их производные
- •15.3.3.1. Водородные соединения азота и их производные
- •15.3.3.2. Водородные соединения фосфора и их производные
- •15.3.3.3. Водородные соединения мышьяка, арсениды
- •15.3.3.4. Гидрид сурьмы, антимониды
- •15.3.3.5. Гидрид висмута
- •15.3.4. Серосодержащие соединения
- •15.3.4.1. Серосодержащие соединения азота
- •15.3.4.2. Сульфиды фосфора
- •15.3.4.3. Сульфиды мышьяка
- •15.3.4.4. Сульфиды сурьмы
- •15.3.4.5. Сульфиды висмута
- •15.4. Комплексные и элементоорганические соединения элементов 15-й группы
- •15.4.1. Комплексные соединения
- •15.4.2. Элементоорганические соединения
- •15.5. Биологическая роль элементов 15-й группы
15.3.2.2. Галогениды фосфора
По сравнению с галогенидами азота, очень неустойчивыми и взрывчатыми, галогениды фосфора значительно менее реакционноспособны. Например, если NCl3 - сильнейший детонатор (из-за очень высокой устойчивости молекулы N2, образующейся при распаде NCl3, при разложении NCl3 выделяется большое количество энергии, равное 460 кДж/моль N2), то РСl3 вполне устойчив при обычных условиях, детонационной способностью не обладает (молекула Р4 является менее прочной, чем N2).
Известны следующие галогениды фосфора: восемь тригалогенидов − PF3, PF2Cl, PFCl2, PCl3, PF2Br, PFBr2, PBr3, PI3, девять пентагалогенидов - PF5, PCl5, PBr5, PFxCl5−x, где х = 1 ÷ 4, PF3Br2, PI5 (существование РI5 подвергается сомнению, возможно, это PI3×I2) и три тетрагалогенида - P2F4, P2Cl4 и Р2I4.
Типичными для галогенидов фосфора свойствами обладают хлориды фосфора. Получаются они обычно взаимодействием РКР и хлора при незначительном нагревании:
2Р + 3Сl2 = 2РСl3.
Трихлорид фосфора представляет собой при обычных условиях легкоподвижную бесцветную жидкость с ТКИП = 76,60С. Образующийся при той же температуре, но при большей концентрации Сl2 пентахлорид фосфора РСl5 в обычных условиях - кристаллическое бесцветное, легко возгоняющееся (1000С) вещество. При нагревании РСl5 диссоциирует:
РСl5 D РСl3 + Сl2.
Полный распад происходит при 3000С.
Разницу в агрегатном состоянии РСl3 и РСl5 нельзя объяснить тем, что в РСl3 связь Р-Сl имеет ковалентный характер, а в РСl5 - ионный. Установлено, что связь Р-Сl в обоих галогенидах носит ковалентный характер, однако атомы фосфора и хлора группируются в РСl5 таким образом, что образуются положительно заряженные катионы РСl4+ и отрицательно заряженные анионы РСl6¯, располагающиеся в узлах ионной кристаллической структуры. Тем же объясняется и твердое состояние РВr5 при обычных условиях. Однако состав образующих кристаллическую структуру типа CsCl ионов в этом случае иной: РВr4+ и Вr¯ (анионы РВr6¯ не могут существовать из-за больших размеров Вr¯). В паре молекулы РХ5 представляют собой тригональную бипирамиду.
Галогениды фосфора обладают свойствами галогенангидридов: при взаимодействии с водой они образуют галогеноводородную и одну из кислородсодержащих кислот фосфора. Например:
РСl3 + 3Н2О = Н3РО3 + 3НСl,
РСl5 + 4Н2О = Н3РО4 + 5НСl.
При частичном гидролизе пентагалогенидов фосфора образуются оксогалогениды, например:
РСl5 + Н2О = РОСl3 + 2НСl.
оксохлорид
Оксохлорид фосфора можно получить также при слабом нагревании пентахлорида фосфора с избытком оксида фосфора (V):
3РСl5 + Р2О5 = 5РОСl3.
Если РСl5 взаимодействует не с водой, а с аммиаком, то вместо гидролиза осуществляется аммонолиз, сопровождающийся образованием одного из наиболее известных неорганических полимеров - фосфонитрилхлорида (PNCl2)n (где n = 3). Строение его может быть описано формулой
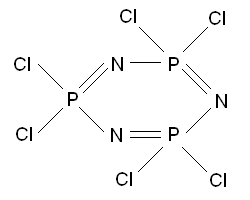
Это один из нескольких «неорганических бензолов». Здесь электроны фосфора и азота, находящиеся на p-орбиталях, делокализованы по шестичленному кольцу, что придает всем связям частично двойной («ароматический») характер.
Тетраиодид дифосфора Р2I4 - триклинные красные кристаллы, ТПЛ = 125,50С. Рентгеноструктурное исследование показало, что молекулы Р2I4 имеют центросимметричную транс-форму. Он образуется при взаимодействии иода и красного фосфора при 1800С или иода и белого фосфора в растворе CS2. Кроме того, его можно получить восстановлением РI3 красным фосфором или РСl3 иодом. Большинство реакций Р2I4 приводит к разрыву связи Р-Р. При гидролизе Р2I4 образуются различного состава фосфины и кислородсодержащие кислоты фосфора, в том числе небольшое количество фосфорноватой кислоты Н4Р2О6.
Пентагалогениды, тригалогениды и оксогалогениды фосфора, будучи реакционноспособными и легкорастворимыми соединениями, широко применяются в неорганическом и органическом синтезе для получения фосфор- и галогенсодержащих соединений.
