
- •Глава 15
- •15.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •15.1.3. Нахождение в природе, изотопный состав
- •15.1.4. Краткие исторические сведения
- •15.2. Простые вещества
- •15.2.1. Азот
- •15.2.2. Фосфор
- •15.2.3. Мышьяк
- •15.2.4. Сурьма
- •15.2.5. Висмут
- •15.3. Сложные соединения элементов 15-й группы
- •15.3.1. Кислородные соединения
- •15.3.1.1. Оксиды азота
- •15.3.1.2. Кислородсодержащие кислоты азота и их соли
- •15.3.1.3. Оксиды фосфора
- •15.3.1.4. Кислородсодержащие кислоты фосфора и их соли
- •15.3.1.5. Оксиды мышьяка
- •15.3.1.6. Кислородсодержащие кислоты мышьяка и их соли
- •15.3.1.7. Оксиды сурьмы
- •15.3.1.8. Гидраты оксидов сурьмы и их соли
- •15.3.1.9. Кислородные соединения висмута (III)
- •15.3.1.10. Кислородные соединения висмута (V)
- •15.3.2. Галогениды
- •15.3.2.1. Галогениды азота
- •15.3.2.2. Галогениды фосфора
- •15.3.2.3. Галогениды мышьяка
- •15.3.2.4. Галогениды сурьмы
- •15.3.2.5. Галогениды висмута
- •15.3.3. Водородные соединения и их производные
- •15.3.3.1. Водородные соединения азота и их производные
- •15.3.3.2. Водородные соединения фосфора и их производные
- •15.3.3.3. Водородные соединения мышьяка, арсениды
- •15.3.3.4. Гидрид сурьмы, антимониды
- •15.3.3.5. Гидрид висмута
- •15.3.4. Серосодержащие соединения
- •15.3.4.1. Серосодержащие соединения азота
- •15.3.4.2. Сульфиды фосфора
- •15.3.4.3. Сульфиды мышьяка
- •15.3.4.4. Сульфиды сурьмы
- •15.3.4.5. Сульфиды висмута
- •15.4. Комплексные и элементоорганические соединения элементов 15-й группы
- •15.4.1. Комплексные соединения
- •15.4.2. Элементоорганические соединения
- •15.5. Биологическая роль элементов 15-й группы
15.3.1.3. Оксиды фосфора
Оксиды фосфора менее разнообразны, чем оксиды азота. Наиболее важными для химии и технологии фосфора являются оксид фосфора (V) Р2О5 и оксид фосфора (III) Р2О3. Их свойства в сравнении со свойствами аналогичных оксидов элементов 15-й группы ПС представлены в табл. 15.5. Известны также оксиды фосфора с другими степенями окисления - РО, Р4О7, Р4О8, Р4О9. Они неустойчивы в обычных условиях, но играют важную роль промежуточных соединений в процессах окисления фосфора - простого вещества и фосфорсодержащих соединений.
О к с и д ф о с ф о р а (V)
Оксид фосфора (V), фосфорный ангидрид, пентаоксид фосфора, Р2О5 является наиболее стабильным оксидом фосфора. Р2О5 - лишь стехиометрическая формула, а строение его a-модификации описывается формулой Р4О10 - в каждой молекуле четыре атома фосфора располагаются по углам тетраэдра (рис. 15.3, а).
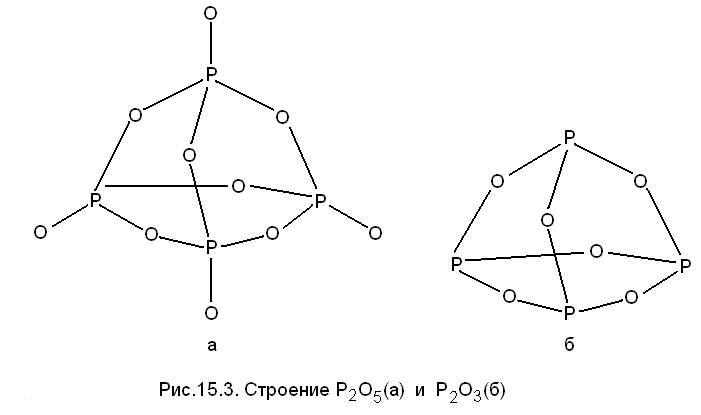
Каждый атом фосфора, в свою очередь, окружен четырьмя атомами кислорода, образующими треугольную пирамиду. При этом 12 связей Р-О (мост.) имеют длину 1,56 - 1,65 Å, а четыре расстояния Р-О (конц.) значительно короче (1,40 - 1,49 Å). Отсюда следует, что только 4 из 16 связей Р-О двойные, остальные являются одинарными. Поэтому не будет ошибкой сказать, что каждый атом фосфора в молекуле Р4О10 образует пять ковалентных связей. С помощью МВС это объясняют образованием p-связей между атомами кислорода (p-электроны) и атомами фосфора (свободные d-орбитали). Такое построение кислородных соединений невозможно для азота, не имеющего d-орбиталей.
Однако энергия 3d-орбиталей атома фосфора слишком велика по сравнению с энергией 2p-орбиталей атома кислорода, чтобы образовать p-связь. С помощью ММО пятиковалентность фосфора объясняют использованием несвязывающих МО, которые имеют меньшую энергию, чем исходные АО фосфора.
Р4О10 при обычных условиях - твёрдое белое вещество. При 3600С Р4О10 возгоняется. ТПЛ (под давлением) = 5630С. Фосфорный ангидрид даже в парах не мономерен и присутствует в форме Р4О10.
Обращает на себя внимание большая разница в термодинамической стабильности Р2О5 и N2O5 (см. табл. 15.5). Стабильность Р2О5 можно объяснить большим числом связей Р-О и большей разницей в электроотрицательности у Р и О, чем у N и О.
Известно несколько модификаций пентаоксида фосфора. Легче всего в чистом виде получить гексагональную a-форму, обладающую летучестью и ярко выраженной кристаллической структурой; метастабильная ромбическая b-форма получается при нагревании a-формы до 4000С и повышенном давлении в течение 2 ч; устойчивая ромбическая g-модификация образуется при нагревании b-формы при 4500С в течение 24 ч, также при повышенном давлении. Слоистую структуру b-модификации составляют циклы из 10 тетраэдров Р4, трехмерную структуру g-формы - циклы из 6 тетраэдров Р4. Известны также стеклообразная форма и модификация высокого давления. b- и g-Формы имеют большие плотность и ТПЛ, чем -модификация.
Р4О10 получают путем взаимодействия фосфора с избытком кислорода:
Р4 + 5О2 = Р4О10.
Оксид фосфора(V) активно взаимодействует с водой, при этом образуются в зависимости от условий различные фосфорные кислоты. Пентаоксид реагирует с оксидами и гидроксидами, давая соли различного состава (см. разд. 15.3.1.4). Благодаря большому сродству к воде Р4О10 широко используют как сильно действующее водоотнимающее средство.
О к с и д ф о с ф о р а (III)
Оксид фосфора (III), фосфористый ангидрид, триоксид фосфора) Р2О3 - белое кристаллическое вещество, ТПЛ = 23,80С, TКИП = 175,40С, хорошо растворимое в органических растворителях. Структура оксида фосфора (III) в паре, растворах и одной из кристаллических модификаций димерная Р4O6 и представляет собой четыре треугольные пирамиды РО3, связанные общими вершинами с образованием тетраэдра Р4 (рис. 15.3, б).
Фосфор в Р4О6, как видно из структуры, координационно ненасыщен, поэтому это его состояние является неустойчивым (см. табл. 15.5). Так, взаимодействие Р4О6 с горячей водой приводит к диспропорционированию:
Р4О6 + 6Н2О = РН3 + 3Н3РО4.
С холодной водой медленно идет образование фосфористой кислоты:
Р4О6 + 6Н2О = 4Н3РО3.
Газообразный НСl разлагает Р4О6:
Р4О6 + 6НСl = 2Н3РО3 + 2РСl3.
При нагревании в инертной атмосфере выше 2100С триоксид Р4О6 также разлагается:
4Р4О6 = 3Р4О8 + 4Р.
Фосфористый ангидрид образуется при медленном окислении Р4 кислородом:
Р4 + 3О2 = Р4О6.
Д р у г и е о к с и д ы ф о с ф о р а
Если нагревать Р4О6 при 200 – 4000С в запаянной вакуумированной ампуле, то в результате диспропорционирования образуются красный фосфор и твердые растворы Р4Оn, например:
4Р4О6 = 3Р4О8 + 4РКРАСН.
a-Фаза имеет состав в пределах Р4О8,1–9,2 и состоит из твердого раствора оксидов, в которых удалены из Р4О10 один или два концевых атома кислорода (Р4О9, Р4О8). b-Фаза является твердым раствором оксидов Р4О8 и Р4О7 (пределы состава Р4О8,0–7,7). Оксид Р4О7 представляет собой структурный аналог Р4О10, в котором остался лишь один концевой атом кислорода. Оксид Р4О8, по-видимому, можно считать смешанным ангидридом фосфорной и фосфористой кислот, так как при взаимодействии с водой он образует эти кислоты:
Р4О8 + 6Н2О = 2Н3РО3 + 2Н3РО4.
