
- •Глава 15
- •15.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •15.1.3. Нахождение в природе, изотопный состав
- •15.1.4. Краткие исторические сведения
- •15.2. Простые вещества
- •15.2.1. Азот
- •15.2.2. Фосфор
- •15.2.3. Мышьяк
- •15.2.4. Сурьма
- •15.2.5. Висмут
- •15.3. Сложные соединения элементов 15-й группы
- •15.3.1. Кислородные соединения
- •15.3.1.1. Оксиды азота
- •15.3.1.2. Кислородсодержащие кислоты азота и их соли
- •15.3.1.3. Оксиды фосфора
- •15.3.1.4. Кислородсодержащие кислоты фосфора и их соли
- •15.3.1.5. Оксиды мышьяка
- •15.3.1.6. Кислородсодержащие кислоты мышьяка и их соли
- •15.3.1.7. Оксиды сурьмы
- •15.3.1.8. Гидраты оксидов сурьмы и их соли
- •15.3.1.9. Кислородные соединения висмута (III)
- •15.3.1.10. Кислородные соединения висмута (V)
- •15.3.2. Галогениды
- •15.3.2.1. Галогениды азота
- •15.3.2.2. Галогениды фосфора
- •15.3.2.3. Галогениды мышьяка
- •15.3.2.4. Галогениды сурьмы
- •15.3.2.5. Галогениды висмута
- •15.3.3. Водородные соединения и их производные
- •15.3.3.1. Водородные соединения азота и их производные
- •15.3.3.2. Водородные соединения фосфора и их производные
- •15.3.3.3. Водородные соединения мышьяка, арсениды
- •15.3.3.4. Гидрид сурьмы, антимониды
- •15.3.3.5. Гидрид висмута
- •15.3.4. Серосодержащие соединения
- •15.3.4.1. Серосодержащие соединения азота
- •15.3.4.2. Сульфиды фосфора
- •15.3.4.3. Сульфиды мышьяка
- •15.3.4.4. Сульфиды сурьмы
- •15.3.4.5. Сульфиды висмута
- •15.4. Комплексные и элементоорганические соединения элементов 15-й группы
- •15.4.1. Комплексные соединения
- •15.4.2. Элементоорганические соединения
- •15.5. Биологическая роль элементов 15-й группы
15.3.1.9. Кислородные соединения висмута (III)
Для висмута наиболее характерна степень окисления +3 (см. табл. 15.5).
Оксид висмута (III) Bi2O3, в отличие от оксидов такого же состава других членов 15-й группы ПС, никто не называет «ангидридом», поскольку он не проявляет ни кислотных, ни даже амфотерных, а только основные свойства.
Оксид Bi2O3 - вещество желтого цвета. Его получают прокаливанием нитратов, окислением металлического Bi, термолизом различных органических соединений висмута (III): ацетатов, b-дикетонатов, комплексонатов, а также МОС.
Задача получения Bi2O3 приобрела в последнее время особое значение в связи с обнаружением свойств высокотемпературных сверхпроводников (ВТСП) у сложных оксидных материалов, содержащих BiIII, например, у керамики состава Bi2Ca2Sr2Cu3Ox. Тонкие и толстые пленки, а также компактные образцы сложных оксидов такого типа можно получать путем термолиза выделенных из раствора полиядерных комплексных соединений, в которых полидентатные лиганды статистически связывают атомы различных элементов-металлов. Для той же цели используется газофазный термолиз летучих соединений, например МОС и летучих хелатных комплексов (слабое межмолекулярное взаимодействие). Успешно используются при газофазном термолизе для получения сложных оксидных пленок трифенилвисмут BiPh3 (см. разд. 15.4.2), а также карбоксилаты (например, ацетаты и пивалаты, оказавшиеся летучими при нагревании уже до 2000С) и b-дикетонаты BiIII. Нагревание паров таких соединений примерно до 3000С вызывает их превращение в Bi2O3. Интересно, что аналогичные соединения SbIII сублимируются при более низкой температуре, но и термолиз соединений сурьмы с превращением в Sb2O3 в присутствии О2 наступает при более низкой температуре (на 50 – 1000С), чем у таких же соединений BiIII.
Исследования Bi-содержащей керамики со свойствами ВТСП, проводимые сейчас в различных лабораториях мира, показали, что такая керамика относится к классу сложных оксидов, а не висмутитов, содержащих BiIII в оксоанионе, т.е., как и следовало ожидать, учитывая большие размеры атома Bi, нежели Sb, в таких материалах BiIII амфотерности не проявляет.
С растворами щелочей Bi2O3 практически не взаимодействует, а сплавление со щелочью и оксидами других элементов-металлов не сопровождается образованием солей, содержащих висмут в оксоанионе. В кислотах Bi2O3 быстро растворяется, образуя соли, содержащие катион Bi3+, например, нитрат Bi(NO3)3 и хлорид BiCl3.
Гидроксид висмута (III) Bi(OH)3 проявляет только основные свойства. Получить Bi(OH)3 можно, добавляя щелочь к раствору нитрата или хлорида висмута (растворы солей висмута обычно подкисляют, чтобы устранить гидролиз и выпадение осадка основных солей):
Bi(NO3)3 + 3NaOH = Bi(OH)3¯ + 3NaNO3.
Выпадает белый, типично «гидроксидный» студенистый осадок Bi(OH)3. Если разделить его на две части и к одной добавить избыток щелочи, к другой - избыток кислоты, то видно, что осадок растворяется только в кислоте:
Bi(OH)3 + 3HNO3 = Bi(NO3)3 + 3Н2О.
Таким образом, гидроксид BiIII не проявляет амфотерных свойств: оксоанионы типа ВiO33– (висмутит-ионы) или гидроксоанионы типа [Bi(OH)4]¯, [Bi(OH)6]3– не образуются. Однако в другие реакции комплексообразования, в том числе с переходом в анионные комплексы типа [BiO4]¯, [Bi(NO3)6]3–, висмут вступает охотно.
Гидроксид BiIII может проявлять как окислительные, так и восстановительные свойства. При действии сильных окислителей, например персульфата калия, висмут повышает свою степень окисления, и образуется висмутат:
Bi(OH)3 + 3КОН + K2S2O8 = КВiO3 + 2K2SO4 + 3Н2О.
Сильные восстановители, например, соединения олова (II), выделяют из гидроксида висмута металл:
2Bi(OH)3 + 3Na2[Sn(OH)4] = 2Bi¯ + 3Na2[Sn(OH)6].
Соли висмута (III), как уже упомянуто, содержат BiIII только в катионе. Наиболее распространены соли BiIII - нитрат и хлорид.
Нитрат висмута Bi(NO3)3 кристаллизуется из кислых растворов в виде пентагидрата Bi(NO3)3×5Н2О. Хлорид BiCl3 выпадает в виде белого осадка при действии царской водки на металлический Bi.
Соединения висмута (III) и сурьмы (III) обнаруживают разницу в строении.
Например, в ацетатах SbIII и BiIII, как видно из рис. 15.5, все ацетогруппы являются прежде всего бидентатно-циклическими, т.е. оба атома кислорода каждой из трех карбоксильных групп в Bi(CH3COO)3 и в Sb(CH3COO)3 принадлежат «собственному» атому BiIII или SbIII. Однако одновременно часть карбоксильных групп ацетат-ионов выполняют мостиковую функцию, координируясь соседними атомами BiIII и SbIII и проявляя, таким образом, в сумме три- и даже тетрадентатность. При этом в структуре Sb(CH3COO)3 только одна ацетогруппа (из трех «формульных») тридентатна, а в структуре Bi(CH3COO)3 одна ацетогруппа бидентатна, одна - тридентатна и одна - тетрадентатна. В результате КЧ висмута в его ацетате равно 9, а КЧ сурьмы только 7. Длины связей Bi-ОАЦЕТАТ в четырехчленном цикле, образовавшемся в результате координации бидентатной циклической ацетогруппы, меньше различаются по величине, чем в ацетате сурьмы. Так, в ацетате висмута более длинные расстояния составляют 2,65 Å, тогда как более короткие - 2,18 - 2,35 Å, а в структуре Sb(CH3COO)3 короткие расстояния равны 2,03 - 2,06 Å, а длинные - 2,65 - 2,79 Å.
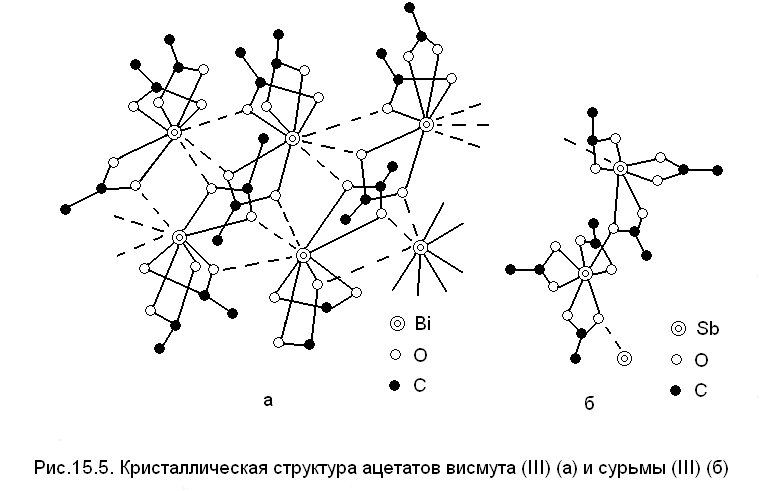
Таким образом, налицо дифференциация длин двух связей, образуемых ацетогруппой с данным атомом SbIII, и, напротив, тенденция к нивелированию этих расстояний в ацетате BiIII. Несомненно, это указывает на более ионный характер связи Bi-ацетат, нежели связи Sb-ацетат. Неодинаковость расстояний Sb-О в координированной сурьмой ацетогруппе приближает последнюю к состоянию –COOH, характерному для протонированного карбоксила, где две связи С—О существенно различны; в депротонированном карбоксиле, входящем в состав карбоксилата ионной природы, обе эти связи выравнены: -COO¯
Гидролиз солей BiIII, несмотря на очевидный основный характер производных висмута(III), интенсивно протекает даже в сильнокислой среде. Так, если к нейтральному водному раствору лакмуса добавить немного Bi(NO3)3×5Н2О, лакмус мгновенно краснеет, обнаруживая кислую реакцию среды, а раствор мутнеет вследствие образования белого осадка основного нитрата висмута:
Bi(NO3)3 + 2Н2О = Bi(OH)2NO3¯ + 2HNO3.
Аналогично гидролизуется хлорид BiCl3:
BiCl3 + 2H2O = Bi(OH)2Cl¯+ 2HCl
Высушивание осадка основного хлорида висмута вызывает его превращение в оксохлорид состава BiOCl. Кипячение растворов солей BiIII доводит гидролиз «до конца», в результате выпадает белый осадок Bi(OH)3, в той или иной степени гидратированный.
О строении основных солей BiIII можно сказать примерно то же, что о таких же соединениях сурьмы (III), (см. разд. 15.3.1.8). Все они имеют полимерную структуру. Так, в водных нейтральных растворах висмут (III) находится в виде полимерных катионов [Bi6O6]6+, в гидратированной форме этот гексамер может быть представлен формулой [Bi6(OH)12]6+. По-видимому, ближе к истине вторая формула, поскольку трудно предположить полную депротонизацию координированных висмутом молекул Н2О и гидроксильных групп. Состав полимеров, существующих в щелочных растворах, предложено изображать как [Bi6O6(OH)3]3+. Очевидно, новые исследования уточнят картину. Интересно, например, выяснить, зависит ли состав гидроксоолигомеров от концентрации BiIII так, как это показано для ванадия (V) (см. разд. 5.3.1.1), или нет, а также, можно ли квалифицировать оксо- и гидроксополимеры BiIII как изополисоединения, аналогичные таковым у MoVI, WVI (см. разд. 6.3.1.1). Сейчас важно, однако, подчеркнуть, что только в случае висмута - тяжелого аналога элементов подгруппы мышьяка - можно говорить о химии катионов Э3+, существующих в водных растворах. Это важнейшее подтверждение основного характера соединений висмута (III).
