
- •Глава 15
- •15.1.2. Строение электронной оболочки, валентность, основные типы химических соединений
- •15.1.3. Нахождение в природе, изотопный состав
- •15.1.4. Краткие исторические сведения
- •15.2. Простые вещества
- •15.2.1. Азот
- •15.2.2. Фосфор
- •15.2.3. Мышьяк
- •15.2.4. Сурьма
- •15.2.5. Висмут
- •15.3. Сложные соединения элементов 15-й группы
- •15.3.1. Кислородные соединения
- •15.3.1.1. Оксиды азота
- •15.3.1.2. Кислородсодержащие кислоты азота и их соли
- •15.3.1.3. Оксиды фосфора
- •15.3.1.4. Кислородсодержащие кислоты фосфора и их соли
- •15.3.1.5. Оксиды мышьяка
- •15.3.1.6. Кислородсодержащие кислоты мышьяка и их соли
- •15.3.1.7. Оксиды сурьмы
- •15.3.1.8. Гидраты оксидов сурьмы и их соли
- •15.3.1.9. Кислородные соединения висмута (III)
- •15.3.1.10. Кислородные соединения висмута (V)
- •15.3.2. Галогениды
- •15.3.2.1. Галогениды азота
- •15.3.2.2. Галогениды фосфора
- •15.3.2.3. Галогениды мышьяка
- •15.3.2.4. Галогениды сурьмы
- •15.3.2.5. Галогениды висмута
- •15.3.3. Водородные соединения и их производные
- •15.3.3.1. Водородные соединения азота и их производные
- •15.3.3.2. Водородные соединения фосфора и их производные
- •15.3.3.3. Водородные соединения мышьяка, арсениды
- •15.3.3.4. Гидрид сурьмы, антимониды
- •15.3.3.5. Гидрид висмута
- •15.3.4. Серосодержащие соединения
- •15.3.4.1. Серосодержащие соединения азота
- •15.3.4.2. Сульфиды фосфора
- •15.3.4.3. Сульфиды мышьяка
- •15.3.4.4. Сульфиды сурьмы
- •15.3.4.5. Сульфиды висмута
- •15.4. Комплексные и элементоорганические соединения элементов 15-й группы
- •15.4.1. Комплексные соединения
- •15.4.2. Элементоорганические соединения
- •15.5. Биологическая роль элементов 15-й группы
15.3.1.8. Гидраты оксидов сурьмы и их соли
С у р ь м я н и с т а я к и с л о т а и а н т и м о н и т ы
Сурьмянистую кислоту Sb(OH)3, или H3SbO3, нельзя синтезировать путем прямой гидратации Sb2O3, так как этот оксид не растворяется в Н2О. Поэтому сурьмянистую кислоту получают гидролизом галогенидов сурьмы (III) и других растворимых в воде соединений SbIII или добавлением щелочи к растворам «солей» SbIII. Так, если к подкисленному водному раствору SbCl3 на холоду постепенно добавлять щелочь, то среди выпадающих в осадок продуктов гидролиза будет и сурьмянистая кислота.
В индивидуальном состоянии сурьмянистая кислота H3SbO3 [или основание Sb(OH)3?] не выделена. При попытке удалить «внешнесферную» воду из студенистого осадка Sb(OH)3 происходит дегидратация самой сурьмянистой кислоты с превращением ее в ангидрид Sb2O3, удерживающий то или иное количество «остаточной» Н2О (Sb2O3×nН2О).
Осадок сурьмянистой кислоты растворяется в избытке щелочи с образованием анионной формы SbIII, называемой антимонат (III), или антимонит-ионом, и, по-видимому, представляющей собой гидроксокомплекс:
Sb(OH)3
![]() [Sb(OH)6]3–
®
SbO33-
+ 3Н2О.
[Sb(OH)6]3–
®
SbO33-
+ 3Н2О.
Осадок Sb(OH)3 (и других продуктов гидролиза) растворяется и при добавлении НСl. Поэтому можно сделать вывод, что сурьмянистая кислота H3SbO3 ≡ Sb(OH)3 обладает амфотерными свойствами.
Антимонаты (III), содержащие сурьму (III) в анионе, легко гидролизуются, так как являются производными слабой (и непрочной) сурьмянистой кислоты. При осторожном добавлении к их щелочным растворам минеральных кислот можно получить сурьмянистую кислоту:
NaSbO2 + HCl + Н2О = Sb(OH)3¯ + NaCl
или, если трактовать антимонит как гидроксокомплекс, то по уравнению
Na[Sb(OH)4] + НСl = Sb(OH)3¯ + NaCl + Н2О.
Кроме антимонитов, полученных в растворах действием щелочи на сурьмянистую кислоту и, скорее всего, представляющих собой гидроксокомплексы, описаны также твердые антимониты, например, метаантимонит натрия NaSbO2×3H2O. Однако такие соединения представляют собой не соли, а сложные оксиды, в которых нет локализованных оксоанионов (аналогия с антимонатами, содержащими SbV, см. ниже).
Соли, образующиеся при растворении сурьмянистой кислоты в кислотах, например в НСl, содержат сурьму (III) в катионе. То же относится к продуктам неполного гидролиза галогенидов SbIII
Поскольку соли, содержащие сурьму (III) в катионе, даже в кислых средах гидролизованы, состав их изображают, привлекая представление об антимонил-радикале. В простейшем случае это хлорид антимонила (SbO)Cl, сульфат антимонила (SbO)2SO4, нитрат антимонила (SbO)NO3 и т. д. В действительности состав и строение оксосолей сурьмы намного сложнее. Состав оксогалогенидов отвечает следующим формулам: Sb4O5Cl2, [Sb8O8(OH)4][(OH)2-x(Н2О)1+x]Cl2+x, Sb8О10(OH)2Cl2. Предполагавшееся в старых работах существование антимонил-радикала Sb=O в роли однозарядного катиона [SbO]+ не нашло структурных подтверждений. Как и в других случаях (например, титанил [TiO]2+, цирконил [ZrO]2+-ионы, см. разд. 4.3.3), твердые оксосоли типа SbOCl, SbONO3 вероятнее всего имеют полимерное строение, предполагающее наличие мостиков —Sb—О—Sb—О—, а в растворах существуют в виде гидроксосоединений типа [Sb(OH)2(OH2)6]+, в той или иной мере (в зависимости от условий) полимеризованных за счет оловых связей.
Сейчас методом структурного анализа доказано, что в твердых оксохлоридах локальных фрагментов [SbO]+ нет, а существуют протяженные слои [Sb—O]x, где каждый атом сурьмы связан с тремя или четырьмя атомами кислорода. Слои отделены друг от друга слоями атомов хлора (или других галогенов).
Однако все же оксогалогениды и другие оксосоли SbIII - одно из проявлений катионной формы существования сурьмы (III), а наличие таких солей является доказательством существенного нарастания основных свойств по сравнению с мышьяком (III), у которого таких форм нет.
Собственно ион Sb3+ (негидролизованный) предполагается лишь в сульфате Sb2(SO4)3, полученном при действии концентрированной H2SO4 на металлическую сурьму:
2Sb + 6H2SO4 = Sb2(SO4)3 + 3SO2 + 6H2O.
Однако очевидно, что негидратированный и негидролизованный ион Sb3+ может существовать только в отсутствие воды. Вода неизбежно вызывает гидратацию и затем гидролиз с образованием оксо- и гидроксосульфатов. Поэтому нормальный акваион [Sb(OH2)6]3+ или [Sb(OH2)4]3+ превратится (формально) в антимонил-ион [SbO]+×aq (или [Sb(OH)2]+×aq). Если же в системе будет избыток SO42- ионов, получатся сульфатные комплексы типа [Sb(SO4)2]¯, поскольку у сурьмы (III) сильно выражены комплексообразующие свойства.
Как показывают структурные данные, в безводном сульфате Sb2(SO4)3 отсутствуют оксомостики гидролитического происхождения, но сурьма (III) сильно сшита кислородными атомами, принадлежащими анионам SO42- (рис. 15.4).
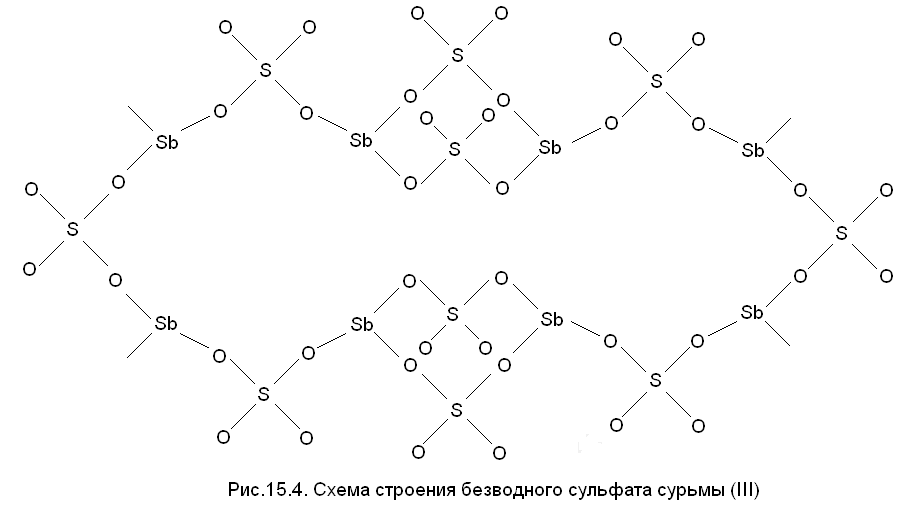
Из рис. 15.4 видно, что КЧ сурьмы в Sb2(SO4)3 равно 3 - это очень низкое значение по сравнению с КЧ других трехзарядных катионов сходного или даже меньшего размера, например, существенно меньший по размерам ион Аl3+ обычно имеет КЧ = 4 (радиус 0,39 Å) и даже КЧ = 6 (радиус 0,53 Å). Главной причиной низкого КЧ сурьмы (III) в его сульфате при радиусе 0,76 Å может быть только ковалентный характер взаимодействия Sb-О. Поэтому «солью» это соединение SbIII можно назвать только условно.
Не только кислотно-основные, но и окислительно-восстановительные свойства SbIII выражены слабо:
Sb2O3 + 6Н+ + 6ē = 2Sb + 3Н2О (E0 = 0,152 В),
[сурьма (III) как окислитель]
Sb2O5,ТВ + 6Н+ + 4ē = 2SbO+ + 3Н2О (E0 = 0,588 В)
[сурьма (III) как восстановитель].
В частности, сурьмянистая кислота и ее соли - антимониты - не проявляют восстановительных свойств, характерных для аналогичной по составу фосфористой кислоты и ее солей.
С у р ь м я н а я к и с л о т а и а н т и м о н а т ы
Сурьмяная кислота H3SbO4 - белый порошок, плохо растворимый в воде, но водный раствор лакмуса краснеет в присутствии Sb2O5, что свидетельствует о переходе H3SbO4 в раствор. Формула H3SbO4 условна прежде всего в том смысле, что сурьмяная кислота всегда гидратирована, и содержание воды в ней колеблется в зависимости от условий синтеза. Иногда ее состояние описывают равновесием:
Sb2O5×nH2O¯ D H[Sb(OH)6] (в растворе).
Для последней формы константа кислотной диссоциации равна 4,0×10−5.
Сурьмяная кислота проще всего получается гидролизом галогенидов сурьмы (V). Другой путь синтеза - окисление Sb2O3 концентрированной HNO3 (см. разд. 15.3.1.7).
Соли сурьмяной кислоты - антимонаты (V), или просто антимонаты, получают, растворяя Sb2O5 в щелочи:
H3SbO4 + 3NaOH = Na3SbO4 + 3Н2О.
В зависимости от условий синтеза (в растворе) и способа выделения в твердом виде можно получить орто-(ЩЭ)3SbO4, пиро-(ЩЭ)2Sb2O7 и мета-(ЩЭ)SbO3 антимонаты. Метаантимонаты получают, кроме того, сплавляя металлическую сурьму с KNO3.
При действии на метаантимонат KSbO3 воды образуется пироантимонат (точнее, дигидропироантимонат калия)
2KSbO3 + Н2О = K2H2Sb2О7.
Это соединение (кристаллизуется с 6Н2О) известно как реактив для аналитического определения Na+ в водных растворах.
Мы использовали здесь общепринятый способ изображения формул антимонатов, предполагающий сходство их строения (оксоанионы) с фосфатами. Однако структурные исследования показали, что такой аналогии нет. Строение дигидропироантимоната состава Na2H2Sb2O7-5H2O описывается формулой гидроксокомплекса Na[Sb(OH)6]. Это соединение имеет структуру типа NaCl, где позиции Сl¯-ионов занимают гексагидроксокомплексы [Sb(OH)6]¯.
Другой пример - гидратированный метаантимонат магния, имеющий эмпирическую формулу Mg(SbO3)2×12Н2О. Оказалось, что структура этого соединения, как и многих других гидратов антимонатов, также содержит фрагмент [Sb(OH)6]¯, и состав соли можно записать как [Mg(OH2)6][Sb(OH)6]2.
«Фосфатоподобные» формулы антимонатов типа NaSbO3 можно приписать только антимонатам, синтезированным по «твердофазной» методике, например сплавлением оксидов сурьмы и карбоната другого элемента-металла:
Sb2O3 + Na2CO3 + О2 2NaSbO3 + СО2.
Для их получения пригоден также способ дегидратации «антимонатов», выделенных из водной среды:
Na[Sb(OH)6] NaSbO3 + 3H2O.
Однако структурные исследования показали, что «твердофазные» безводные антимонаты, как и твердофазные антимониты, принадлежат к сложным оксидам, а не солям. Так, структуру метаантимоната NaSbO3 можно представить как гексагональную плотнейшую упаковку атомов кислорода, где атомы ЩЭ и Sb занимают треть октаэдрических пустот. Таким образом, сурьма (V) в этих соединениях не выполняет функций элемента, образующего оксоанион, т.е. сурьма (V), в отличие от азота (V), фосфора (V) и мышьяка (V), ведет себя как элемент-металл, способный к комплексообразованию, но недостаточно электроотрицательный для того, чтобы сформировать соли с оксоанионом - производные от «настоящей» сурьмяной кислоты H3SbO4.
