
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
8.2. Основы химической термодинамики
8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
Термодинамика - это наука, изучающая переходы энергии из одной формы в другую и от одной части системы к другой при протекании различных процессов. Раздел термодинамики, изучающий системы, в которых происходят химические реакции и фазовые переходы, называется химической термодинамикой.
Для характеристики состояния системы термодинамика использует так называемые термодинамические функции, к которым относятся внутренняя энергия (U), энтальпия (H), энтропия (S), свободная энергия Гиббса (G), свободная энергия Гельмгольца (F) и химический потенциал (μ). Общим для термодинамических функций является то, что все они являются функциями состояния. Изменение термодинамических функций зависит только от начального и конечного состояния системы и не зависит от пути, по которому протекает данный процесс. Остановимся на характеристике первых двух термодинамических функций.
Внутренняя энергия (U) - это совокупность всех видов энергии термодинамической системы, кроме кинетической энергии ее движения как целого и потенциальной энергии ее положения в каком-либо внешнем поле.
Частями внутренней энергии является энергия движения тел, образующих систему, энергия движения молекул, атомов, ионов, электронов, внутриядерная энергия и т.д. Поскольку во внутреннюю энергию входят все виды энергии, заключенные в материи, в том числе и те, о которых мы ничего не знаем, абсолютные значения внутренней энергии не могут быть определены. Однако можно определить изменение внутренней энергии в результате какого-либо процесса:
ΔU = U2 - U1 (8-2)
где U1 и U2 - внутренняя энергия процесса в начальном и конечном состояниях системы.
Пусть система представляет собой сосуд, в котором свободно движется поршень, оказывающий на газ, находящийся внутри сосуда, давление р. В системе протекают процессы, сопровождающиеся выделением или поглощением теплоты. Если эти процессы являются химическими реакциями или фазовыми переходами, то количество теплоты, поглощаемое системой, называется тепловым эффектом реакции или фазового перехода (Q). Реакции, протекающие с поглощением тепла (Q > 0), называются эндотермическими, с выделением тепла (Q < 0) - экзотермическими. Если поршень в сосуде движется свободно, процесс протекает при постоянном давлении (изобарный процесс с тепловым эффектом Qp); если поршень фиксирован, процесс осуществляется при постоянном объеме (изохорный процесс с тепловым эффектом QV) (рис. 49).
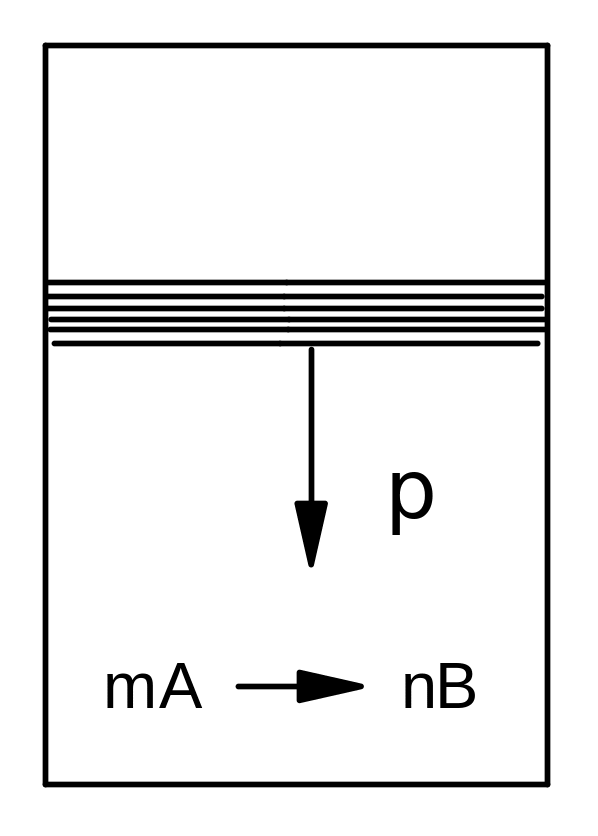
Рис. 49. Осуществление изобарного и изохорного процесса
Пусть в системе имеет место эндотермическая реакция (Q > 0). В этом случае поглощенная системой теплота может израсходоваться на увеличение внутренней энергии системы на величину ΔU и на совершение работы А против внешних сил (например, на поднятие поршня). В соответствии с законом сохранения энергии
Q = ΔU + A (8-3)
или
ΔU = Q - А (8-4)
Уравнение (8-4) является математическим выражением первого закона термодинамики:
В любом процессе увеличение внутренней энергии системы равно количеству теплоты, сообщенной системе, минус количество работы, совершенной системой против внешних сил.
Естественно, значения ΔU и А могут быть как положительными, так и отрицательными; в последнем случае внутренняя энергия системы понижается, а внешние силы совершают определенную работу.
Совершаемую системой работу можно представить как сумму двух величин:
А = А(р) + А΄
где А(р) - работа, совершенная против внешнего давления, А΄ - все другие виды работы (например, работа, связанная с электрическим или магнитным полем). Рассмотрим случай, когда А΄ = 0. Тогда
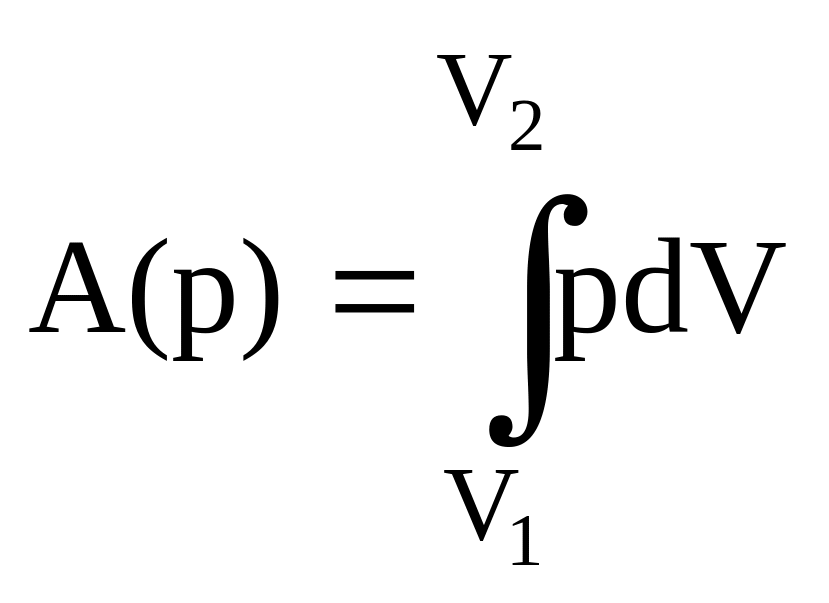
Если реакция протекает при постоянном объеме, то V1 = V2 и А(р) = 0, откуда в соответствии с (8-3)
QV = ΔU
Тепловой эффект изохорного процесса равен изменению внутренней энергии системы.
Если в процессе реакции постоянным остается давление, то
![]() ,
,
а
Qp = ΔU + pΔV (8-5)
Подставив в уравнение (8-5) значения ΔU и ΔV, имеем:
Qp = (U2 - U1) + p(V2 -V1) = (U2 + pV2) - (U1 + pV1)
или
Qp = H2 - H1 = ΔH , (8-6)
где
H = U + pV (8-7)
- термодинамическая функция, называемая энтальпией. Таким образом, тепловой эффект изобарного процесса равен изменению энтальпии системы.
Отметим, что энтальпия, как и внутренняя энергия, является функцией состояния и определяется лишь начальным и конечным состоянием системы, но не зависит от пути, по которому протекает процесс. Поскольку в выражение (8-7) входит внутренняя энергия, абсолютное значение Н неопределимо. В связи с тем, что химические реакции часто проводят при постоянном давлении, энтальпия широко используется для выражения тепловых эффектов.
