
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
Используя концепцию двухэлектронных локализованных связей, можно построить структурные формулы большинства ковалентных соединений. Однако полученный результат не всегда достаточно хорошо согласуется с экспериментальными данными для соответствующих частиц, в связи с чем представление о связях, соединяющих два атома пришлось дополнить представлениям о связях, объединяющих три, четыре и более атомов. Подобные связи получили название делокализованных многоцентровых связей.
Рассмотрим вопрос об образовании многоцентровых связей на примере строения карбонат-аниона. Ион СО32- формально можно представить как результат соединения атома углерода, атома кислорода и двух однозарядных анионов кислорода, распределение электронов в которых показано ниже:
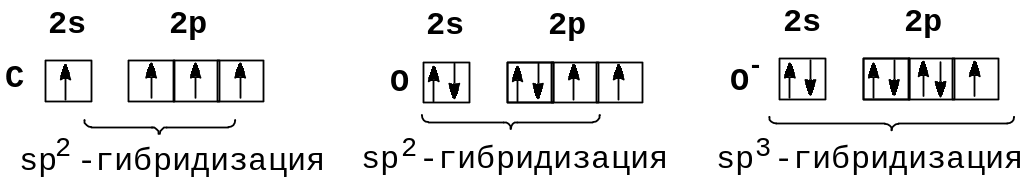
Определим строение карбонат-аниона, используя представление о локализованных двухцентровых связях. Для этого необходимо предположить, что атомы углерода и кислорода, не несущие заряда, подвергаются sp2-гибридизации, что позволяет им соединиться двойной связью; ионы О- в состоянии sp3-гибридизации образуют с углеродом лишь по одной -связи. В результате ион СО32- должен иметь форму равнобедренного треугольника, поскольку в образовавшейся частице двойная связь короче одинарных. В действительности же ион СО32- имеет форму равностороннего треугольника. Причиной наблюдаемого противоречия является произвольный выбор атома кислорода, присоединенного двойной связью. Действительно, иону СО32- отвечают три равноценные формы:
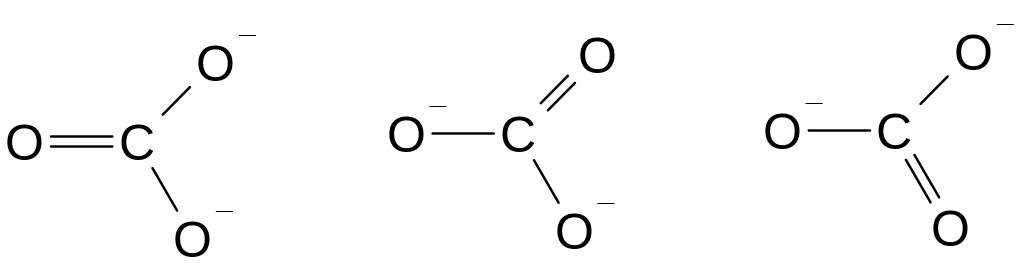
Подобные формы принято называть каноническими. Картина, отвечающая истинному строению иона СО32- не соответствует ни одной из этих структур; согласующийся с экспериментальными данными результат можно получить, если предположить, что в карбонат-ионе происходит одновременное перекрывание четырех pz-орбиталей (если частица расположена в плоскости ху) всех атомов кислорода и атома углерода, приводящее к образованию четырехцентровой -связи, охватывающей всю частицу. Делокализованную -связь обозначают пунктиром. Одновременно происходит делокализация отрицательного заряда на все атомы кислорода, в результате чего строение СО32- выражается следующей формулой :
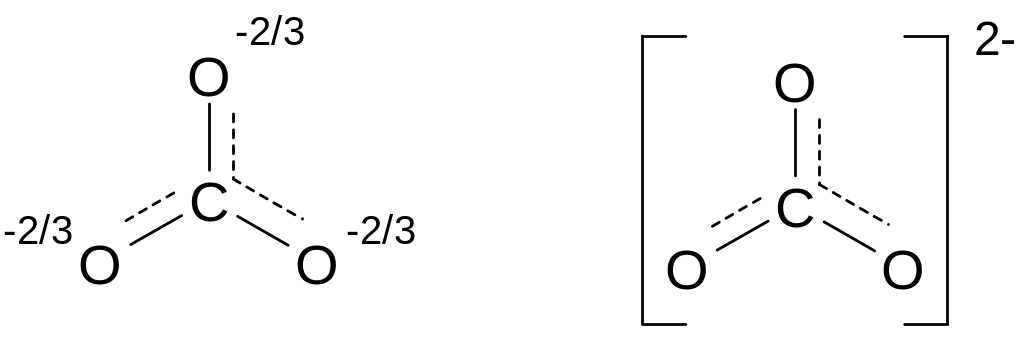
Теория многоцентровых связей была разработана Л.Полингом и получила название теории резонанса.
Пусть частице отвечают канонические формы I, II и III, отличающиеся распределением одинарных, двойных и тройных связей, а также зарядов на атомах; эти канонические формы описываются волновыми функциями I,II и III, энергии которых составляют ЕI, EII и EIII. Методами квантовой механики можно доказать, что энергии ЕI, EII и EIII будут всегда больше, чем энергия состояния, волновая функция которого является линейной комбинацией волновых функций I,II и III.
' = с1I + c2II + c3III (5-10)
Выше отмечалось, что волновая функция тем лучше описывает систему, чем меньше соответствующая ей энергия. В силу этого функции ' следует отдать предпочтение сравнительно с волновыми функциями отдельных канонических форм. Наложение отвечающих им структур получило название резонанса. Волновую функцию, описывающую резонансную структуру, называют резонансно-гибридной, а разность энергий между энергиями форм I-III и энергией резонансно-гибридной функции - энергией резонанса. Чем больше энергия резонанса для той или иной канонической формы, тем больший вклад вносит волновая функция этой формы в уравнение резонансно-гибридной волновой функции (5-10).
Существует несколько правил, позволяющих выбрать канонические формы, вносящие значительный вклад в резонансно-гибридную функцию.
1. Положение ядер во всех канонических формах должно быть одинаковым. Изомеры, в том числе и таутомеры, не являются каноническими формами.
2. Канонические формы должны иметь максимальное число связей.
3. В канонических формах не должны соседствовать атомы с одноименными зарядами.
4. Канонические формы должны иметь одинаковое число неспаренных электронов (при наличии последних).
Так, например, для молекулы оксонитрида азота N2O можно записать шесть канонических форм:
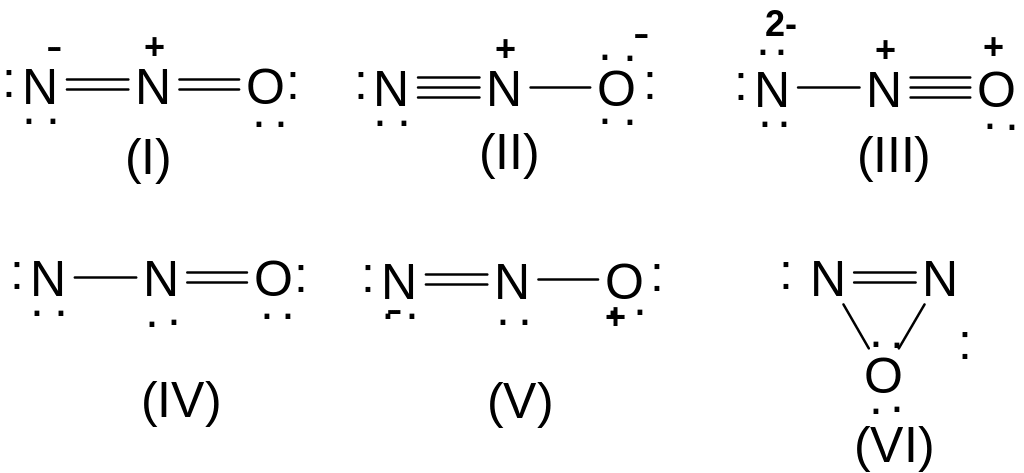
Однако реальный вклад в гибридно-резонансную функцию будут вносить только формы I и II; форма III запрещена правилом 3, формы IV и V - правилом 2, форма IV - правилом 1.
Основной вывод к которому приводит теория резонанса, может быть сформулирован следующим образом : реальная структура частицы является наложением структур ее канонических форм.
