
- •Э.А. Гюннер, в.Ф. Шульгин общая химия
- •Введение Предмет и структура химии
- •1. Химическая атомистика
- •1.1. Основные положения и понятия химической атомистики
- •1.2. Стехиометрические законы химии
- •1.3. Методы определения молекулярных масс и атомных масс
- •Методы определения молекулярных масс.
- •1.3.2. Методы определения атомных масс.
- •2. Основы теории строения атома
- •2.1. Предпосылки возникновения квантово-механической теории
- •2.2. Постулаты квантово-механической теории
- •2.3. Волновая функция. Уравнение Шредингера
- •2.4. Атом водорода. Одноэлектронные атомарные ионы
- •2.5. Многоэлектронные атомы
- •3. Периодический закон д.И. Менделеева в свете квантово-механических представлений
- •3.1. Современная формулировка Периодического закона
- •3.2. Структура периодической системы элементов: периоды, группы, подгруппы элементов
- •3.3. Закономерности изменения свойств элементов в периодах и подгруппах периодической системы
- •3.3.1. Эффективный заряд ядра.
- •3.3.2. Атомные радиусы.
- •3.3.3. Энергия ионизации.
- •3.3.4. Сродство к электрону.
- •3.3.5. Электроотрицательность.
- •3.3.6. Степени окисления элементов.
- •3.4. Элементы-аналоги. Виды аналогии в периодической системе элементов
- •3.4.1. Групповая аналогия.
- •3.4.2. Типовая аналогия.
- •3.4.3. Электронная аналогия.
- •VI группа I группа
- •3.4.4. Слоевая аналогия.
- •3.4.5. Контракционная аналогия (шринк-аналогия).
- •3.4.6. Горизонтальная аналогия.
- •3.4.7. Диагональная аналогия.
- •4. Атомное ядро. Радиоактивность
- •4.1. Элементарные частицы
- •4.2. Теория строения атомных ядер
- •4.3. Ядерные реакции
- •4.4.Радиоактивность. Типы радиоактивного распада
- •4.5. Законы радиоактивного распада
- •4.6. Естественная радиоактивность. Радиоактивные ряды. Радиоактивное равновесие
- •4.7. Искусственная радиоактивность. Изотопная индикация
- •4.8. Новые химические элементы
- •4.9. Эволюция элементов во Вселенной
- •5. Химическая связь и строение молекул
- •5.1. Химическая связь. Параметры химической связи. Валентность
- •5.2. Метод валентных связей
- •5.2.1. Основные принципы метода валентных связей.
- •5.2.2. Насыщаемость ковалентной связи. Механизм образования двухцентровой связи.
- •5.2.3. Направленность ковалентной связи. Гибридизация электронных орбиталей.
- •5.2.4. Кратность ковалентной связи.
- •5.2.5. Делокализованные многоцентровые связи. Теория резонанса.
- •5.2.6. Предсказание геометрической формы молекул.
- •5.2.7. Неполярные и полярные связи. Типы ковалентных молекул.
- •5.2.8. Недостатки метода валентных связей.
- •5.3. Метод молекулярных орбиталей
- •5.3.1. Основные принципы метода молекулярных орбиталей.
- •5.3.2. Применение метода молекулярных орбиталей.
- •5.3.2.1. Двухатомные молекулы.
- •5.3.2.2. Молекулы, состоящие из трех и более атомов.
- •5.4. Ионная связь
- •5.4.1. Особенности ионной связи. Свойства ионных соединений.
- •5.4.2. Типы кристаллических решеток ионных соединений. Ионные радиусы.
- •5.3.3. Энергия ионной кристаллической решетки.
- •5.4.4. Поляризация ионов.
- •5.5. Металлическая связь. Зонная теория кристаллов
- •5.6. Межмолекулярное взаимодействие
- •5.7. Водородная связь
- •6. Координационные соединения
- •6.1. Координационные соединения. Основные положения координационной теории
- •6.2. Классификация координационных соединений
- •6.3. Номенклатура координационных соединений
- •6.4. Изомерия координационных соединений
- •6.5. Химическая связь в координационных соединениях
- •6.5.1. Метод валентных связей
- •6.2. Теория кристаллического поля
- •6.3. Метод молекулярных орбиталей
- •6.7. Реакции внешнесферного и внутрисферного замещения. Принцип транс-влияния
- •7. Агрегатные состояния вещества
- •7.1. Типы агрегатного состояния
- •7.2. Твердое состояние вещества
- •7.2.1. Кристаллическое состояние.
- •7.2.2. Аморфное состояние.
- •7.3. Жидкое состояние вещества
- •7.4. Газообразное состояние вещества
- •7.5. Плазма
- •8. Теория химических процессов
- •8.1. Предмет и основные понятия теории химических процессов
- •8.2. Основы химической термодинамики
- •8.2.1. Термодинамические функции. Внутренняя энергия и первый закон термодинамики. Энтальпия.
- •8.2.2. Термохимия. Закон Гесса.
- •8.2.3. Энтропия. Второй и третий законы термодинамики.
- •8.2.4. Свободная энергия Гиббса. Направление химического процесса.
- •8. Химическая кинетика
- •8.3.1. Предмет химической кинетики. Скорость химической реакции. Энергия активации.
- •8.3.2. Факторы, влияющие на скорость химической реакции. Катализаторы и катализ.
- •8.3.3. Кинетическая классификация реакций.Молекулярность и порядок реакции. Механизмы реакций.
- •8.3.4. Некоторые типы многостадийных реакций.
- •8.4. Химическое равновесие
- •8.4.1. Обратимые и необратимые реакции. Состояние химического равновесия.
- •8.4.2. Смещение химического равновесия.
- •9. Растворы
- •9.1. Общая характеристика растворов
- •9.2. Разбавленные растворы неэлектролитов. Коллигативные свойства растворов
- •9.3. Растворы электролитов
- •9.3.1. Электролиты. Теория электролитической диссоциации (ионизации).
- •9.3.2. Теория растворов слабых электролитов.
- •9.3.2.1. Степень ионизации слабых электролитов и методы ее определения.
- •9.3.2.2. Равновесия в растворах слабых электролитов.
- •6,5·10-4 Моль/л
- •9.3.3. Теория сильных электролитов.
- •9.3.4. Обменные реакции в растворах электролитов.
- •9.3.4.1. Типы обменных реакций в растворах электролитов.
- •9.3.4.2. Гидролиз солей.
- •9.3.5. Теории кислот и оснований.
- •9.3.6. Окислительно-восстановительные реакции в растворах.
- •9.3.6.1.Общая характеристика окислительно-восстановительных реакций.
- •9.3.6.2. Составление уравнений окислительно-восстановительных реакций.
- •9.3.6.3. Электродные потенциалы. Направление окислительно-восстановительных реакций. Гальванический элемент.
- •9.3.6.4. Электролиз.
- •9.4. Коллоидные растворы
- •9.4.1. Общая характеристика коллоидных растворов и методы их получения.
- •9.4.2. Строение коллоидных частиц.
- •9.5. Твердые растворы
- •Список рекомендуемой литературы
5.3.2.2. Молекулы, состоящие из трех и более атомов.
Одной
из простейших трехатомных молекул
является молекула гидрида бериллия.
Применим метод МО для описания ее
строения. Пусть ядра атомов Be,
Ha
и Hb
лежат на оси z,
которая для атомов бериллия и На
направлена слева направо, для Hb
- справа налево. Атомный базис для
конструирования МО в данном случае
будет включать 6 АО (2s,
2px,
2py
и 2pz
от атома бериллия, 1sa
и 1sb
от двух атомов водорода). При этом
1s-орбитали
атомов водорода будут перекрываться
как с 2s-,
так и с 2pz-орбиталями
бериллия, тогда как орбитали 2px
и 2py
перейдут в молекулу как несвязывающие
орбитали
![]() .
Из орбиталей 2s,
2pz,
1sa
и 1sb
могут быть построены следующие МО:
.
Из орбиталей 2s,
2pz,
1sa
и 1sb
могут быть построены следующие МО:
sсв = 2s + 1sa + 1sb
sp = 2s - 1sa - 1sb
zсв = 2px - 1sa + 1sb
zр = 2pz + 1sa - 1sb
Граничные поверхности и энергетическая диаграмма полученных молекулярных орбиталей ВеН2 приведены на рис. 26 и 27,а. Распределение четырех валентных электронов на связывающих МО приводит к электронной формуле (sсв)2(zсв)2, подтверждающей возможность существования молекулы ВеН2.
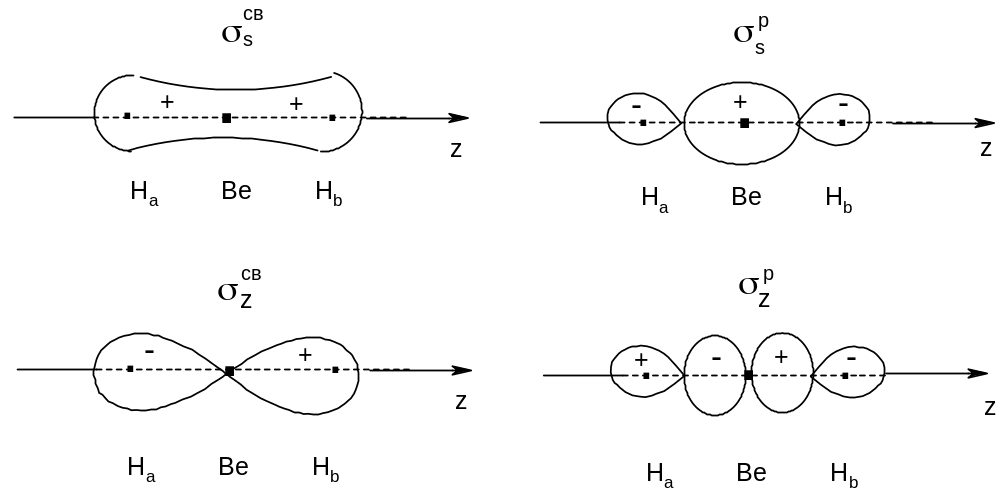
Рис. 26. Граничные поверхности связывающий и разрыхляющих орбиталей
молекулы гидрида бериллия - BeH2
В ряде случаев при конструировании МО используют не "чистые", а гибридные атомные орбитали, что обычно упрощает задачу; тип гибридизации и форма молекулы при этом могут быть установлены по методу Гиллеспи (раздел 5.2.6.). Так для молекулы ВеН2 имеет место spz-гибридизация; комбинирование двух sp-гибридных орбиталей Ве с 1s-орбиталями атомов водорода приводит к образованию двух одинаковых spсв и двух spp орбиталей (рис. 27,б). Валентные электроны занимают связывающие МО, в результате чего молекуле ВеН2 отвечает электронная формула (spсв)4. Такой подход хорошо объясняет равноценность связей в молекуле гидрида бериллия.
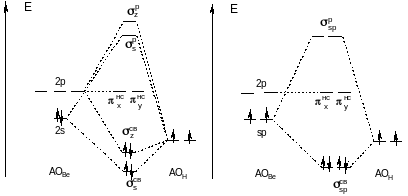
Рис. 27. Энергетическая диаграмма молекулярных орбиталей молекулы гидрида бериллия - BeH2 (а - без учета гибридизации, б - с учетом sp-гибридизации)
Используем рассматриваемый прием для описания четырехатомной молекулы аммиака, атом азота которой подвергается sp3-гибридизации, что обуславливает пирамидальную форму молекулы этого соединения. Пусть координатные оси z атомов водорода направлены по линиям связи NH от водорода к азоту, что обеспечивает максимальное перекрывание их с sp3-гибридными орбиталями атома азота. Атомный базис в этом случае будет включать четыре АО от азота и три АО от трех атомов водорода (На, Нb и Нс). Из орбиталей атомного базиса следует сконструировать 7 МО. Комбинирование трех sp3-гибридов азота с 1s-орбиталями атома водорода дает три связывающие и три разрыхляющие орбитали с уравнениями волновых функций типа:
sp3 = sp3 1si; (i-a,b,c)
Четвертый sp3-гибрид с орбиталями атома водорода не перекрывается и переходит в молекулу как несвязывающая молекулярная орбиталь. Энергетическая диаграмма молекулы NH3 и распределение на ней электронов показаны на рис. 28.
В пятиатомной молекуле метана атом углерода также подвержен sp3-гибридазации. В этом случае все гибридные орбитали принимают участие в образовании молекулярных орбиталей типа sp3 1s (четырех связывающих и четырех разрыхляющих). Восемь валентных электронов молекулы метана занимают все связывающие орбитали (рис. 29).
Метод молекулярных орбиталей позволяет объяснить существование соединений, в которых атом водорода связан с двумя атомами других элементов равноценными связями. Примером подобных частиц может служить дифторогидрогенат-анион - HF2-, линейный симметричный ион с одинаковыми межъядерными расстояниями F-H (113 пм). Существование такой частицы можно объяснить, предположив в ней образование трехцентровых молекулярных орбиталей из 1s-орбитали атома водорода и двух 2pz-орбиталей атома Fa и Fb.
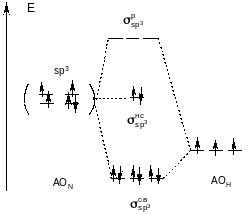
Рис. 28. Энергетическая диаграмма молекулы аммиака - NH3
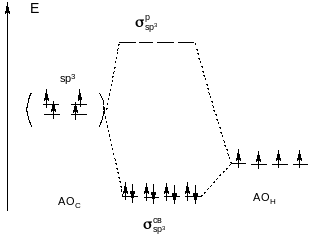
Рис. 29. Энергетическая диаграмма молекулы метана - СН4
В уравнения молекулярных орбиталей атомные орбитали 2pza и 2pzb могут входить в виде комбинаций 2pza 2pzb. Комбинация 2pza + 2pzb с 1s-орбиталью атома водорода дает связывающую орбиталь
св = 1s + (2pza + 2pzb)
и разрыхляющую орбиталь
p = 1s - (2pza + 2pzb)
Комбинация 2pza - 2pzb с орбиталью 1s не перекрывается и переходит в HF2- как несвязывающая орбиталь
нс = 2pza - 2pzb
Граничные поверхности сконструированных МО и энергетическая диаграмма иона HF2- приведены на рис. 30; валентные электроны заполняют св и нс-орбитали, что обеспечивает довольно высокую энергию связей F-H в дигидрогидрогенат-ионе (114,6 кДж/моль).
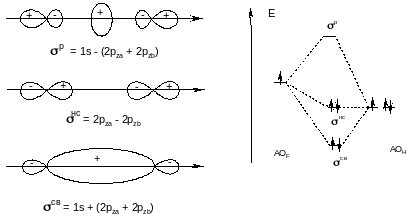
Рис. 30. Молекулярные орбитали и энергетическая диаграмма иона HF2-
В заключение следует отметить, что метод молекулярных орбиталей в настоящее время является наиболее широко используемым приемом описания химической связи.
