
Учебники / Конспекты по химии
.pdf
перенапряжения растворения кислорода полностью компенсирует разность потенциалов восстановительных полуреакций. Поэтому в щелочной среде железо не будет окисляться кислородом воздуха.
Рис. 76. Поляризационные кривые окисления железа растворенным в щелочном растворе кислородом
Представим полученные данные в виде сводки:
Среда |
Процесс коррозии железа |
|
|
Кислая |
Катодный процесс: 2H+ + 2e = H2 |
Анодный процесс:Fe = Fe2+ + 2e |
|
|
|
Нейтральная |
Катодный процесс: O2 + 2H2O + 4e = 4OH– |
Анодный процесс:Fe = Fe2+ + 2e |
|
|
|
Щелочная |
Железо устойчиво к коррозии |
|
|
Аналогичные рассуждения можно проделать и для других металлов. Кроме величин восстановительных потенциалов и перенапряжения необходимо при этом принимать во внимание способность металлов образовывать на поверхности плотные пассивирующие пленки оксидов, защищающих металл от дальнейшего воздействия окружающей среды. Для примера, на рис. 77 показано влияние кислотности среды на скорость коррозии некоторых металлов.
213
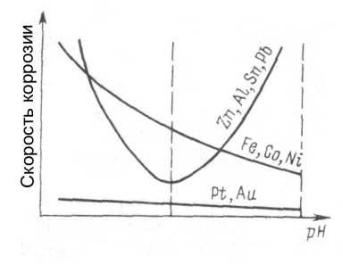
Металлы подгруппы железа – кобальт и никель, ведут себя подобно железу: они интенсивно корродируют в нейтральной и кислой средах.
Алюминий пассивируется в нейтральной среде, но амфотерный оксид алюминия реагирует как с кислотами, так и с основаниями, поэтому он максимально устойчив к коррозии в нейтральной среде.
Скорость коррозии благородных металлов практически равна нулю в любых средах.
Рис. 77. Зависимость скорости коррозии некоторых металлов от кислотности среды
Влияние посторонних веществ на скорость коррозии
В природе взаимодействие металлов происходит не с чистой водой, а с водой, в которой находятся растворенные примеси. Например, в природной воде содержатся соли натрия, кальция, магния, главным образом, в виде гидрокарбонатов. Углекислый газ, растворенный в воде, придает ей слабокислую среду (рН≈6). В городах и вблизи промышленных объектов дождевая и грунтовая вода может содержать множество других примесей. Поэтому для правильного понимания коррозии необходимо рассматривать коррозию в воде, содержащей примеси разной природы. Мы рассмотрим порознь влияние на скорость коррозии растворенных в воде катионов и анионов.
214

Влияние катионов. Катионы активных металлов влияния на коррозию не оказывают. К активным металлам относятся, прежде всего, катионы K+, Na+, Mg2+, Ca2+, Ba2+и др., гидрокарбонаты и гидроксиды которых сравнительно хорошо растворимы в воде.
Катионы неактивных металлов (Cu2+, Hg2+, Ag+, Au3+и др.) являются катализаторами коррозии железа и других металлов, таких как цинк или алюминий. Механизм катализа объясняется тем, что на поверхности железа осаждаются частицы неактивного металла:
Fe + Cu2+ = Fe2+ + Cu.
В результате осаждения частиц неактивного металла на поверхности металла образуются высокоэффективные микрогальванические элементы (рис. 78).
Рис. 78. Микрогальванические элементы на поверхности железа в растворе, содержащим ионы меди
Влияние анионов. Если анионы не образуют нерастворимых солей с ионами железа, то они повышают проводимость воды – сопротивление среды уменьшается и за счет этого коррозия ускоряется. Если анионы образуют с катионами железа нерастворимые соли (MnO4– , CrO42– , PO43– ), то они или замедляют процесс коррозии при образовании плотной пленки, или, если пленка рыхлая, не влияют на скорость коррозии.
Специфическое влияние на скорость коррозии оказывают ионы галогенов – F – , Cl– , Br– ,которые разрушают оксидную пленку на ме-
215
таллах и ускоряют процесс коррозии. Например, на алюминии плотная пассивирующая пленка защитного оксида алюминия преобразуется в пористую пленку проводящего оксохлорида алюминия:
Al2O3 + 2HCl = 2AlOCl + H2O.
Образующийся оксохлорид алюминия за счет высокой пористости хорошо удерживает воду, а благодаря проводящим свойствам он способен играть роль катода. Поэтому в присутствии ионов хлора коррозия алюминия очень сильно ускоряется. Процессы, происходящие в этом случае можно записатьследующим образом:
Катодный процесс:O2 + 2H2O + 4e = 4OH– . Анодный процесс: Al = Al3+ + 3e.
Коррозия реальных металлоконструкций
Все реальные металлы фактически являются сплавами, т. е. наряду с основным металлом в них содержатся металлические и неметаллические примеси. Металлы содержат неоднородности, которые принимают участие в процессе коррозии основного металла. Наиболее распространенной теорией (не означает – правильной) является теория электрохимической коррозии реальных металлоконструкций. В ее основе лежит положение о том, что причиной коррозии является возникновение на поверхности металла короткозамкнутых гальванических элементов той или иной природы. Протекание тока в таких элементах и определяет скорость коррозии металла. Ниже мы рассмотрим некоторые примеры образования гальванических элементов при коррозии металлов в водно-воздушной среде.
Сталь наряду с кристаллами железа содержит кристаллы цементита Fe3C. Кристаллы цементита при коррозии играют роль катода, кристаллы железа – роль анода.
Любые воздействия на материал могут привести к увеличению скорости коррозии. Например, если металлическую конструкцию изогнуть, в ней возникнут механические напряжения, неоднородно рас-
216

пределенные по поверхности металла. Так как свойства металла в деформированной и недеформированной областях различны, то такие области способны образовывать гальванические пары (рис. 79).
Рис. 79. Коррозия деформированного металла
Неоднородная структура металла создается и при локальном термическом воздействии на металл. Например, при сварке металлических конструкций вблизи сварного шва металл разогревается, и в нем происходят изменения строения. Примером является коррозия сварных швов в «нержавеющей» стали. Типичная нержавеющая сталь содержит 18 % Cr, 8 % Ni и от 0,1 до 0,2 % C. При 500 – 800 оС из кристаллов стали выделяется карбид хрома Cr23C6. Области между отдельными зернами, где выделился карбид хрома, обедняются хромом, в то время как состав зерен практически не изменяется. Структура стали становится неоднородной – в ней появляются катодные и анодные области (рис. 80).
Реальная среда часто является неоднородной. В результате электродные потенциалы разных частей конструкции оказываются различными. Возникающая разность потенциалов является движущей силой коррозии. Примеры неоднородной среды приведены на рис. 81.
Если поверхность жидкости, контактирующая с воздухом, невелика, в объеме электролита концентрация кислорода не постоянна по объему. Области, обогащенные кислородом, являются катодом. В этих областях происходит катодное восстановление кислорода.
217

Рис. 80. Схема коррозии стали вблизи сварного шва
Коррозия в неоднородной среде
Рис. 81. Коррозия в неоднородной среде
Блуждающие токи
Блуждающими токами называют токи, вызванные наличием внешней разности потенциалов в грунте и водоемах. Источниками блуждающих токов являются заземленные источники питания: железнодорожные и трамвайные пути, электрические подстанции и т. п. Например, большая часть электрического тока, идущего от работающего электротранспорта, идет к источнику тока по рельсу, но часть его идет также по грунту (рис. 82). Если на пути тока находится ме-
218
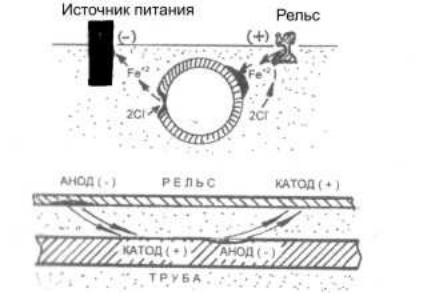
таллическая конструкция, например, труба, на ней возникает анодный участок, где происходит растворение железа и катодный участок, на котором выделяется водород.
Рис. 82. Схема коррозии железа под действием блуждающего тока
Потери от коррозии в результате действия блуждающих токов особенно велики в городских условиях. Для справки: блуждающий ток силой 1 А в течение года растворяет 9,2 кг железа.
Методы защиты от коррозии
Одним из наиболее эффективных методов защиты от коррозии является использование чистых металлов. Металлы высокой степени чистоты намного более устойчивы к коррозии, чем металлы, содержащие примеси. Например, высокочистое железо покрывается плотной пленкой оксида (пассивируется) и становится устойчивым к атмосферной коррозии. Однако этот метод защиты от коррозии дорогостоящий и поэтому используется крайне редко.
Наиболее распространенные методы защиты от коррозии основаны на изоляции поверхности металла с помощью искусственных пассивирующих слоев. В качестве пассивирующих слоев используют пленки оксидов и солей (фосфатов, хроматов), лаки, краски, пленки
219
металлов. Поверхность может быть также защищена применением специальных ингибиторов коррозии. Ниже мы рассмотрим некоторые приемы.
Лакокрасочные и полимерные покрытия
Нанесение лаков и красок относится к наиболее распространенному способу защиты поверхности металла от коррозии. Плотная, водонепроницаемая пленка краски или лака защищает поверхность металла до тех пор, пока в ней не появятся трещины или отслоения. При этом защитные свойства лакокрасочного покрытия легко восстанавливаются. Основной проблемой нанесения лаков и красок на металл является их плохое сцепление (низкая адгезия) друг с другом. Поэтому покрытию металла лаком или краской предшествуют стадии очистки поверхности от грязи, ржавчины и жиров. Затем на поверхность металла наносят грунтовое покрытие (праймер), которое химически взаимодействует с металлом, модифицируя его поверхность. Нанесение грунтового покрытия способствует улучшению сцепления краски с металлом. Защитное покрытие наносится на грунтовое покрытие.
Химические защитные покрытия
При создании химических защитных покрытий на поверхности металла с помощью химических реакций создают тонкую пленку устойчивого соединения, изолирующую металл от контакта с атмосферой. К наиболее распространенным способам создания защитных покрытий на сплавах железа относятся фосфатирование, азотирование и воронение.
Фосфатирование заключается в обработке железных сплавов в средах, содержащих фосфорную кислоту. Фосфорная кислота преобразует поверхностный слой оксидов железа в нерастворимые фосфаты железа:
Fe2O3 + 2H3PO4 = 2FePO4 + 3Н2О,
3FeO + 2H3PO4= Fe3(PO4)2 + 3Н2О.
220
Достоинство фосфатирования состоит в том, что слои фосфатов железа имеют хорошее сцепление с лакокрасочными покрытиями и его обычно применяют при подготовке поверхности к окраске.
Азотирование. Проводят при повышенной температуре, обрабатывая детали в атмосфере аммиака при высокой температуре. В процессе азотирования на поверхности железа образуется тонкий слой нитрида железа:
3Fe + 2NH3 = Fe3N2 + 3H2.
Слой нитрида железа обладает очень высокими защитными свойствами. Недостатком азотирования является высокая стоимость процесса. Кроме того, при контакте с водородом многие сплавы железа приобретают хрупкость. Поэтому азотирование используют не очень часто.
Оксидирование (воронение). Этим методом на сплаве железа выращивают плотный слой оксида железа (II–III). Для этого железное изделие обрабатывают горячим окислительным раствором с сильно щелочной реакцией. При 80 оС образуется плотная пленка оксида:
3Fe + 2O2 → Fe3O4.
Оксид, образующийся при воронении, обладает высокой твердостью и хорошими защитными свойствами. Поэтому воронение часто используют для защиты от коррозии тех деталей, которые не могут быть покрашены.
Защитные металлические покрытия. Для защиты металлов от коррозии часто используют нанесение защитных пленок металлов. Особенно часто защитные металлические покрытия наносят на сплавы железа (кровельное железо, консервные банки, кузова автомобилей). Различают два типа покрытий – катодное и анодное.
Катодное покрытие. В этом случае железо покрывают металлом с более положительным значением электродного потенциала. Рассмотрим, например, железо, на поверхность которого нанесена
221
пленка олова. Электродный потенциал олова (–0,14 В) больше электродного потенциала железа (–0,44 В). Олово образует пленку, полностью изолирующую железо от воздействия внешней среды. Однако если защитное покрытие повреждается, возникает гальваническая пара, в которой железо, как вещество с меньшим значением электродного потенциала, является анодом, а олово – катодом.
Соответствующие уравнения коррозионного процесса:
Катодный процесс (Sn):O2 + 2H2O + 4e = 4OH– .
Анодный процесс(Fe): Fe = Fe2+ + 2e.
В соответствии с уравнением процесса, при повреждении катодного покрытия коррозионному разрушению подвергается железо.
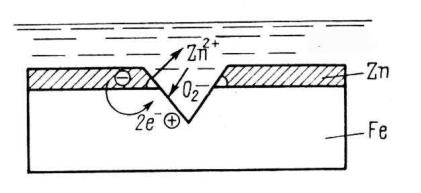
Анодное покрытие – это покрытие железа металлом с более отрицательным электродным потенциалом. Рассмотрим схему коррозии железа, покрытого цинком – металлом с меньшим значением электродного потенциала (–0,76 В), чем у железа (–0,44 В). При разрушении анодного покрытия создается гальваническая пара, в которой цинк является анодом, а железо – катодом (рис. 83).
Рис. 83. Схема коррозии железа с защитной пленкой цинка
Соответствующие уравнения коррозионного процесса:
Катодный процесс (Fe):O2 + 2H2O + 4e = 4OH– .
222
