
Министерство общего и профессионального образования
Российской Федерации Уральский государственный технический университет
ИЗУЧЕНИЕ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ ВОЗДУХА. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ МЕТОДОМ КЛЕМАНА-ДЕЗОРМА
Методические указания к лабораторной работе № 7 по физике для студентов всех форм обучения всех специальностей
Екатеринбург 2004
УДК 539.16
Составители А.А. Сабирзянов, М.Г. Валишев, А.А. Повзнер, Н.Н. Серебренников, Г.Д. Федоров
Научный редактор проф., д-р. техн. наук. В.М. Замятин
ИЗУЧЕНИЕ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ ВОЗДУХА. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ МЕТОДОМ КЛЕМАНА- ДЕЗОРМА: Методические указания к лабораторной работе № 7 по физике /А. А. Сабирзянов, М.Г.Валишев, А.А.Повзнер, Н.Н. Серебренников, Г.Д.Федоров. Екатеринбург: Изд-во УГТУ, 2004. 15 с.
В работе изложена методика проведения лабораторной работы по определению показателя адиабаты и других параметров воздуха. Методические указания предназначены для студентов всех форм обучения всех специальностей.
Библиогр. 2 назв. Рис. 3. Прил. 1.
Подготовлено кафедрой физики
© Уральский государственный технический университет, 2004
2
Теоретическая часть
Адиабатический процесс
Адиабатическим называется процесс, протекающий без теплообмена с окружающей средой. Это означает, что первое начало термодинамики имеет вид:
Q = DU + A = 0 (1)
Адиабатический процесс в идеальном газе описывается уравнением адиаба -
ты
Pi^i7= P 2V • (2)
где p1 и V1 - давление и объем газа в начальном состоянии, а р2 и V2 - в конечном состоянии.
Можно записать уравнение адиабаты в переменныхр и T
g
f т \ Ti
(3)
g-i у-i ^ \
Pi p2 i Pi I
= или
Ti' T' уP2 0 VT2 0
g-i
где T\ и T2 - температура газа в начальном и конечном состояниях.
Величина у называется показателем адиабаты (коэффициентом Пуассона). Показатель адиабаты входит в уравнения, описывающие адиабатический и близкие к нему процессы. К таким процессам относятся распространение звуковых волн в газах, истечение газа из сопла реактивного двигателя и т.д.
Показатель адиабаты вычисляется по формуле
C P i + 2 1Л\
у =—=—• (4)
CV *
где CP - молярная теплоемкость газа при постоянном давлении (при изобарическом процессе), CV - молярная теплоемкость при постоянном объеме (при изо- хорическом процессе), i - число степеней свободы молекул газа. Известно, что для одноатомных молекул i = 3, для двухатомных i = 5, для многоатомных i = 6. Воздух представляет собой смесь, в которой преобладают двухатомные газы (азот, кислород), поэтому для него принимают i = 5.
Можно определить у экспериментальным путем. В настоящей работе для определения показателя адиабаты воздуха используется один из самых простых методов - метод Клемана-Дезорма.
Метод Клемана-Дезорма
Данный метод основан на измерении давления газа (воздуха), последовательно проходящего через три состояния: из первого во второе газ переходит адиабатически, из второго в третье - изохорически (рис. i).
Рис.
1.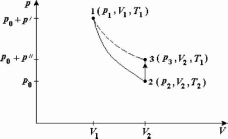
В стеклянный баллон нагнетается воздух до давления р1, превышающего атмосферное давлениер0 на небольшую величину р', т.е. р\ = р0 + р , р<<р0.
После установления теплового равновесия температура газа в баллоне будет равна температуре окружающей среды Т1. Таким образом, начальное состояние газа (состояние 1 на рис. 1) определяется параметрамир1, V1, Т\. Открывая кран, баллон на некоторое время соединяют с атмосферой. При этом давление в баллоне падает до значения р2, равного атмосферному: р2 = р0.
Так как процесс расширения газа при соединении баллона с атмосферой происходит достаточно быстро, то теплообменом с окружающим воздухом через стенки баллона можно пренебречь и считать процесс близким к адиабатическому. Таким образом, газ адиабатически переходит в состояние 2 с параметрами р2, V2, Т2, причем V2>V1, Т2<Т1. Будем считать, что V2 равен объему баллона V. Так как при расширении часть воздуха выходит в атмосферу, то объем V1 воздуха в состоянии 1 немного меньше объема баллона (на величину, занимаемую воздухом, вышедшим в атмосферу при открывании крана).
После закрытия клапана воздух в баллоне, охладившийся при расширении до температуры Т2, будет нагреваться до температуры окружающей среды Т1. При изохорическом нагревании воздух перейдет в состояние 3 с параметрами р3, V2, Т1, причем, согласно закону Шарля,
р 2 р3 или р3 Т1 (5) = или = —. (5)
ТГ ГТ~1 ГТ~1
2 Т1 р2 Т2
Давление р3 превышает атмосферное давление р0 на небольшую величину р '' , т.е. рз = ро + р'', р'' << ро.
4
Из формул (3) и (5) получаем
/ \'-i Pi
f т \у
Ti
V T2 0
Г \У
P3 P2
(6)
P2
P 0
V
У
V
У
Так как выражения в скобках близки к единице, можно ограничиться первыми членами разложения в ряд обеих частей уравнения (6):
Р_
P 0
i + у P-.
P0
1 + (у -1)
Отсюда следует, что
P
у = -7^-7 ■ (7) P - P
Используемый в работе водяной U - образный манометр непосредственно измеряет разность давлений воздуха в баллоне и в атмосфере, т.е. величины p ', P'' , которые можно записать в виде:
P = rghi, P" = rgh2, (8)
где hi, h2 - разности уровней жидкости в коленах манометра в состояниях i и 3, р - плотность воды, g - ускорение свободного падения. Подставляя (8) в (7), получаем расчетную формулу для определения у:
у = -^- (9)
h
2
i - hРасчет работы и изменения температуры газа при его адиабатическом расширении
Из уравнения (i) следует, что при адиабатическом расширении воздуха из состояния i в состояние 2
A
(10)
= -DU = m.(Ti - T2 )Так как газ при этом совершает работу против внешних сил за счет уменьшения своей внутренней энергии, то его температура уменьшается (T2<Ti).
Расчет показывает, что работу газа при адиабатическом расширении в данном случае можно выразить как
PghiV
(
A
11)у
При адиабатическом процессе изменяются давление, объем и температура газа. В частности, для изменения температуры DT можно получить выражение
5
(12)
г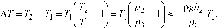 де
р0
- атмосферное давление, h2
- разность уровней жидкости в коленах
манометра в состоянии 3.
де
р0
- атмосферное давление, h2
- разность уровней жидкости в коленах
манометра в состоянии 3.
Все предыдущие расчеты основаны на предположении, что переход газа из состояния 1 в состояние 2 является адиабатическим процессом. Это было бы справедливо при условии, что расширение газа происходит за бесконечно малое время. В действительности расширение занимает некоторое время, в течение которого успевает произойти теплообмен газа в баллоне с окружающим воздухом.
В результате в состоянии 3 манометр покажет не истинное значение h2, необходимое для расчета g и других величин, а некоторое меньшее значение h2; при этом h2 будет тем меньше, чем больше время t, в течение которого из баллона выпускается воздух.
Опытным путем установлено, что при малых отклонениях воздуха от равновесного состояния (р ', р'' <<р0) выполняется соотношение
h
(13)
'2 = h2e at или lnh'2 = lnh2 - at,где а - константа, не зависящая от параметров установки и условий опыта, t - время, в течение которого открыт клапан.
Формула (13) позволяет по экспериментальным значениям h2 графическим методом определить h2, а затем рассчитать g и другие параметры воздуха.
* Оценка коэффициента теплопроводности воздуха при комнатной температуре
В данной работе имеется возможность определить еще одну величину- коэффициент теплопроводности воздуха к. Он определяет способность газа проводить тепло посредством теплопроводности (другим механизмом переноса те - пла в газе является конвекция) и зависит от природы данного газа и температуры.
Количество переносимого тепла dQ можно найти, используя уравнение теплопроводности
АТ
8
(14)
Q = к— Sdt, АгВыполняется по указанию преподавателя.
6
где S - площадь поверхности, через которую передается тепло, Dt - промежуток времени, в течение которого оно передается, Dr - расстояние, на котором происходит перепад температур DT.
Из уравнения (14) видно, что коэффициент теплопроводности к численно равен количеству теплоты, перенесенной через единицу площади за единицу
DT
в
, равном единице.
Dr
ремени при градиенте температуры
После закрытия клапана воздух в баллоне изохорически нагревается (процесс 2-3 на рис. 1) от температуры Т2 до комнатной температуры T1, получая количество тепла
q
(15)
=m ■ - (т - Т2) M 2х 1 2/Приравнивая Q = \dQ и интегрируя (14) в интервале времени t = (t, ¥), после преобразований получаем
k=V-$TSa' (16)
где a - константа, входящая в уравнение (13) и рассчитываемая графическим методом.
