
- •42. Оценка термической стабильности ионных твердых тел.
- •40. Уравнение Капустинского.
- •3 9. Учет отталкивания ионов при перекрывании атомных орбиталей в расчете энергии кристаллической решетки.
- •53. Диффузия атомов и ионов. Законы Фика. Механизм диффузии. Энергия активации процесса диффузии.
- •51. Нестехиометрические соединения. Дефекты и нестехиометрия.
- •54. Твердые электролиты. Сенсоры.
- •29. Структура хлорида цезия. Определение числа формульных единиц, в элементарной ячейке.
- •30. Структура сфалерита. Координация ионов в структуре.
- •31. Структуры флюорита и антифлюорита. Координация ионов в структурах этих кристаллов.
29. Структура хлорида цезия. Определение числа формульных единиц, в элементарной ячейке.
П![]() редставлена
солямиCsCl,
CsBr,
CsJ,
TiCl
и тд. Все эти соли образованы крупными
катионами. Ячейка не объемноцентрированная,
поскольку в центре и углах куба расположены
ионы разного сорта. Элементарная ячейка
представляет собой куб. структуру
CsCl(к)
получаем путем взаимного пронизывания
двух примитивных кубических решеток,
одна из которых состоит только из ионов
Cl-,
а другая Cs+.
редставлена
солямиCsCl,
CsBr,
CsJ,
TiCl
и тд. Все эти соли образованы крупными
катионами. Ячейка не объемноцентрированная,
поскольку в центре и углах куба расположены
ионы разного сорта. Элементарная ячейка
представляет собой куб. структуру
CsCl(к)
получаем путем взаимного пронизывания
двух примитивных кубических решеток,
одна из которых состоит только из ионов
Cl-,
а другая Cs+.
|
Сl |
Cs |
Объем |
0 |
1 |
Грань(1/2) |
0 |
0 |
Ребро(1/4) |
0 |
0 |
Угол(1/8) |
8/8=1 |
0 |
На один примитивный куб приходится1 ион Cl и 1 ион Cs. На одну элементарную ячейку приходится одна формульная единица CsCl. координационные числа катиона и аниона равны 8.
30. Структура сфалерита. Координация ионов в структуре.
Z![]() nS,(β-модификация)
ZnSe, ZnTe, SiC,
CdS, CdSe и
др.Связь менее ионная и более ковалентная
чем в структуре каменной соли. Ковалентные
связи обладают направленностью. Структуру
сфалерита можно получить из структуры
алмаза, заменив одну половину атомов
углерода атомами цинка, а другую атомами
серы. Структура основана на кубической
гранецентрированной анионной решетке.
Каждый атом Zn окружен по
тетраэдру 4-мя атомами S,
каждый атом S окружен по
тетраэдру 4-мя атомами Zn.
Структуру β-ZnS можно
представить в виде плотноупакованных
слоёв анионов серы, тетраэдрические
пустоты между которыми занимают Zn2+.
nS,(β-модификация)
ZnSe, ZnTe, SiC,
CdS, CdSe и
др.Связь менее ионная и более ковалентная
чем в структуре каменной соли. Ковалентные
связи обладают направленностью. Структуру
сфалерита можно получить из структуры
алмаза, заменив одну половину атомов
углерода атомами цинка, а другую атомами
серы. Структура основана на кубической
гранецентрированной анионной решетке.
Каждый атом Zn окружен по
тетраэдру 4-мя атомами S,
каждый атом S окружен по
тетраэдру 4-мя атомами Zn.
Структуру β-ZnS можно
представить в виде плотноупакованных
слоёв анионов серы, тетраэдрические
пустоты между которыми занимают Zn2+.
|
Zn |
S |
Объем |
0 |
4 |
Грань(1/2) |
6/2=3 |
0 |
Ребро(1/4) |
0 |
0 |
Угол(1/8) |
8/8=1 |
0 |
На элемнтарную ячейку приходится 4 атома Zn2+ и 4 атома S2-.т.е. 4 формульные единицы ZnS. Координационное число равно 4.
31. Структуры флюорита и антифлюорита. Координация ионов в структурах этих кристаллов.
CaF2, SrF2, CdF2. HgF2, CeO2 и др.Химическая связь не является чисто ионной, значительную роль играет ковалентная составляющая связей. Структура основана на кубической гранецентрированной катионной решетке. Если представить структуру исходя из плотнейшей упаковки катионов, то позиции анионов будут соответствовать тетраэдрическим пустотам между катионами. Координационное число катиона=8 (кубическая геометрия), аниона – 4 (тетраэдрическая геометрия).
|
Са |
F |
Объем |
0 |
4 |
Грань(1/2) |
6/2=3 |
0 |
Ребро(1/4) |
0 |
0 |
Угол(1/8) |
8/8=1 |
0 |
Чтобы перейти к структуре антифлюорита, достаточно поменять местами в решетки катионы и анионы.В такой структуре кристаллизуются K2O, халькогениды лития, натрия и калия. Кубическую гранецентрированную решетку формируют анионы, а тетраэдрические позиции занимают катионы. На одну элементарнюю ячейку приходится (АБ2) 4 атома А и 8 атомов Б.
3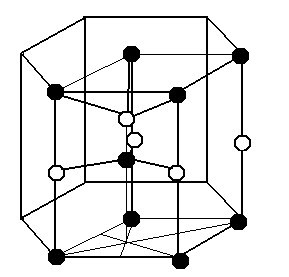 2.
Структура
вюрцита.
ZnS, ZnO, CdS, BeO, MnS,AgJ. Основывается на плотнейшей
гексагональной упаковке анионов.
Элементарная ячейка может быть
представлена в виде гексагональной
призмы, но принято выбирать меньшую
ячейку в основании которой лежит ромб
с углом 600.Такая ячейка становится
примитивной и характеризуется параметрами
а=в и а≠с. Оба вида атомов образуют
плотнейшую гексагональную упаковку и
две образованные ими решетки вставлены
со сдвигом одна в другую. Атомы одного
вида тетраэдрически окружены атомами
другого вида. На одну элементарную
ячейку приходится одна формульная
единица.
2.
Структура
вюрцита.
ZnS, ZnO, CdS, BeO, MnS,AgJ. Основывается на плотнейшей
гексагональной упаковке анионов.
Элементарная ячейка может быть
представлена в виде гексагональной
призмы, но принято выбирать меньшую
ячейку в основании которой лежит ромб
с углом 600.Такая ячейка становится
примитивной и характеризуется параметрами
а=в и а≠с. Оба вида атомов образуют
плотнейшую гексагональную упаковку и
две образованные ими решетки вставлены
со сдвигом одна в другую. Атомы одного
вида тетраэдрически окружены атомами
другого вида. На одну элементарную
ячейку приходится одна формульная
единица.
33. Структура арсенида никеля. Координация ионов в структуре.
NiAs, NiS, NiSb, NiTe, CoS, FeS,и др. Основывается на плотнейшей гексагон-ой упаковке анионов. В структуре арсенида никеля атомы as образуют плотнейшую гексагональную упаковку, а все октаэдрические пусты заняты атомами Ni, которые образуют примитивную гексагональную решетку. К.ч.(As)=6. координация атомов As необычная:они размещаются в центрах тригональных призм из Ni. Атомы As и Ni не взаимозаменяемы.
|
Ni |
As |
Объем(×3) |
0 |
6 |
Ось (×1) |
2 |
0 |
Основание(×1/2) |
1 |
0 |
Ребро(×1/3) |
1 |
0 |
Угол(×1/6) |
2 |
0 |
Для определения атомов, входящих в гексагональную ячейку необходимы другие правила. Атом, занимающий угол ячеки, принадлежит сразу 6 ячейкам (×1/6). Атом, расположенный на вертикальном ребре, принадлежит сразу 3 ячейкам (×1/3), а атом в центре основания – двум элементарным ячейкам ( ×1/2). Если атом находится в объеме призмы с ромбом в основании, то таких атомов будет три ( ×3). Атом размещенный на оси призмы учитывается коэф-м 1. Из вычислений видно, что на одну элементарную ячейку в форме гексагональной призмы приходится 6 формульных единиц.
|
Zn |
S |
Объем(×3) |
3 |
3 |
Ось (×1) |
0 |
1 |
Основание(×1/2) |
1 |
0 |
Ребро(×1/3) |
0 |
2 |
Угол(×1/6) |
2 |
0 |
Для определения атомов, входящих в гексагональную ячейку необходимы другие правила. Атом, занимающий угол ячеки, принадлежит сразу 6 ячейкам (×1/6). Атом, расположенный на вертикальном ребре, принадлежит сразу 3 ячейкам (×1/3), а атом в центре основания – двум элементарным ячейкам ( ×1/2). Если атом находится в объеме призмы с ромбом в основании, то таких атомов будет три ( ×3). Атом размещенный на оси призмы учитывается коэф-м 1. Из вычислений видно, что на одну элементарную ячейку в форме гексагональной призмы приходится 6 формульных единиц.
