
- •42. Оценка термической стабильности ионных твердых тел.
- •40. Уравнение Капустинского.
- •3 9. Учет отталкивания ионов при перекрывании атомных орбиталей в расчете энергии кристаллической решетки.
- •53. Диффузия атомов и ионов. Законы Фика. Механизм диффузии. Энергия активации процесса диффузии.
- •51. Нестехиометрические соединения. Дефекты и нестехиометрия.
- •54. Твердые электролиты. Сенсоры.
- •29. Структура хлорида цезия. Определение числа формульных единиц, в элементарной ячейке.
- •30. Структура сфалерита. Координация ионов в структуре.
- •31. Структуры флюорита и антифлюорита. Координация ионов в структурах этих кристаллов.
46 Термодинамическое обоснование возникновения дефектов твердых тел.
Д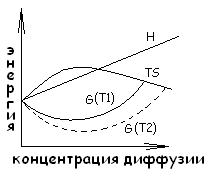 ефекты:
внутренние(собственные) и внешние(приемные).
Собственные получаются при нагревании.
Как видно, образование дефектов до
определенной концентрации приводит к
понижению энергии Гиббса – энергообразование
самопроизвольный процесс. Повышение Т
приводит к увеличению концентрации
дефекта в твердом теле. (10-6
– 10-7%
- низкие концентрации.) Это приводит к
увеличению условий для диффузии атомов
и ионов в твердом теле.
ефекты:
внутренние(собственные) и внешние(приемные).
Собственные получаются при нагревании.
Как видно, образование дефектов до
определенной концентрации приводит к
понижению энергии Гиббса – энергообразование
самопроизвольный процесс. Повышение Т
приводит к увеличению концентрации
дефекта в твердом теле. (10-6
– 10-7%
- низкие концентрации.) Это приводит к
увеличению условий для диффузии атомов
и ионов в твердом теле.
44 Оценка растворимости ионных кристаллов.
Л учше
растворяются те соединения, у которых
больше разница размеров радиусов
катионов и анионов. У которых радиусы
близки – малорастворимы. Изменение
размера одного из ионов относительно
мало влияет на энергию решетки но
приводит к большему изменению энергии
гидратации. Различие в Е катионов и
анионов приводит к возрастанию Е
гидратации, равновесие реакции растворения
смещается в сторону растворения.
учше
растворяются те соединения, у которых
больше разница размеров радиусов
катионов и анионов. У которых радиусы
близки – малорастворимы. Изменение
размера одного из ионов относительно
мало влияет на энергию решетки но
приводит к большему изменению энергии
гидратации. Различие в Е катионов и
анионов приводит к возрастанию Е
гидратации, равновесие реакции растворения
смещается в сторону растворения.
43 Стабилизация высоких степеней окисления металлов анионами малых размеров. Высокие степени окисления катионов стабилизируются малыми по размеру анионами.
MX(S)+Y2X2(G) MX2(S)
AgF(S)+1/2F2(G)AgF2(S)
F2 F-F Е=155кДж моль
Cl2 Cl-Cl Е=242кДж моль
Br2 Br-Br Е=193кДж моль
J2 J-J Е=151кДж моль
В этом случае более легкое разложение F2 по сравнению с Cl2 благоприятствует реакции, однако это не главное. Основной вклад – увеличение заряда катиона. При этом резко возрастает числитель. больше при меньшем значение d. Этим объясняется особое увеличение устойчивости фторидов при увеличении степени окисления катионов. При этом могут стабилизироваться даже аномальные степени окисления катионов.
Например: CoF3 а CoJ3 не существует; FeCO3 а Fe2(CO3)3 не образуется.
42. Оценка термической стабильности ионных твердых тел.
∆![]() G0
= ∆H0
- T∆S0
G0
= ∆H0
- T∆S0
MCO3(S)MO(S)+CO2(G)
Д![]() ля
однотипных соединений вклад энтропии
оказывается одинаковым. При оценке
относительной устойчивости энтропию
можно не принимать во внимание. Тогда
можно ограничится энтальпией реакции.
На основании уравнения Капустинского
можно дать конечную оценку разложения
химических соединений при котором
катион или анион разлагаются, что
приводит к уменьшению расстояния между
ионами.
ля
однотипных соединений вклад энтропии
оказывается одинаковым. При оценке
относительной устойчивости энтропию
можно не принимать во внимание. Тогда
можно ограничится энтальпией реакции.
На основании уравнения Капустинского
можно дать конечную оценку разложения
химических соединений при котором
катион или анион разлагаются, что
приводит к уменьшению расстояния между
ионами.
В![]() данных примерах заряды ионов при
термическом разложении не меняются,
однако расстояния уменьшаются.
Относительный вклад уменьшения размера
аниона больше в том случае, когда меньше
размер аниона. В этом случае образуются
наиболее прочные оксиды и исходные
соединения разлагаются при
более никой температуре.
данных примерах заряды ионов при
термическом разложении не меняются,
однако расстояния уменьшаются.
Относительный вклад уменьшения размера
аниона больше в том случае, когда меньше
размер аниона. В этом случае образуются
наиболее прочные оксиды и исходные
соединения разлагаются при
более никой температуре.
40. Уравнение Капустинского.
К![]() апустинский
предложил упрощенный вариант расчетов
энергии решетки и предложил учить:1)в
расчетах применять формульную единицу
деленную на число ионов, входящих в неё.
2)Независимо от координационного числа
применять в качестве базовой решетку(6;6)
NaCl.
Использовать уравнение для расчета Е
кристаллической решетки тех веществ,
которые образованы из несферических
ионов (анионов). При этом за радиус
принимается радиус псевдосферического,
при исполнении которого по уравнению
Капустинского можно правильно вычислить
уравнение кристаллической решетки. Для
псевдосферических ионов был введен
термин – термохимический радиус ионов.
Использование их значений позволяет
правильно вычислять по уравнению
Капустинского энергии кристаллов в
который
входит соответствующий ион.
апустинский
предложил упрощенный вариант расчетов
энергии решетки и предложил учить:1)в
расчетах применять формульную единицу
деленную на число ионов, входящих в неё.
2)Независимо от координационного числа
применять в качестве базовой решетку(6;6)
NaCl.
Использовать уравнение для расчета Е
кристаллической решетки тех веществ,
которые образованы из несферических
ионов (анионов). При этом за радиус
принимается радиус псевдосферического,
при исполнении которого по уравнению
Капустинского можно правильно вычислить
уравнение кристаллической решетки. Для
псевдосферических ионов был введен
термин – термохимический радиус ионов.
Использование их значений позволяет
правильно вычислять по уравнению
Капустинского энергии кристаллов в
который
входит соответствующий ион.
3 9. Учет отталкивания ионов при перекрывании атомных орбиталей в расчете энергии кристаллической решетки.
В![]() реальных системах не только Кулоновское
взаимодействие заряженных ионов, но и
частичный ковалентный вклад в связь.
Он происходит при перекрывании атомных
орбиталей взаимодействующих электронов.
Расстояния между ядрами уменьшается,
иногда это рассматривают с позиции
поляризации ионов. Дальнейшему движению
мешает отталкивание электронных оболочек
и особенно заряженных ядер ионов. Учет
дополнительного взаимодействия можно
учесть по отношению по уменьшению
расстояния м/д ядрами ионов, когда м/д
ними появляется только к
реальных системах не только Кулоновское
взаимодействие заряженных ионов, но и
частичный ковалентный вклад в связь.
Он происходит при перекрывании атомных
орбиталей взаимодействующих электронов.
Расстояния между ядрами уменьшается,
иногда это рассматривают с позиции
поляризации ионов. Дальнейшему движению
мешает отталкивание электронных оболочек
и особенно заряженных ядер ионов. Учет
дополнительного взаимодействия можно
учесть по отношению по уменьшению
расстояния м/д ядрами ионов, когда м/д
ними появляется только к![]() улоновское
взаимодействие.
улоновское
взаимодействие.
C’-постояная
d![]() -идеальное
-идеальное
dx- реальное расстояние.
dx = 0,345Ао
53. Диффузия атомов и ионов. Законы Фика. Механизм диффузии. Энергия активации процесса диффузии.
Диффузией называют переход частицы вещества из области с более высокой его концентрацией в область с более низкой концентрацией. Закономерности диффузии описываются 1 и 2 законами Фика. 1 закон выражает постоянную скорость диффузии через единицу сечения некоторой среды вследствие наличия градиента концентрации вещества в условиях стационарного состояния потока. При стационарном состоянии потока градиент концентрации диффундирующего вещества не меняется со временем вдоль всего пути диффузии.
dn/dt = -DS dc/dx; dn/dt – количество вещества в молях, перенесенное за единицу времени через поперечное сечение S(поток диффузии) при градиенте концентрации вещества -dc/dx на отрезке пути dx; D – коэффициент диффузии.
Если нет равенства скоростей входящего и выходящего потоков и происходит накопление вещества во времени в элементарном объеме, ограниченном dx, то применяют второй закон Фика:
