
- •6. Образ природы в неклассическом естествознании: квантовая концепция.
- •6.1. Тепловое излучение тел
- •6.2. Внешний фотоэффект
- •6.3. Волны де Бройля. Соотношение неопределенностей.
- •6.4. Квантовая механика. Уравнение Шредингера.
- •6.5. Физика атома.
- •6.6. Физика элементарных частиц.
- •7. Квантовая физика в современных технологиях. Неклассические концепции в химии.
- •7.1. Ядерная энергетика
- •7.2. Полупроводники
- •7.3. Лазеры
- •7.4. Учение о химическом процессе
- •Тепловой эффект реакции.
- •Химическое равновесие реакции.
- •Скорость протекания реакции.
- •8. Концепция самоорганизации природных систем.
- •9. Эволюционные концепции в современном естествознании.
- •9.4. Современные концепции происхождения жизни на Земле.
- •10. Жизнь на нашей планете. Человек и природа.
- •10.1.Термодинамика и энергетика живых систем
8. Концепция самоорганизации природных систем.
8.1. Методы описания многочастичных систем.



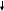


Термодинамика
Макроскопический
(феноменологический)
подход
Распределения
Молекулярная
физика
Микроскопический
(статистический)
подход

МОЛЕКУЛЯРНЫЕ СИСТЕМЫ

Макропараметры:
давление Р
объем V
температура Т
энтропия S

Микропараметры:
импульс р
энергия
длина пробега L

Уравнения состояния,
1 и 2 начала термодинамики
Термодинамический метод
Термодинамика - теория описания процессов в молекулярной системе с помощью макропараметров.
Классическая термодинамика изучает только равновесные состояния и процессы.
Термодинамическое равновесие – состояние системы, когда во всех ее частях значения макропараметров одинаковы.
Связь макропараметров системы называется уравнением состояния.
Уравнение состояния идеального газа Менделеева –Клапейрона.
![]()
Классическая термодинамика представляет собой теорию динамического типа.
Статистический метод
Молекулярная физика - теория описания процессов в молекулярной системе на основе их молекулярного строения.
Макросостояние системы определяется статистическими распределениями микропараметров.
Распределение Максвелла
молекул газа по их скоростям:
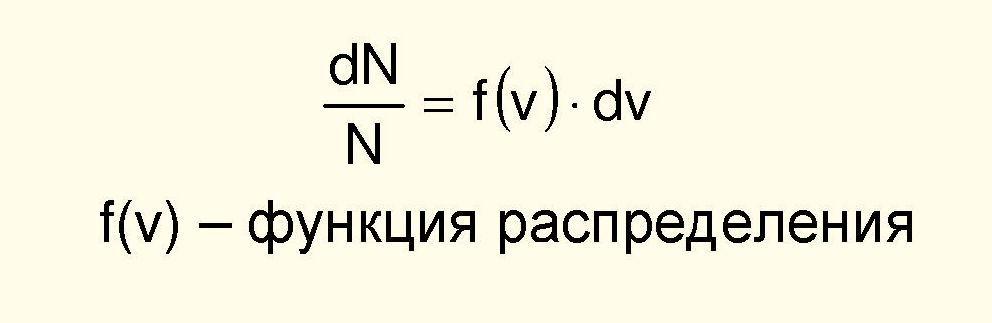
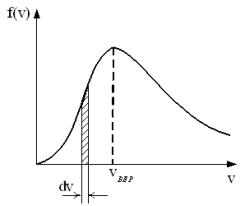
Молекулярная физика представляет собой теорию статистического типа.
8.2. Обратимые и необратимые процессы. Энтропия.
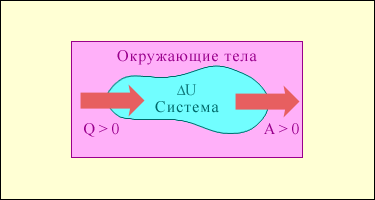
Первое начало термодинамики:
Теплота, сообщаемая системе, расходуется на увеличение ее внутренней энергии и на совершение этой системой работы.
![]()
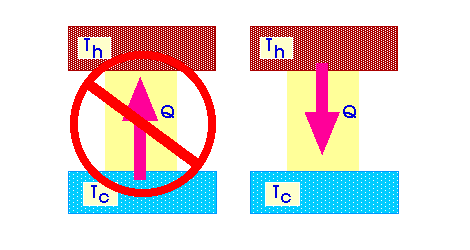
Второе начало термодинамики:
Формулировка Р. Клаузиуса: не существует процесса, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
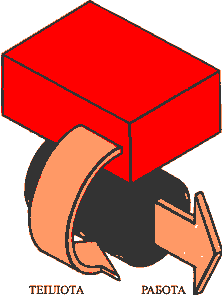
Формулировка У. Кельвина и М. Планка: невозможен циклический процесс, единственным результатом которого является превращение теплоты в работу.
Обратимые и необратимые процессы
Обратимым называется процесс, который может быть проведен в прямом и обратном направлении без остаточных изменений в окружающей среде.
Большинство процессов в природе необратимы и связаны с диссипацией (рассеянием) энергии.
Мера необратимого рассеяния энергии – энтропия.
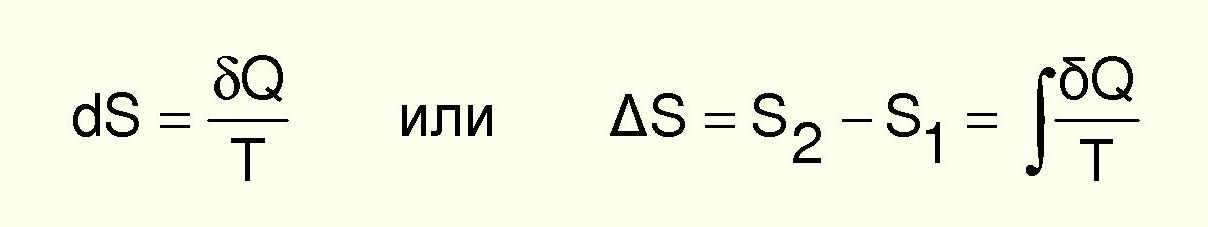
В процессах важно знать изменение энтропии
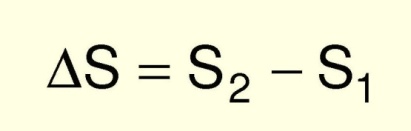
Энтропия и вероятность
Энтропия системы связана с числом способов реализации макросостояния системы (вероятностью реализации состояния).
Формула Больцмана:
![]()
W – вероятность состояния системы.
Энтропия является мерой неупорядочности (хаотичности) состояния системы.
Изменение энтропии в системах




Неизолированная
Термодинамическая система

Изолированная

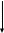





S 0
S < 0
S > 0
S = 0
Обратимые
процессы
Необратимые
процессы
Формулировка второго начала термодинамики: энтропия изолированной системы не может убывать S ≥ 0.
Все изолированные системы эволюционируют в направлении от упорядоченности к хаотичности.
Возникновение хаоса обусловлено нелинейностью и неустойчивостью систем.

Второе начало термодинамики вступило в противоречие с теорией эволюции!
8.3. Открытые термодинамические системы
Эволюционная парадигма: В процессе развития происходит переход к новым, более упорядоченным формам.
Второе начало термодинамики описывает эволюцию изолированных равновесных систем.
Природные объекты – открытые неравновесные системы.
В таких системах возникает неоднородное распределение термодинамических параметров и происходит обмен энергией, веществом, информацией и т.д.
Процессы в открытых неравновесных системах исследует неравновесная термодинамика.
Градиент – физическая величина, характеризующая степень неоднородности распределения какой-либо величины.
Наличие градиента вызывает появление потока другой физической величины (градиент температуры – поток тепла…).
Различают слабонеравновесные и сильнонеравновесные открытые системы.
В слабонеравновесной системе ( близкой к термодинамическому равновесию) поток переносимой величины линейно связан с соответствующим градиентом.
В сильнонеравновесной системе потоки являются нелинейными функциями соответствующих градиентов.
Явления переноса
Это необратимые процессы в слабонеравновесных системах, стремящиеся привести систему в состояние равновесия.
Теплопроводность Диффузия

8.4. Концепция самоорганизации в сильнонеравновесных открытых системах.
И. Пригожин, бельгийский физик (1917-2003 г.): теория неравновесной термодинамики в сильнонеравновесных системах.
Самоорганизация - процесс образования в системе упорядоченной структуры без внешнего организующего воздействия.
Флуктуация - случайное, локальное отклонение параметров от их среднего значения в данной точке.
Поведение различных систем.









сильнонеравновесная
слабонеравновесная
Процессы
переноса
Неизолированная
(открытая) система
Изолированная
система
Образование новой
упорядоченной
структуры
(самоорганизация)
Возвращение
системы в
равновесное
состояние
(релаксация)
Флуктуация
Структуры, возникающие как результат самоорганизации в сильнонеравновесных системах, получили название диссипативных структур.
Диссипативные структуры:
Диссипация – переход части энергии упорядоченного движения в энергию беспорядка.
существуют за счет больших потоков энергии извне
способствуют рассеянию энергии.



Б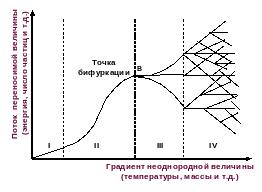 ифуркационная
диаграмма открытой термодинамической
системы.
ифуркационная
диаграмма открытой термодинамической
системы.
Точка бифуркации - состояние, при котором в сильнонеравновесной системе происходит переход к новому типу поведения.
В этой точке у системы появляется возможность выбора.
Выбор системы носит вероятностный характер, что делает эволюцию системы необратимой.
В поведении открытой сильнонеравновесной системы сочетаются случайность и определенность.
Хаос и порядок – две стороны одной медали, работает принцип дополнительности Бора.
8.5. Самоорганизация и энтропия.
Шутка физиков: Термодинамика - старая властная тетка, которую все недолюбливают, но которая всегда права.
В открытых системах за счет подпитки энергии от внешней среды могут возникать диссипативные структуры с меньшей энтропией.
Открытые системы как бы структурируют энергию из внешней среды:
- упорядоченная часть энергии остается в системе,
- неупорядоченную энергию система «сбрасывает», возвращая в природу.
Производство энтропии:
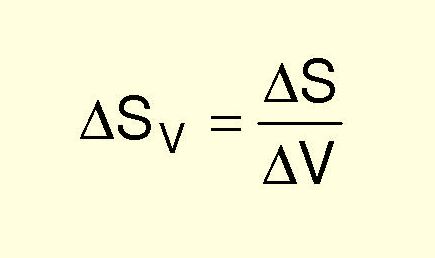
Производство энтропии в неравновесных системах






SV 0
SV > 0
Сильнонеравновесная
самоорганизующаяся система
SV(внеш) < 0
Изолированная
система
SV(внеш) = 0
SV(внутр.) > 0
![]()
Принцип производства минимума энтропии Пригожина - Гленсдорфа: в точках бифуркации система идет по пути, отвечающему меньшему значению производства энтропии.
8.6. Самоорганизация и развитие эволюционных представлений.
Характерные признаки самоорганизации:
1. Система является сложной, т.е. состоит из большого числа элементов.
2. Система является открытой.
3. Неустойчивость и нелинейность свойств системы при увеличении внешнего воздействия.
4. Быстрая перестройка системы при согласованном поведении ее элементов.
5. Конкуренция состояний системы.
6. Уменьшение энтропии системы в результате обмена с внешней средой.
Эволюционно-синергетическая парадигма
Герман Хакен, немецкий физик, (род. 1927 г) – основатель синергетики – науки, изучающей самоорганизацию в сложных, сильнонеравновесных системах любой природы.
Эволюционно-синергетическая парадигма: социальные, физико-химические и биологические объекты подчиняются в своем развитии одним и тем же фундаментальным законам.
Любой объект проходит три стадии:
1. Рождение (самоорганизация).
2. Развитие (смена упорядоченных форм).
3. Распад (переход к неупорядоченному равновесному состоянию).
