
- •6. Образ природы в неклассическом естествознании: квантовая концепция.
- •6.1. Тепловое излучение тел
- •6.2. Внешний фотоэффект
- •6.3. Волны де Бройля. Соотношение неопределенностей.
- •6.4. Квантовая механика. Уравнение Шредингера.
- •6.5. Физика атома.
- •6.6. Физика элементарных частиц.
- •7. Квантовая физика в современных технологиях. Неклассические концепции в химии.
- •7.1. Ядерная энергетика
- •7.2. Полупроводники
- •7.3. Лазеры
- •7.4. Учение о химическом процессе
- •Тепловой эффект реакции.
- •Химическое равновесие реакции.
- •Скорость протекания реакции.
- •8. Концепция самоорганизации природных систем.
- •9. Эволюционные концепции в современном естествознании.
- •9.4. Современные концепции происхождения жизни на Земле.
- •10. Жизнь на нашей планете. Человек и природа.
- •10.1.Термодинамика и энергетика живых систем
6.4. Квантовая механика. Уравнение Шредингера.
Эрвин Шрёдингер, австрийский физик (1887-1961г.) получил волновое уравнение для микрообъектов.
Стационарное уравнение Шредингера:
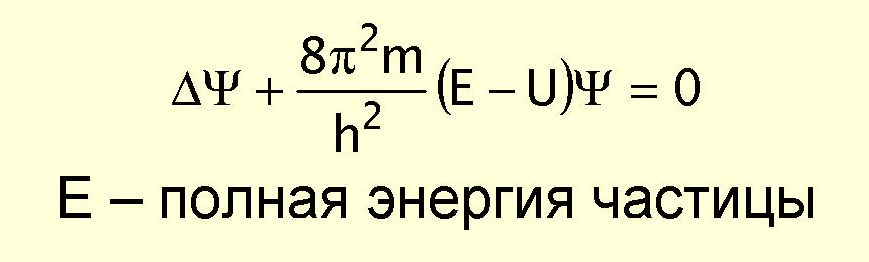
Е – полная энергия частицы;
U – потенциальная энергия;
- волновая функция;
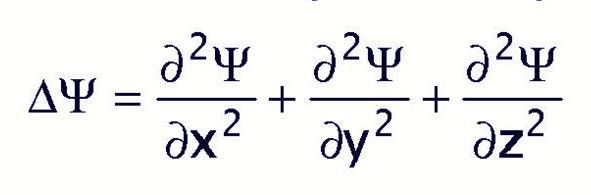
Физический смысл уравнения Шредингера и волновой функции.
Квадрат модуля волновой функции ||2 определяет вероятность нахождения частицы в элементе объема пространства dV:
![]()
В отличие от динамических зависимостей классических теорий в квантовой механике используются статистические зависимости.
Уравнение Шредингера описывает эволюцию системы.
Уравнение имеет решение только при некоторых значениях энергии Е, т.е. энергия частицы квантуется.
6.5. Физика атома.
Джозеф Томсон, английский физик 1897 г. - открытие электрона.
Опыты Резерфорда 1908 г. – облучение тонких металлических пластинок - частицами: 1/10000 часть частиц отражалась на большой угол.
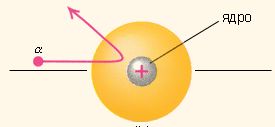
Создана планетарная модель атома.
Противоречия планетарной модели атома
При движении по окружности электроны по теории Максвелла будут излучать волны.
Спектр излучения должен быть сплошным, а на опыте он линейчатый.
Излучая энергию, электроны потеряют энергию и упадут на ядро.
По классической теории атом нестабилен!
Современная модель атома.
Из решения уравнения Шредингера следует, что состояние электрона в атоме определяется четырьмя квантовыми числами:
n = 1, 2, 3, … - главное квантовое число.
Определяет энергию электрона и размеры электронного облака.
l = 0, 1, 2, …, (n –1) - орбитальное квантовое число.
m = 0, 1, 2, … l - магнитное квантовое число.
Числа l и m определяют орбитальный момент импульса электрона, конфигурацию и ориентацию электронного облака.
ms = ½ - спиновое квантовое число.
Определяет собственный момент импульса электрона.
«Электронные облака»
Электронные облака (орбитали) - совокупность точек, в которых велика вероятность нахождения электрона.
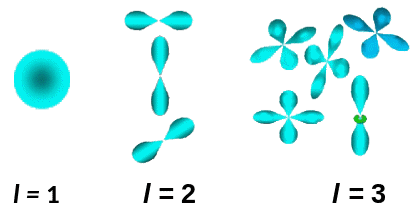
Заполнение оболочек ядра 11Na23
Принцип Паули: в атоме не может быть двух и более электронов с одинаковым набором четырех квантовых чисел.
Натрий – щелочной металл!
6.6. Физика элементарных частиц.
Сильное – взаимодействие протонов и нейтронов в ядрах атомов (радиус взаимодействия ~ 10–15 м);
Электромагнитное – взаимодействие электрических зарядов, токов, электрических и магнитных полей (радиус взаимодействия до ∞);
Слабое – взаимодействие элементарных частиц при радиоактивном распаде (радиус взаимодействия ~10–15 м);
Гравитационное – взаимодействие всех тел (радиус взаимодействия до ∞).
Взаимодействия осуществляются посредством обмена элементарными частицами, их известно более 400.
Основные характеристики частиц.
Масса.
В середине прошлого столетия была создана классификация элементарных частиц по массе
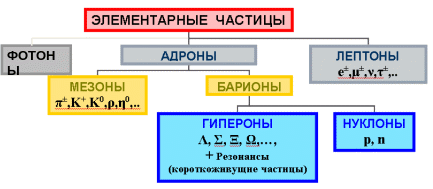
Фотоны –частицы с массой покоя, равной нулю. Участвуют в электромагнитных взаимодействиях.
Лептоны – легкие частицы (электрон, позитрон, нейтрино…) Участвуют во всех взаимодействиях, кроме сильного.
Адроны – крупные частицы, участвуют во всех видах взаимодействий:
Мезоны – обмен этими частицами обеспечивает сильное взаимодействие частиц ядра
Барионы - протон, нейтрон и гипероны.
Сверхэлементарные частицы - шесть кварков, М. Гелл-Ман и Д. Цвейг, американские физики, 1963 г.
Мезоны – 2 кварка, барионы – 3 кварка.
Основные характеристики частиц.
Электрический заряд: 0, +|е|, −|е|.
Среднее время жизни:
Стабильные частицы:
фотон
две разновидности нейтрино
электрон
протон.
Нестабильные частицы – все остальные, время жизни ~ 10-8 – 10-24 с.
Спин (собственный момент импульса частицы) и квантовые числа.
