
- •4 Физико-химические основыпроцессов переработки сырьевых материалов
- •2.1. Характеристика чистоты вещества
- •6. Общая характеристика процессов разделения и очистки
- •7. Сорбционные процессы
- •7. Экстракционные процессы
- •8. Процессы перегонки через газовую фазу
- •9. Ректификация.
- •11 Кристаллизационная очистка
- •2.6.1. Принцип очистки
- •12. Эффективный и равновесный коэффициенты распределения
- •13 Распределение примеси по длине кристалла, полученного нормальной направленной кристаллизацией
- •14. Распределение примеси по длине кристалла, полученного зонной плавкой
- •15. Многократная зонная плавка
8. Процессы перегонки через газовую фазу
Перегонкой называют технологические процессы, состоящие из испарения исходного вещества, последующей концентрации паров и отбора конденсата на разных этапах процесса. Перегонку подразделяют на сублимацию, дистилляцию, ректификацию, а также перегонку с помощью химических транспортных реакций.
Сублимация – метод разделения компонентов твердого раствора однократной возгонкой и последующей конденсацией паров. Сублимация возможна для тех веществ, которые при нагреве до температуры ниже температуры плавления характеризуются высоким давлением паров. Более летучие по сравнению с основным веществом примеси отгоняются при низкой температуре, примеси менее летучие остаются в твердой фазе после возгонки основного компонента.
Дистилляция – метод разделения компонентов жидкого раствора однократным испарением жидкости и последующей конденсацией образовавшихся паров.
Ректификация – метод разделения компонентов жидкого раствора испарением и многократной промывкой паров в противотоке образующимся конденсатом (частью паров, сконденсировавшихся в жидкость) внутри ректификационной колонны, то есть это непрерывный многократный процесс дистилляции и конденсации.
При недостаточной летучести паров очищаемого вещества его переводят в химическое соединение, более летучее, чем примеси или другие компоненты. Последующее разложение легколетучего соединения дает возможность получить очищенный продукт. Реакции синтеза и разложения проводятся в разных реакционных зонах, между которыми осуществляется перенос вещества. Такой метод называется химическими транспортными реакциями (реакциями переноса).
Дистилляция. Рассмотрим двойную систему из компонентов А и В, образующих непрерывный ряд жидких растворов. Парциальное давление насыщенного пара каждого компонента над раствором при постоянной температуре пропорционально мольной доле его в растворе
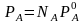 ,
,
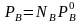 ,
(2.4)
,
(2.4)
где
РА
и РВ
– парциальные давления паров компонентов
А и В над раствором; NA
и NB
– их мольные доли в растворе;
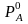 и
и
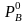 – давление паров чистых компонентов.
Общее давление пара РАВ,
равновесного с раствором
– давление паров чистых компонентов.
Общее давление пара РАВ,
равновесного с раствором
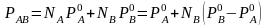 .
(2.5)
.
(2.5)
Это закон Рауля, справедливый для идеальных систем, образование которых не сопровождается тепловым эффектом или изменением объема. Для реальных растворов наблюдается отклонение от линейности между давлением пара раствора и его составом (рис. 2.3).
Растворы с положительным отклонением от закона Рауля образуются с поглощением теплоты и увеличением объема, при отрицательных отклонениях образование растворов сопровождается выделением теплоты и уменьшением объема.

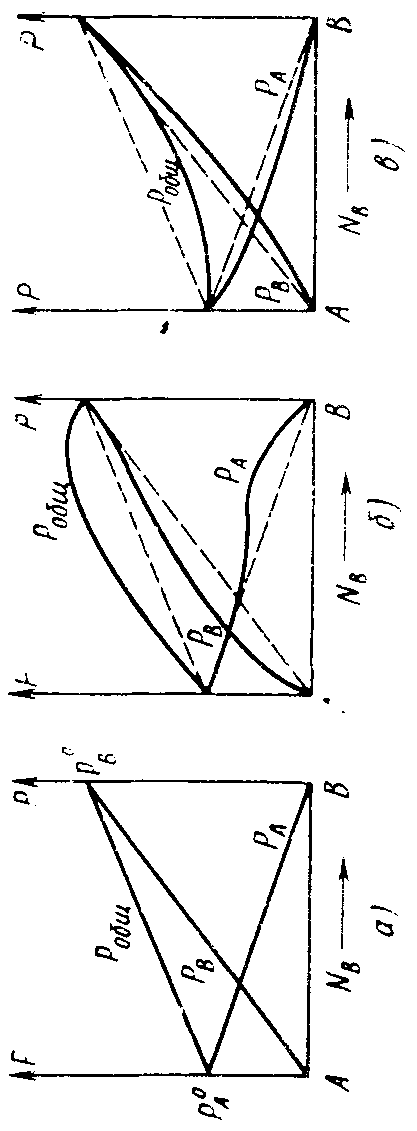
Рис. 2.3. Зависимость общего и парциального давления пара от состава:
а) идеальная система; б) система с положительным отклонением от закона Рауля;
в) система с отрицательным отклонением от закона Рауля
Относительное
содержание компонентов раствора в паре
будет отличаться от их содержания в
растворе. Только при одинаковом давлении
паров в чистом состоянии
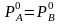 ,
соотношение компонентов в паре и в
растворе совпадают. Во всех остальных
идеальных системах в паровой фазе
преобладает тот из компонентов, который
имеет большее давление пара.
,
соотношение компонентов в паре и в
растворе совпадают. Во всех остальных
идеальных системах в паровой фазе
преобладает тот из компонентов, который
имеет большее давление пара.
При изучении равновесий пар – жидкий раствор применяют два вида диаграмм состояния:
– диаграммы давление пара – состав (T = const);
– диаграммы температура кипения – состав (Р = const).
На рис. 2.4 приведены типичные диаграммы состояния. Системы, обладающие минимумом температур кипения, характеризуются максимумом на кривых давления пара и наоборот.
Точки максимума и минимума соответствуют растворам, состав которых одинаков с составом пара. Растворы, отвечающие этим составам, называются азеотропными или нераздельно кипящими.
На практике для изучения равновесия чаще используют диаграммы температура – состав, они называются диаграммами кипения. Рассмотрим такую диаграмму, относящуюся к первому из трех типов (рис. 2.5).
Если нагреть раствор состава N1, то кипение его начнется тогда, когда будет достигнута температура Т1. Пар, равновесный с этим раствором, обладает составом N3, который богаче компонентом В, чем раствор (первый закон Коновалова). После испарения некоторого количества раствора оставшаяся часть его становится богатой компонентом А и имеет состав, например, N2. Раствор этого состава закипит, когда температура его поднимется до Т2. Пар, находящийся в равновесии с этим раствором, обладает составом, который тоже богаче компонентом В, чем раствор. По мере испарения остаток раствора обогащается компонентом А и температура кипения
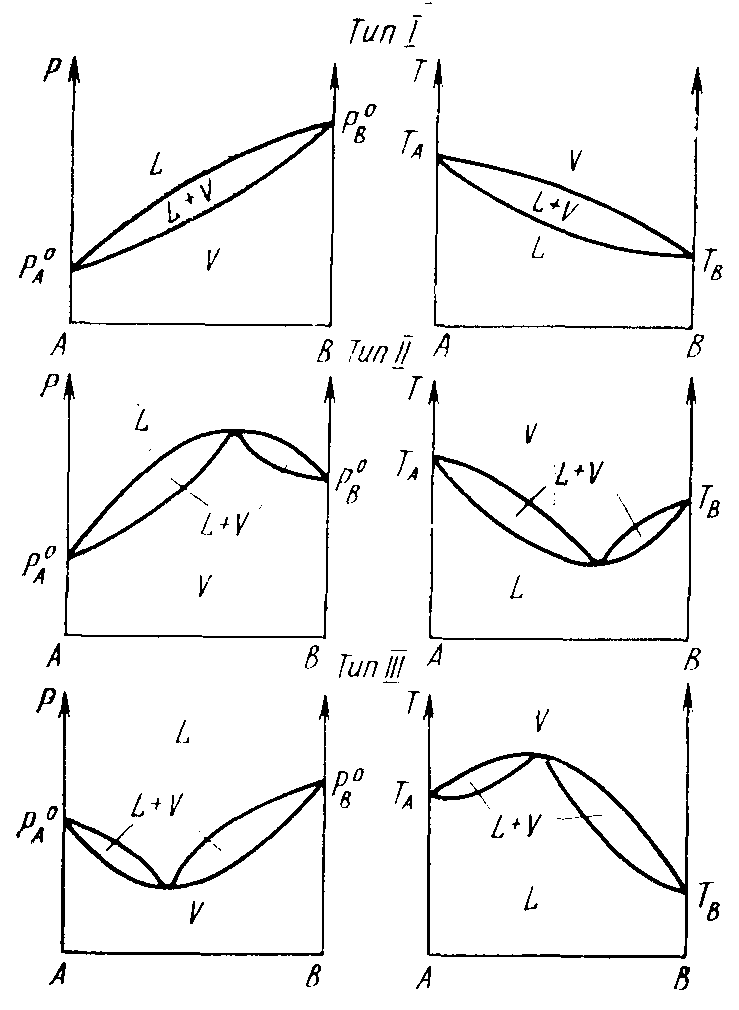
Рис. 2.4. Диаграмма состояния давление пара – состав
и температура кипения – состав для различных типов
систем жидкость L – пар V
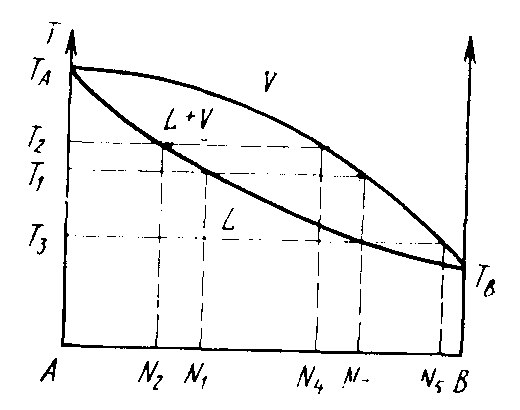
Рис. 2.5. Диаграмма кипения
соответственно повышается. В конце концов в результате испарения в остатке будет содержаться практически чистый компонент А и температура кипения достигнет ТА.
Если пар, выделившийся из раствора при температуре Т1 состава N3, сконденсировать и полученный конденсат подвергнуть дистилляции, то он уже будет кипеть при температуре Т3 и образующийся пар будет иметь состав N5, то есть станет богаче компонентом В. Повторяя такой процесс конденсации и дистилляции, можно в конце концов достигнуть того, что выделяющийся пар будет представлять собой практически чистый компонент В. Таким образом, проведенное рассмотрение показывает, что в системах этого типа любую двойную смесь можно разделить путем дистилляции на чистые компоненты.
В системах же второго или третьего типов разделение растворов на чистые компоненты таким путем невозможно. Действительно, проведя аналогичное рассмотрении процесса дистилляции системы, принадлежащей ко второму или третьему типу, можно показать, что эти системы разделяются на один из чистых компонентов и соответствующий азеотроп.
Азеотроп же не разделяется на компоненты при испарении, и для этого применяют другие методы (экстракция, кристаллизация и др.). Азеотропные растворы встречаются во многих практически важных системах: хлористый водород – вода, азотная кислота – вода, этиловый спирт – вода, сероуглерод – ацетон и др.
Коэффициент распределения при дистилляции
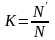 ,
(2.6)
,
(2.6)
где
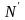 и N
– мольные доли компонентов в паре и
растворе.
и N
– мольные доли компонентов в паре и
растворе.
Для двухкомпонентной системы
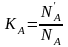 ,
, 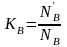 .
(2.7)
.
(2.7)
Коэффициент разделения при дистилляции
. (2.8)
Для идеальных растворов β не зависит от состава
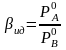 (2.9)
(2.9)
и называется коэффициентом относительной летучести.
Для реальных растворов
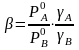 ,
(2.10)
,
(2.10)
где γА и γВ – коэффициенты активности компонентов А и В, характеризующие степень отклонения раствора от идеального
 .
(2.11)
.
(2.11)
В области малых концентраций примесного компонента для основного компонента γ → 1. При очистке А от следов В γА → 1,
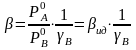 ,
(2.12)
,
(2.12)
в области малых концентраций примеси степень очистки определяется коэффициентом активности примеси (то есть характером и величиной отклонения раствора от идеального).
Повторное проведение дистилляции и сублимации дает возможность достичь высоких степеней очистки. Повысить глубину очистки и эффективность можно в непрерывных процессах. Технически это можно реализовать для процесса дистилляции. Такой процесс осуществляется в ректификационной колонне.
