
- •Введение
- •15.2. Тепловое излучение
- •Спектры атомов
- •Статистическая интерпретация волн деБройля
- •Современные представления о природе света
- •Эффект комптона
- •Статистическая интерпретация волн деБройля
- •Соотношения неопределенностей (Гейзенберга) (1927)
- •Магнитный момент атома водорода (рис.35)
- •Периодический закон Менделеева
- •Химическая связь
- •Физика атомного ядра
- •Нейтрино
- •Квантовая физика твердого тела
- •Сверхпроводимость
- •Эффект Мёссбауэра
- •Эффект Джозефсона
- •Проблема управляемого термоядерного синтеза
- •Лазерный термоядерный синтез
Спектры атомов
Таблица 2. Развитие спектрального анализа
Год |
Ученый |
Содержание открытия |
1704
1802
1814
1857
1859
1860
1870... 1890
1860
1874
1877...
1900
1885
1911
1913 |
И. Ньютон (1643 – 1727)
У. Волластон (1766 – 1828)
И.Фраунгофер (1787 – 1826)
У. Сван (1828 – 1914)
Г. Кирхгоф (1824 – 1887), Р. Бунзен (1811 – 1899)
Они же
Кирхгоф, В. Вин, С. Стефан, Л. Больцман
Дж. Максвелл
Н. Локьер (1836 – 1920)
В. Вин, Дж. Рэлей, Д. Джинс
М. Планк
И. Бальмер
Т. Лайман, Ф. Пашен
Э. Резерфорд
Н. Бор |
Ввел в физику понятие «спектр». С помощью призмы разложил солнечный свет в спектр.
Создал спектральный прибор - спектроскоп со щелью на входе прибора, который позволил радикально увеличить спектральное разрешение. Изображение щели после прохождения лучей через призму с помощью линзы проектируется на экран. Обнаружил в сплошном спектре солнечного света темные линии. Ввел понятие: спектральная линия – изображение щели спектроскопа на экране в случае его освещения монохроматическим светом. Построил спектроскоп с дифракционной решеткой. Определил длины волн 574 темных линий (фраунгоферовы линии), которые наблюдают на фоне сплошного яркого спектра излучения Солнца.
Обнаружил, что двойная линия в желтой области спектра пламени спиртовки связана со свечением атомов натрия.
Установили, что свечение газа каждого химического элемента обладает своим характерным линейчатым спектром. Эти линии можно использовать для анализа состава вещества на Земле, Солнце и в звездах. Объяснили причины существования темных линий в спектре Солнца. Солнце состоит из горячего ядра, испускающего сплошной спектр, и более холодной атмосферы. Темные фраунгоферовы линии в спектре связаны с поглощением света в атмосфере Солнца. Открытие элементов рубидия и цезия с помощью анализа линейчатых спектров. Спектры излучения нагретых тел сплошные, не имеют линейчатой структуры и вполне определенным образом зависят от единственного параметра - температуры тела.
Высказал идею о том, что спектр испускания и поглощения возникает в атомах вещества. Существование линейчатых спектров свидетельствует о том, что атомы имеют сложную внутреннюю структуру. Создал спектральные приборы - спектрометры, позволяющие фотографировать спектры.
Попытки решения проблемы теоретического получения универсальной функции излучения нагретых тел.
Обоснование квантового характера процесса испускания света. Установление формулы Планка, точно описывающей спектр излучения нагретых тел. Введение в физику новой универсальной фундаментальной физической константы – постоянной Планка, h. Установил,
что частоты линий излучения атома
водорода в видимом диапазоне спектра
точно описываются простой формулой:
Установили,
что все линии спектра свечения
атомарного водорода подчиняется
гармонии целых чисел. Спектр состоит
из серий, которые характеризуются
общей формулой:
Открытие атомного ядра. Обоснование планетарной модели атома.
Используя планетарную модель атома Резерфорда и гипотезу Планка о квантовом характере процесса испускания света атомом теоретически получил формулу Ридберга для спектральных серий атома водорода. Постоянная Ридберга в теории Бора выражается через другие фундаментальные физические константы:
|







 1
2
1
2

 3
3



 1
1


 2
2




 4
1
2
4
1
2
Рис. 7. Схема спектрометра на дифракционной решетке. 1 – входная щель, 2 – объективы, 3 – дифракционная решетка, 4 – фотопластинка.
Монохроматическое излучение создаёт на выходе спектрографа изображение входной щели в виде узкой светящейся полоски - линии. Отсюда в физике возник термин: «спектральная линия».

Рис. 8. Черно-белые фотографии атомных спектров водорода, гелия и ртути в видимом диапазоне.
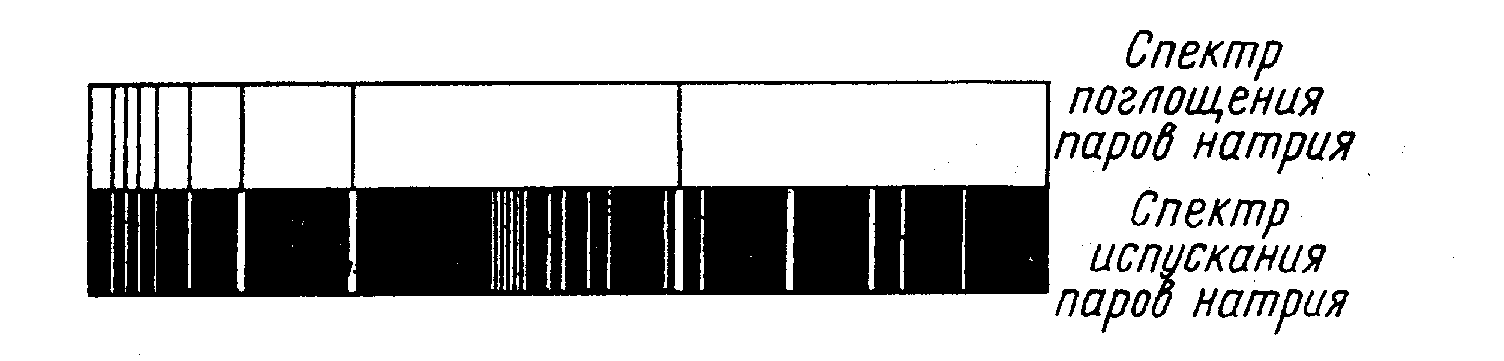
Рис. 9. Спектр испускания содержит больше спектральных линий, чем спектр поглощения. Некоторые спектральные линии поглощения точно соответствуют спектральным линиям излучения натрия.
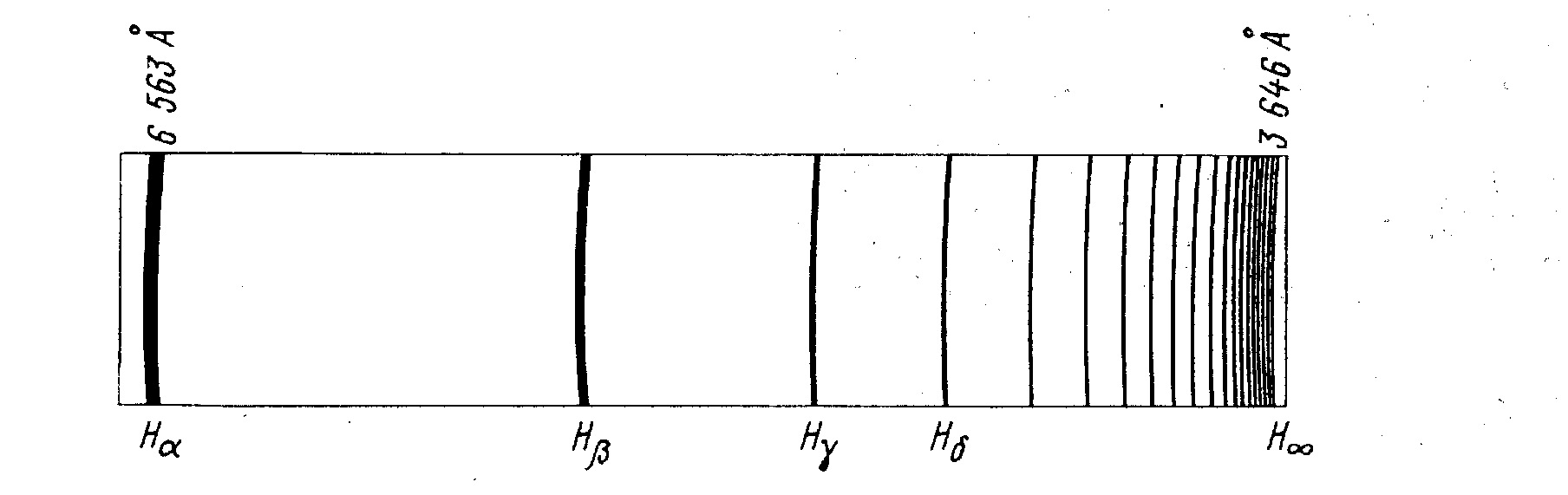
Рис. 10. Бальмеровская серия атомарного водорода.
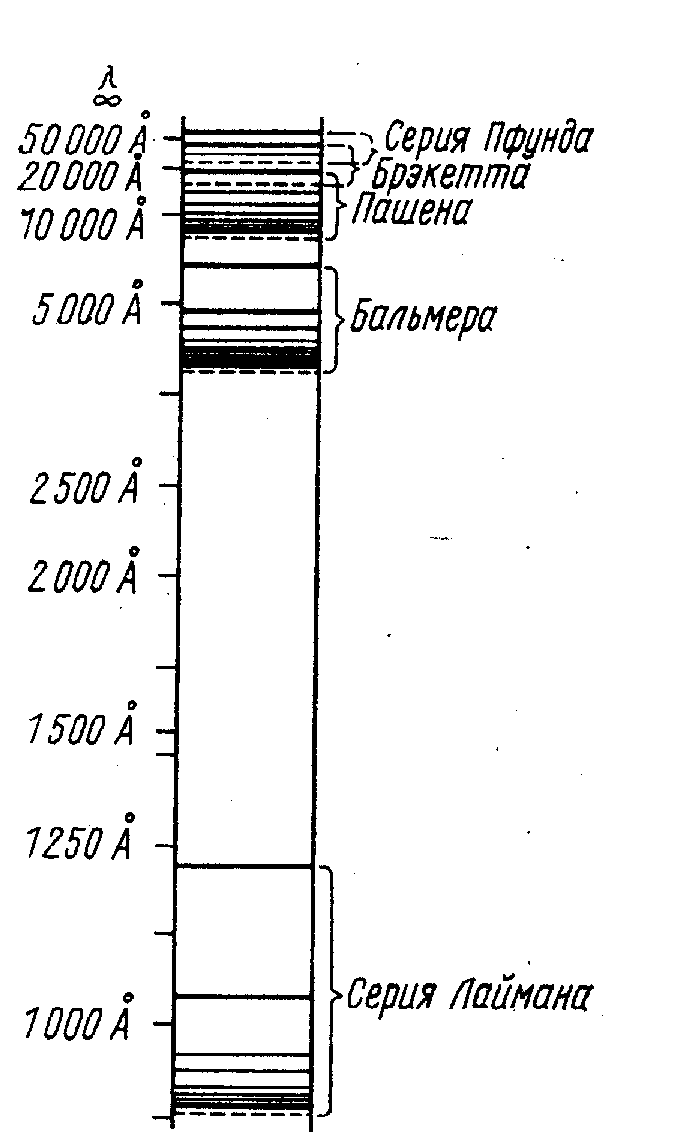
Рис. 11. Спектральные серии атомарного водорода.
Длины волн этой серии подчиняются соотношению Бальмера:
![]()
R = 10973731,534(13) м-1 (современное значение).
Длины
волн излучения атомарного водорода в
ультрафиолетовой области спектра
объединяются в серию, подчиняющуюся
общей формуле:
![]()
Это серия Лаймана.
Открытие атомного ядра
Существование атомного ядра было установлено путем анализа результатов опыта Резерфорда по рассеянию альфа-частиц на золотой фольге. Этот опыт обоснованно считают одним из самых выдающихся достижений физики. Существование объектов в 10 тысяч раз меньших размеров атома было установлено путем измерений, фактически с помощью единственного измерительного прибора – секундомера. По поручению Резерфорда его аспиранты Гейгер и Мардсен производили подсчет числа рассеянных фольгой альфа-частиц в зависимости от угла рассеяния. Попадание альфа-частицы на экран наблюдалось визуально по световой вспышке.
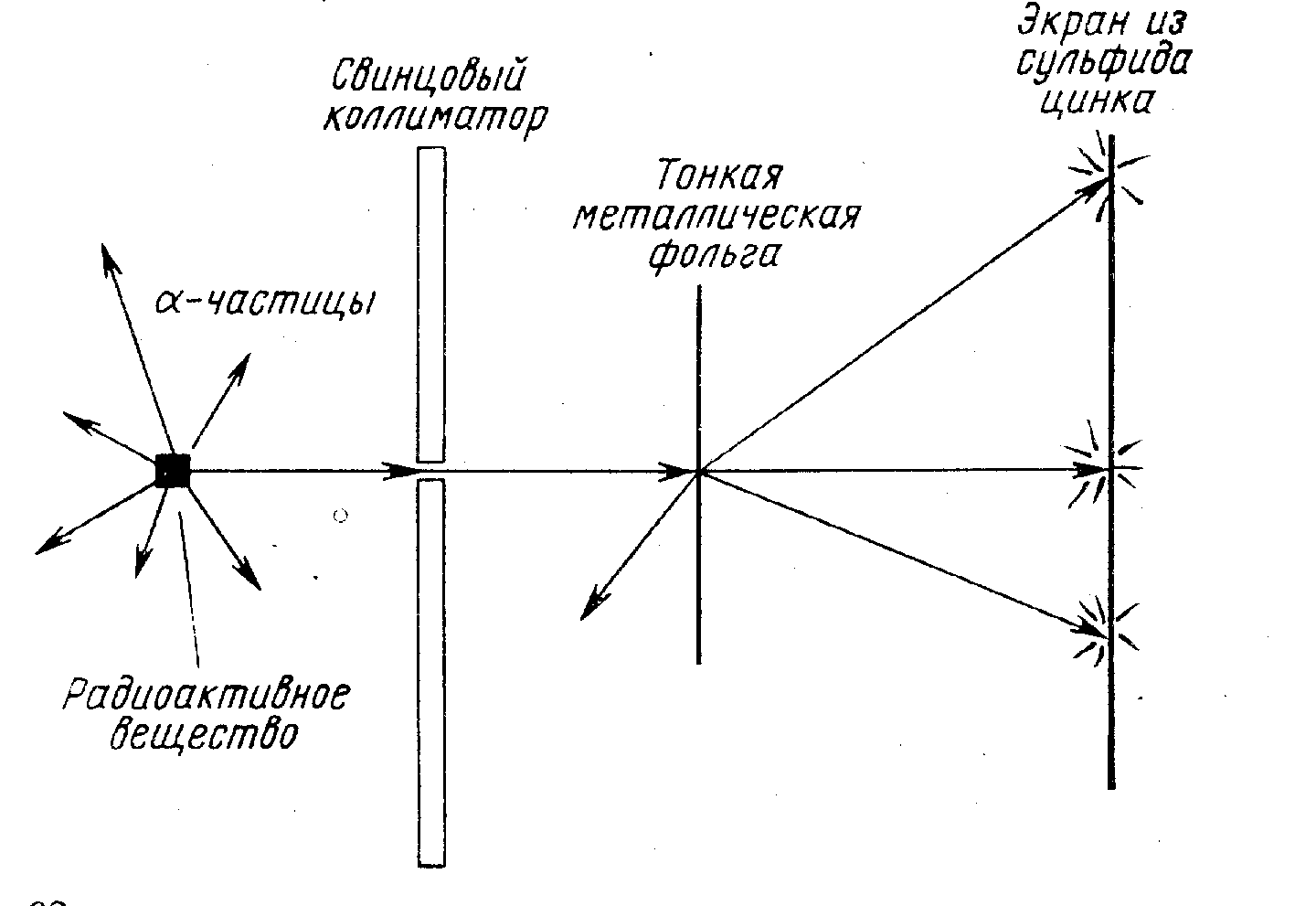
Рис. 12. Схема опыта Резерфорда.

Рис. 13. Рассеяние альфа-частиц на ядрах мишени описывется формулой Резерфорда
(подробное изложение см. в [5]).
Относительное число вспышек, регистрируемых на экране dN/N зависит от угла рассеяния , и телесного угла, в пределах которого заключены углы рассеяния d. N – поток падающих частиц в пучке.
 .
(5)
.
(5)
Из формулы Резерфорда (5) следует, что dN sin4(/2) = const. Это соотношение хорошо оправдывается на опыте при изменениии входящих в него величин в широких пределах.
Из опыта Резерфорда следует принципиальный вывод: масса атома сосредоточена в ядре, имеющем размеры ~ 10-15 м. Размеры ядра на 4 порядка меньше размеров атома.

Рис. 14. Модель атома водорода Резерфорда-Бора.

Рис. 15. Диаграмма энергетических уровней атома водорода.
Элементарная теория Бора для атома водорода приводит к обобщенной формуле Бальмера. Постоянная Ридберга при этом выражается через другие фундаментальные физические константы:
 .
.
Волновые свойства материальных частиц. Волны деБройля
Материальные частицы - это частицы с ненулевой массой покоя – электроны, протоны, нейтроны, мезоны, альфа-частицы, атомы, молекулы...
Гипотеза деБройля: материальные частицы обладают волновыми свойствами.
Свойства
фотона: энергия - h,
релятивистская масса – h/c,
импульс pф
= h/
(V
= c),
=h/pф,
момент
импульса
![]() .
.
Частица массой m, движущаяся со скоростью V имеет импульс p = mV. ДеБройль предположил, что длина волны, связанная с материальной частицей, по аналогии с длиной волны фотона, должна быть равна: =h/p – формула деБройля. Гипотеза ДеБройля блестяще подтвердилась.
Фазовая скорость волны деБройля зависит от её частоты:
![]() .
.
Для электрона с энергией 150 эВ дебройлевская длина волны равна ~ 1Ангстрёму.
Экспериментальное подтверждение гипотезы де Бройля осуществили Дэвиссон и Томсон (Нобелевская премия 1937 г. за открытие дифракции электронов).
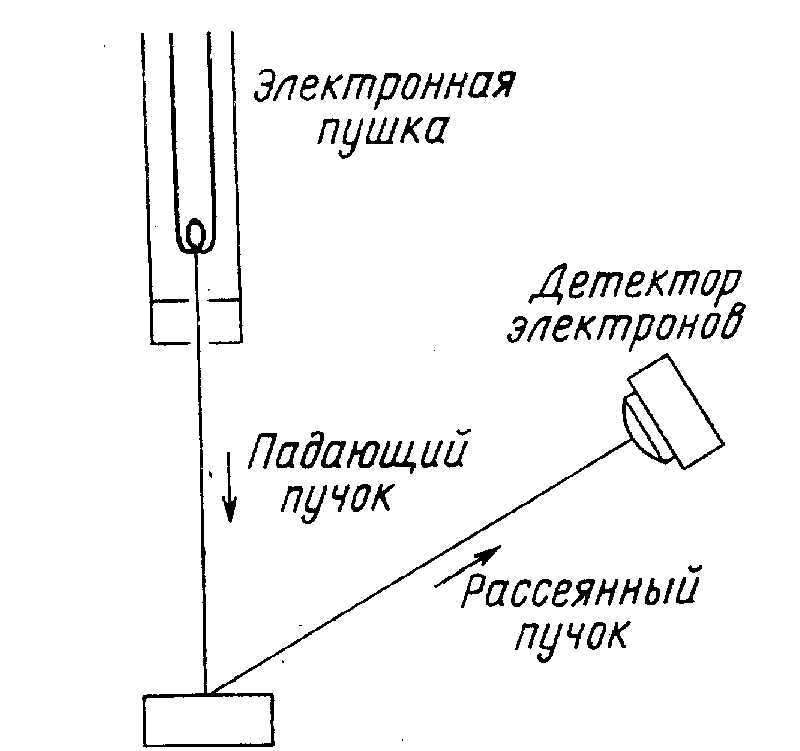
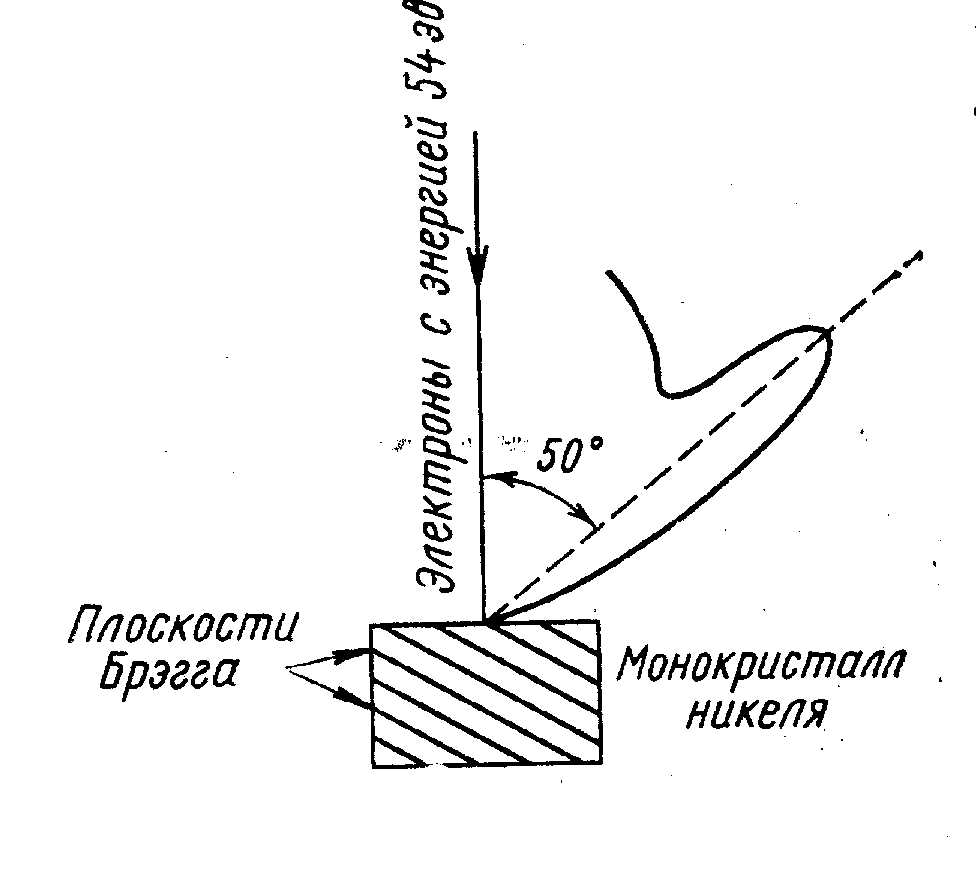
Рис. 16. Эксперимент Дэвиссона и Джермера (1927).
Результаты Дэвиссона и Джермера объясняются дифракцией электронных волн деБройля на кристаллической мишени с упорядоченным расположением атомных плоскостей.
эл = 1,66 Ангстрём. Расстояние а между кристаллографическими плоскостями кристалла никеля равно 0,91 Ангстрём (измерено с помощью рентгеновских лучей). Уравнение Брэгга: n = 2 a sin . Для угла дифракции 50о длина волны совпадает с деБройлевской длиной волны, приведенной выше.
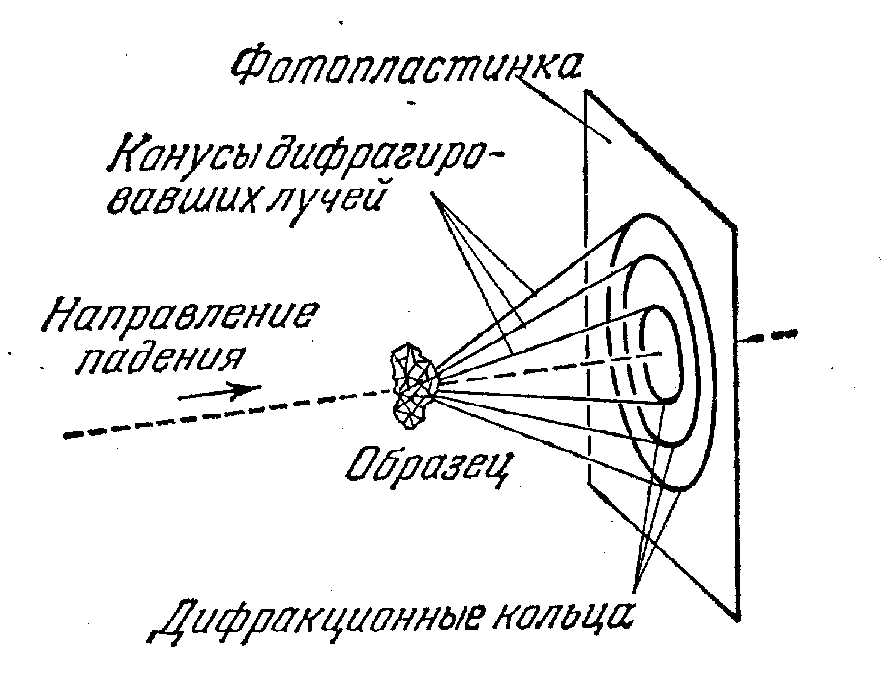
Рис. 17. Дифракция рентгеновских лучей и электронов с такой же дебройлевской длиной волны дают идентичную кольцевую картину при дифракции на одном и том же образце.
Дифракция электронов, наблюдаемая методом Томсона.
Монохроматический пучок быстрых электронов (ускоряющий потенциал от17 до 56 кВ) пропускали через поликристаллическую фольгу толщиной 10-5 см. Импульс электронов и дебройлевская длины волны в нерелятивистском приближении равны:
![]()
длина волны электрона может изменяться от 0,092 до 0,052 нм.
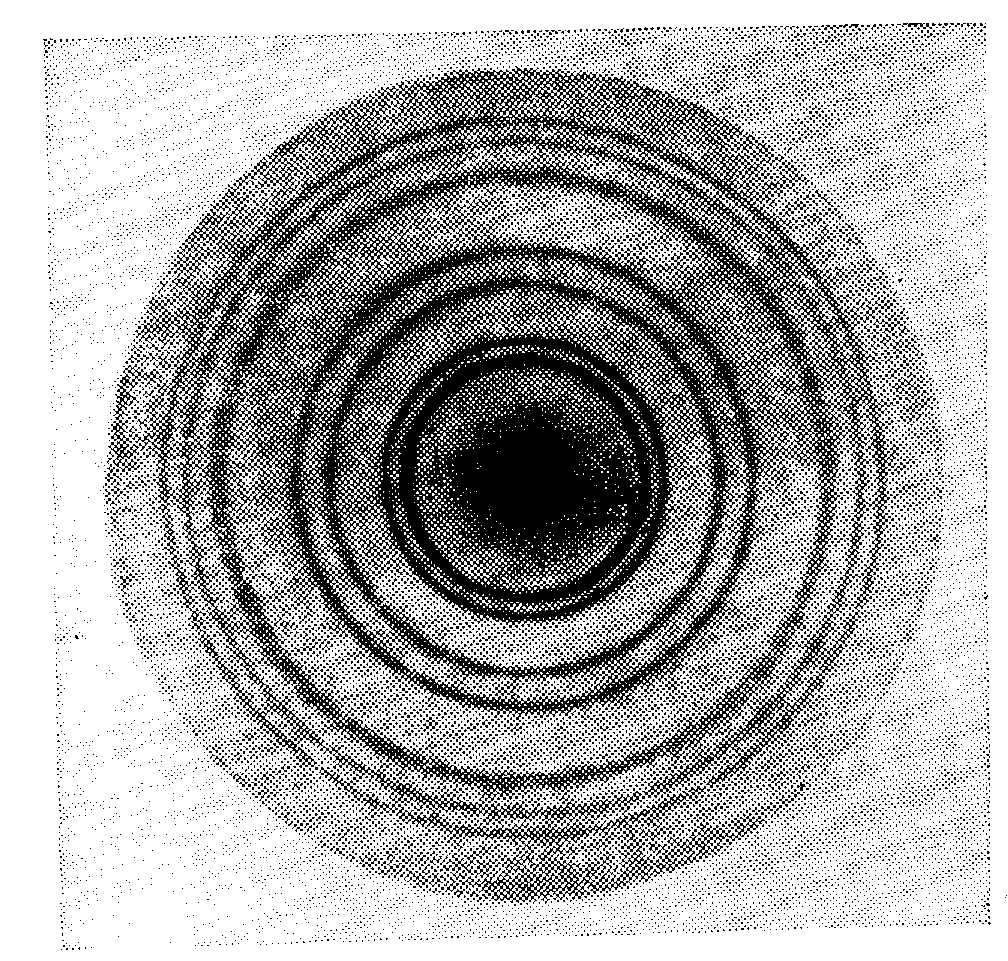
Рис. 18. Картина дифракции электронов на золотой фольге:
Картина образована именно электронами, а не вторичными световыми квантами, т.к. включение магнитного поля на пути пучка электронов до его попадания на образец искажает дифракционную картину. Угол дифракции определяется соотношением Брэгга-Вульфа. Т.о. sin = m/2d, d – межплоскостное расстояние в кристалле.
Аналогичная картина наблюдается при дифракции на том же образце рентгеновских лучей с той же длиной волны.

Рис. 19. Дифракция нейтронов при прохождении пучка нейтронов через кристалл NaCl. (нейтронография).
Существование волновых свойства частиц доказаны экспериментально. Эти свойства нашли многочисленные практические применения в электронографии и нейтронографии для количественного анализа структуры и свойств материалов.
Многие другие эксперименты подтверждают факт: элементарные частицы, атомы и молекулы обладают волновыми свойствами, то есть на самом деле являются не материальными точками, а локализованными волнами.
