
- •Оглавление
- •Введение
- •Исходное сырье
- •Серный колчедан
- •Отходящие газы
- •Характеристика целевого продукта.
- •Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства.
- •Описание технологической схемы процесса.
- •Операторная схема
- •Структурная блок-схема
- •Соблюдение технологических принципов.
- •Ооо «Балаковские минеральные удобрения»
- •Ооо «Балаковские минеральные удобрения»:
- •Список литературы:
Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья. Следующий этап – превращение оксида серы (IV) в оксид серы (VI). Этот окислительный процесс характеризуется очень высоким значением энергии активации, для понижения которой необходимо, как правило применение катализаторов. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SO3 + H2OH2SO4
При проведение процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SO2 + N2O3 + H2OH2SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
Контактный метод.
Появившийся в конце 19 века контактный способ получения серной кислоты сейчас быстро вытесняет нитрозный. Начальная стадия процесса получения серной кислоты по контактному способу совпадает с начальной стадией нитрозного способа - путем сжигания серы получают диоксид серы. А затем в специальных печах происходит окисление диоксида серы до триоксида: SO2 SO3. Соединив последний с водой, получают серную кислоту. Контактный метод подразделяется на два вида: получение серной кислоты из железного колчедана (FеS2) и получение серной кислоты из элементарной серы. Для ускорения процесса в контактном методе используют катализаторы (оксид ванадия).
Чистый V2O5 обладает слабой каталитической активностью, резко возрастающей в присутствии солей щелочных металлов, причем наибольшее влияние оказывают соли К. Промотирующая роль щелочных металлов обусловлена образованием низкоплавких пиросульфованадатов (3К2S2О7 · V2О5, 2К2S2O7 · V2O5 и K2S2O7·V2O5, разлагающихся соответственно при 315-330, 365-380 и 400-405 °С). Активный компонент в условиях катализа находится в расплавленном состоянии.
Схему окисления SO2 в SO3 можно представить следующим образом:
2V5++O2-+SO2 2V4++SO3
2V4++
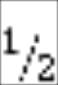 O22V5++O2-
O22V5++O2-
На первой стадии достигается равновесие, вторая стадия медленная и определяет скорость процесса.
Получение H2SO4 из серы
Процесс производства серной кислоты из элементарной серы состоит из следующих основных этапов:
1. подготовка сырья: очистка и плавление серы; очистка, сушка и дозировка воздуха;
2. сжигание серы:
S + O2 = SO2 (1).
Процесс ведут с избытком воздуха. Выделяется очень большое количество теплоты ΔН = -362,4 кДж/моль
3. контактное окисление SO2 в SO3:
SO2+ 0,5O2 = SO3 (2).
на ванадиевом катализаторе при температуре 420-550˚C, тепловой эффект реакции при 500˚C составляет 94,23 кДж/моль;
4. абсорбцияSO3:
SO3 + H2O = H2SO4 (3).
Абсорбционная колонна орошается 98,6% H2SO4. Перед отправкой на склад кислота разбавляется до ~ 93%
Получение H2SO4 из колчедана
Первой стадией процесса является окисление сырья с получением обжигового газа, содержащего диоксид серы:
4FeS2 +11O2 2Fe2O3 + 8SO2 (I)∆Н=-853,8 кДж⁄моль (7117 кДж⁄кг)
При протекании реакции (I) помимо газообразного продукта реакции SO2 образуется твердый продукт Fe2O3, который может присутствовать в газовой фазе в виде пыли. Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений на стадии контактного окисления диоксида серы может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению (вторая стадия), которая помимо очистки от каталитических ядов включает выделение паров воды (осушку), а также получение побочных продуктов (Se и Te).
На третьей стадии протекает обратимая экзотермическая химическая реакция контактного окисления диоксида серы:
SO2 + 1/2O2 ↔ SO3 (III)
Последняя стадия процесса – абсорбция триоксида серы концентрированной серной кислотой или олеумом.
Одной из разновидностей контактного способа получения серной кислоты является способ так называемого «мокрого» катализа. Суть его состоит в том, что после получения диоксида серы, он не разделяется с водой, а вместе с ней подается на катализатор, где окисляется до SO3, который тут же, смешавшись с водой, превращается в серную кислоту.
Нитрозный метод.
Нитрозный способ исторически появился первым, более двух веков назад. Суть его заключается в том, что вначале получают диоксид серы путем сжигания серы, добытой из любого сернистого сырья. Затем в специальных башнях путем смешивания окислов азота NO и NO2 вначале получают азотную кислоту, а затем, путем пропускания через него диоксида серы с водой, получают серную кислоту. Недостатком нитрозного способа является то, что максимальная концентрация серной кислоты, получаемой по этому способу, не превышает 75%, и она более загрязнена, по сравнению с серной кислотой, получаемой по контактному способу. Оксиды азота не расходуются в нитрозном процессе и возвращаются в производственный цикл, вследствие неполного поглощения их серной кислотой они частично уносятся отходящими газами. Достоинства нитрозного метода: простота аппаратурного оформления, более низкая себестоимость (на 10-15% ниже контактной), возможность 100%-ной переработки SO2.
Выбор технологического процесса
Отдельные этапы получения серной кислоты могут быть по-разному скомбинированы в технологическом процессе:
Производство серной кислоты из колчедана методом одинарного контактирования
Производство серной кислоты из серы методом двойногоконтактирования
Производство серной кислоты циклическим методом из серы
Важнейшей задачей в производстве серной кислоты является повышение степени превращения SO2 в SO3. Помимо увеличения производительности по получению серной кислоты выполнение этой задачи позволяет решить и экологические проблемы – снизить выбросы в окружающую среду вредного компонента SO2.
Выбор абсорбента: Диаграмма фазового равновесия пар – жидкость для системы H2O – H2SO4 – SO3 (см. рис.2) показывает, что оптимальным абсорбентом является 98,3%-ная серная кислота (техническое название – моногидрат), соответствующая азеотропному составу. Действительно, над этой кислотой практически нет ни паров воды, ни паров SO3.
Использование в качестве поглотителя менее концентрированной серной кислоты может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой или олеумом в паровой фазе довольно велико равновесное парциальное давление SO3, поэтому он будет абсорбироваться не полностью.Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100˚C. Однако в процессе абсорбции SO3 происходит закрепление кислоты (повышение ее концентрации) и в силу экзотермичности реакции увеличивается температура. Для уменьшения тормозящего влияния этих явлений абсорбцию ведут так, чтобы концентрация H2SO4 при однократном прохождении абсорбера повышалась только на 1 – 1,5%, закрепившуюся серную кислоту разбавляют в сборнике до концентрации 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая высокую кратность циркуляции.
Выбор сырья: Сера как сырье для производства кислоты имеет ряд преимуществ:
В отличие от серного колчедана, почти не содержит примесей, которые могли бы собой представлять каталитические яды.
При ее сжигании не образуются твердые и иные отходы, которые требовали бы складирования .
Серу значительно дешевле транспортировать.
Один из наиболее рациональных методов решения этой задачи, повсеместно применяемый сернокислой промышленности, - метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3. В оставшемся реакционном газа соотношение O2 :SO2 существенно повышается, что приводит к смещению равновесия реакции вправо (равновесная кривая 2 на рис. 2). Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном – двух слоях катализатора достигают 95% степени превращения оставшегося SO2. Суммарная степень превращения SO2 составляет в таком процессе 99,5-99,8%.
Рис.4 Ход
каталитического окисления SO2
в полочном реакторе.

Равновесные кривые: 1 – для исходного реакционного газа (первая ступень контактирования в схемах ДКДА), 2 - для реакционной смеси после промежуточной абсорбции SO3; адиабаты последнего слоя реактора, 3 – при одинарномконтактировании, 4 – при двойном контактировании.
