
- •Оглавление
- •Введение
- •Исходное сырье
- •Серный колчедан
- •Отходящие газы
- •Характеристика целевого продукта.
- •Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства.
- •Описание технологической схемы процесса.
- •Операторная схема
- •Структурная блок-схема
- •Соблюдение технологических принципов.
- •Ооо «Балаковские минеральные удобрения»
- •Ооо «Балаковские минеральные удобрения»:
- •Список литературы:
Серный колчедан
Главной составной частью серного колчедана является сульфид железа FeS2.(53,44 % S и 46,56 % Fe). Серный колчедан – минерал желтоватого или желтовато-серого цвета, плотность его около 5000 кг/м3. Колчедан, применяемый для обжига, предварительно обогащают флотацией. Флотационный колчедан кроме пирита FeS2 содержит ряд примесей (мышьяк, селен, теллур, фтор), которые при обжиге переходят в состав обжигового газа в виде оксидов и фторсодержащих газовых соединений. Наличие этих соединений обуславливает необходимость последующей очистки газа.
Отходящие газы
В процессе обжига различных руд и концентраторов, образуются отходящие газы, содержащие диоксид серы и являющиеся ценным сырьем для производства серной кислоты. При использовании в качестве сырья природных газов отпадает необходимость первой стадии (обжиг серосодержащего сырья), поскольку в этом случае обжиг сульфидов является одной из стадий других технологических процессов.
Характеристика целевого продукта.
Серная кислота (H2SO4) является сильной двухосновной кислотой. При нормальных условиях концентрированная серная кислота представляет собой маслянистую, без цвета и запаха, жидкость.
Серная кислота может существовать как самостоятельное химическое соединение, а также в виде соединений с водой H2SO4*nH2O и с триоксидом серы H2SO4*nSO3. В технике серной кислотой называют безводную H2SO4, ее водные растворы и растворы триоксида серы в безводной H2SO4 – олеум.
Безводная серная кислота – тяжелая маслянистая бесцветная жидкость (может быть окрашена примесями в темный цвет), смешивающаяся с водой (с выделением большого количества теплоты) и триоксидом серы в любом соотношении. Плотность H2SO4 при 0ºC равна 1,85 г/см3. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава.
На диаграмме кристаллизации системы H2O-H2SO4-SO3(рис. 3) максимумы отвечают составу соединений H2SO4•nH2Oили H2SO4•nSO3. Наличие минимумов объясняется тем, что температура кристаллизации смесей двух веществ ниже температуры кристаллизации каждого из них.
Рис. 3. Диаграмма
кристаллизации серной кислоты.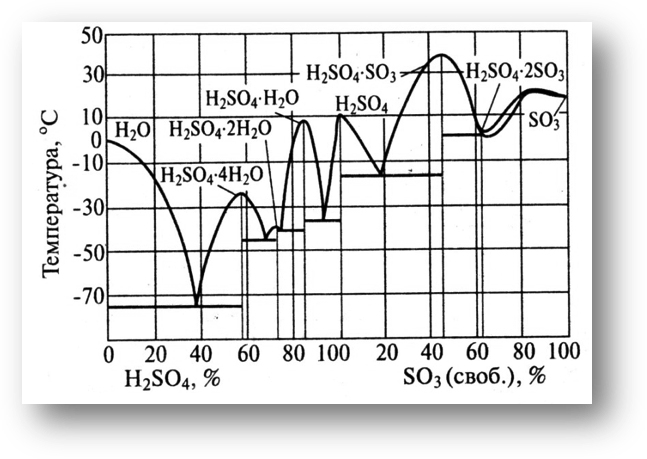
Безводная 100%-ная серная кислота имеет сравнительно высокую температуру кристаллизации - 10,7ºC. Поэтому хранение и транспортировка такой кислотыдовольно сложна. Серная кислота, содержащая всего 6.4% чистой воды, замерзает уже при -37.9oC. Такую кислоту можно перевозить в любое время года. При дальнейшем увеличении содержания воды до 15% серная кислота начинает замерзать около +8oC. Если же содержание воды увеличить до 25%, то кислота опять начинает замерзать при низкой температуре -41.0oС. Таким образом, башенная кислота, содержащая 75% чистой серной кислоты, не боится самых сильных морозов, и её можно перевозить даже в самые холодные районы страны. Также используются 92,5% контактная кислота и олеум – 20 % своб. SO3.
Рис. 2. Зависимость
температуры кипения серной кислоты
при атмосферном давлении от ее состава.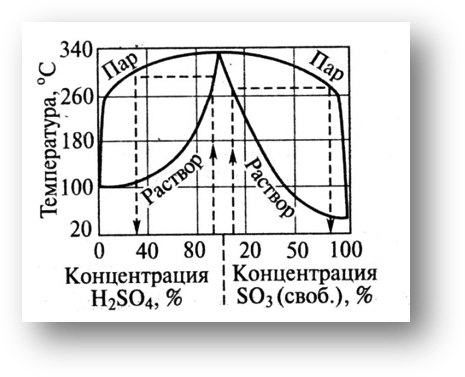
Из диаграммы следует, что серная кислота и вода образуют азеотропную смесь состава 98,3% H2SO4 и 1,7% H2O с максимальной температурой кипения (336,5˚С). Состав находящихся в равновесии жидкой и паровой фаз для кислоты азеотропной концентрации одинаков; у более разбавленных растворов кислоты в паровой фазе преобладают пары воды. В паровой фазе над олеумом высока равновесная концентрация SO3. Эту диаграмму используют для определения режима абсорбции SO3 и концентрирования разбавленной серной кислоты при выпаривании из нее воды.
Пары серной кислоты при повышении температуры диссоциируют:
H2SO4 ↔ H2O + SO3
и нагревание выше 400˚С вызывает диссоциацию SO3:
SO3 ↔ 2 SO2 + O2
Выше 700˚С в парах преобладает SO2, Степень диссоциации меняется при изменении давления.
Серная кислота весьма активна. Она растворяет оксиды металлов и большинство чистых металлов, вытесняет при повышенной температуре все другие кислоты из солей. Серная кислота вступает в реакции обменного разложения, энергично соединяется с водой, обладает окислительными и другими важными свойствами. Она отнимает воду от других кислот, от кристаллогидратов солей и кислородных производных углеводородов. Целлюлоза, крахмал и сахар разрушаются в концентрированной серной кислоте. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека концентрированная серная кислота вызывает ожоги.
Серная кислота – реактив изготавливается по ГОСТ 4204-77
Техническая серная кислота по ГОСТ 2184-77
Аккумуляторная серная кислота изготавливается в соответствии с ГОСТ 667-73
Рассмотренные свойства серной кислоты необходимо учитывать как при выборе технологического режима процесса, так и при проектировании отдельных аппаратов, трубопроводов и т. д. Например, при размещении цеха на открытой площадке необходимо предусмотреть теплоизоляцию трубопроводов, по которым циркулируют растворы серной кислоты, имеющие достаточно высокие температуры кристаллизации. Учет диаграммы фазового равновесия паров и жидкости позволяет правильно выбрать условия проведения стадии абсорбции триоксида серы, обеспечивающие высокую степень абсорбции и предупреждающие побочные явления, такие, например, как образование сернокислотного тумана.
