
Тема 9 Окислительно-восстановительные реакции...
9.1. Основные понятия и определения.
Реакции, протекающие с изменением степеней окисления элементов - окислительно-восстановительные реакции. Название «окислительно-восстановительные реакции» сложилось исторически по названию процессов, известных с давних пор, - процесса окисления металлов и процесса восстановления металлов из них оксидов. В настоящее время к ОВР относят не только реакции с участием кислорода, но и все процессы, сопровождающиеся изменением степени окисления элементов.
Изменение степеней окисления элементов может происходить двумя способами:
1) за счет перехода электронов от одних частиц к другим;
2) за счет перехода атомов от одних частиц к другим.
Пример
Процесс, в результате которого степень окисления элемента повышается, называется окислением. Процесс, в результате которого степень окисления элемента понижается, называется восстановлением. Повышение и понижение степени окисления элементов происходит одновременно и обуславливают друг друга.
Вещества, в состав которого входит элемент, повышающий степень окисления, называют восстановителем. Вещество, в состав которого входит элемент понижающий степень окисления, называют окислителем. (другими словами, окислитель других окисляет, а сам при этом восстанавливается, а сам при этом восстанавливается, а восстановитель – других восстанавливает, а сам при этом окисляется, т.е. подвергается окислению).
Окислитель может проявлять свою функцию только тогда, когда в химической систем одновременно присутствует и восстановитель, - и наоборот.
Так, Fe+3Cl3 является довольно сильным окислителем, но принимать электрон может только при наличии в растворе какого-либо восстановителя, способного этот электрон отдать, например SnCl2:
2 FeCl3 + SnCl2 ↔ 2 FeCl3 + SnCl4 или 2 Fe3+ + Cn2+ ↔ 2 Fe2+ + Sn4+
Здесь железо (окислитель) понижает свою степень окисления, а олово (восстановитель) повышает свою степень окисления.
Для составления уравнений ОВР (определение коэффициентов и продуктов реакции), применяют два метода: метод электронного баланса и метод полуреакции (ионно-электронный метод). Метод электронного баланса основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю. Он позволяет на формальной основе установить стехиометрические отношения в процессе окисления-восстановления в любых гомогенных и гетерогенных системах. Метод полуреакций (ионно-электронный метод) основан на составлении частных уравнений (в ионно-молекулярной форме) реакции восстановления ионов (молекул) окислителя и окисления ионов (молекул) восстановится с последующим их суммированием в общее ионно-молекулярное уравнение. Особенности этого метода: составление уравнения начинается с составления ионной схемы реакции в ионной форме, при этом в схему включается реально существующие в растворе частицы – молекулы и ионы (не изменяются результате реакции ионы в ионную схему не включаются); поскольку рассматриваются реальные частицы с их зарядами, нет необходимости определять степени окисления элементов; метод позволяет учитывать влияние среды на характер О-В процесса. Так, если исходное вещество содержит больше кислорода, чем продукт реакции, то освободившийся кислород в форме О2- связывается в кислых растворах ионами Н+ в воду:
Например: MnO-4 +8H+ + 5e → Mn2+ + 4H2O
А в нейтральной растворах – молекулами волы в гидроксид-ионы;
Например: MnO-4 + 2 H2O +3e → MnO2 + 4OH-
Если исходное вещество содержит меньше атомов кислорода, чем продукт реакции, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, например: SO3- + H2O – 2e → SO2-4 + 2H+, а в исходных растворах – за счет гидроксид-ионо, например: SO2-3 + 2 OH- - 2e → SO2-4 + H2O.
Во всех этих переходах происходит изменение кислотности среды но оно не может быть слишком резким – из щелочного раствор может стать только нейтральным, но не кислотным; из кислого – тоже тока нейтральным, но не щелочным.
9.2 ОВР. Типичные окислители и восстановители.
Различают три типа реакций окислителя-восстановления.
1. ОВР, при которых изменяются степень окисления атома элементов, входящих в состав разных веществ. Все приведенные выше реакции относятся к этому типу реакций.
2. Реакции ОВ распада веществ, при котором степени окисления изменяют атомыразных элементов одного и того же вещества.
Например:
3. Реакции самоокисления – самовосстановления, пи которых степень окисления одного и того же элемента и повышается, и понижается. К этому типу реакций относятся реакции диспропорционирования (элемент в промежуточной точкой степени окисления Эу одновременно повышает Эх и понижает Эе свою степень окисления.
Например:
Только окислительными свойствами обладают вещества, в которых атомы находятся в высшей степени окисления, например: F2; HNO3; H2SO4; K2Cr2O7; KMnO4, PbO2; SnCl4.
Только восстановительными свойствами обладают вещества, в которых атомы находятся в низшей степени окисления, например: Cl-, Br-, S2-, N3-, а также все метлы – Na0, Ca0, Al0 и т.д.
И окислительными и восстановительными свойствами (т.е. окислительно-восстановительной двойственностью) обладают вещества, содержащие атомы в промежуточной степени окисления, например: H2SO4; HNO3; PbO, а также все неметаллы, кроме F2, Cl2-, Br2 и т.д.
К типичным окислителям относятся:
1. простые вещества, атомами элементов неметаллов 6-7 группа, имеющими достаточно большую электроотрицателность и способности восстанавливаться до соответствующих простых анионов Например: F2, О3, О2, Cl2, Br2 и др.
2. Анионы кислородсодержащих кислот, образованных р- и d- элементов в высоких степенях окисления : NO-3; SO-4; СlO-4; Cr2O72-; MnO-4 и др.
При восстановлении они могут переходить в газообразное оксиды (NO), кислородные анионы (MnO-4), простые вещества (s), одноатомные анионы и катионы (Сl-).
3. Многозарядные катионы р- и d- элементов например Fe3+, способные перейти в катионы с меньшим зарядом (Fe2+) или простые веществ соответствующие металлы.
К типичным восстановителям относятся:
1. простые вещества – металлы (Li, Na, K, Ca и т.д.)
2. Одноатомные анионы (Cl-, S2-) и молекулы, содержащие атомы в низкой степени окисления (CH4, NH3)
3. Многоатомные анионы и молекулы, содержащие атоы элементов в промежуточных степенях окисления, например : NO-2; SO-2.
4. Молекулярные катионы р- и d- элементов например Fe2+; S2+.
Однако в большинстве случаев, для веществ, содержащих атомы элементов в промежуточной степенях окисления, относящихся к «типичным окислениям» или «типичным восстановителям» так молекулярный водород чаще всего действительно проявляет восстановительные свойства, но в реакциях образования гидридов он играет роль окислителя.
На протекания окислительно-восстановительных реакций, их направления, скорость влияют многие факторы: природа реагирующих веществ, плотность среды, концентрация, температура, катализатор и другие.
9.3 Направление протекание окислительно-восстановительных реакций.
Критерием
возможности самопроизвольного протекания
окислительно-восстановительный реакций,
как и других химических процессов,
является отрицательное значение
изменения энергии Гиббса
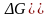 (помним: если
(помним: если
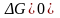 ,
самопроизвольно идет не в прямом, а в
обратном направлении; если
,
наступает химическое равновесие, когда
скорости прямой и обратной реакции
равны).
,
самопроизвольно идет не в прямом, а в
обратном направлении; если
,
наступает химическое равновесие, когда
скорости прямой и обратной реакции
равны).
Пример.
Для
окислительно-восстановительных реакций,
протекающих в водных растворах, есть
еще один критерии возможности
самопроизвольного протекания процесса
– положительное значение электродвижущей
силы. (ЭДС)
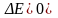 (понятно, что если
(понятно, что если
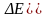 ,
то реакция самопроизвольно протекает
не в прямом, а в обратном направлении;
если
,
то реакция самопроизвольно протекает
не в прямом, а в обратном направлении;
если
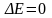 ,
то наступает химическое равновесие).
,
то наступает химическое равновесие).
Связь
между величинами
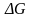 и
и
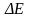 выражается уравнением :
выражается уравнением :
- =nF , где :
- изменение энергии Гиббса; Дж;
n – кол-во вещества электронов, участвующих в окислительно-восстановительном процессе; моль;
F – постоянная Фарадея; F=96485 Кл/моль;
- электродвижущая сила; В.
Пример.
Взаимосвязь между K, и часто используется для точных электрохимических определений К и окислительно-восстановительных реакции, т.к. значения можно измерять с высокой точностью. Величина (электродвижущая сила) как критерий окислительно-восстановительных реакции, протекающих в водных растворах, очень удобна еще и тем, что ее действительно просто можно рассчитать по формуле:
=EОК – ERED или для стандартных условий 0= E0ОК – E0RED , где EОК и E0ОК – восстановительные потенциалы полуреакций, содержащих окислитель; В;
ERED и E0RED – восстановительные потенциалы полуреакции, содержащих восстановитель; В;
Значения стандартных восстановительных потенциалов ( 0) для многих полуреакций известны, их можно найти в справочнике под названием стандартных окислительно-восстановительных потенциалов, стандартных ряд-окспотенциалов или стандартных электродных потенциалов.
Сущность возникновения восстановительного потенциала заключается в следующем. Каждый элементарный опт окисления-восстановления связей с передачей электронов: Ox+ne ↔ Red, где
Ox – окисленная форма
Red – восстановительная форма
При этом между окисленной формой и восстановительной формой возникает разность потенциалов, называемая окислительно-восстановительным потенциалом.
Окислительно-восстановительный процесс состоит из двух полуреакций:
Восстановлений Ox1+ne ↔ Red1
Окисления Red2 ↔ Ox2+ne
Общее уравнение окислительно-восстановительной реакции: Ox1 + Red2↔ Ox2+ Red1
Однако, если окислительно-восстановительное взаимодействие протекает в одном растворе, то вследствие беспорядочного перемещения электронов и ионов суммарный ток, обусловленный передачей электронов от восстановителя к окислителю, равен нулю. Поэтому для определения (нахождения опытным путем) восстановительных потенциалов необходимо особым образом организовать окислительно-восстановительный процесс: разделить процесс окисления и процесс восстановления пространственно, тогда при замыкании внешней цепи наблюдается направленное перемещение электронов. Однако абсолютное значение восстановительного потенциала измерить невозможно, поскольку введение любых измерительных зондов неизбежно приводит к новой контактной разности потенциалов. Поэтому вместе с измерительным электродом используют электрод сравнения. В качестве стандартного электрода сравнения используют стандартный водородный электрод, потенциал которого условно принят за нуль:
2H+(P)+2e = H2(Г)
Водородный электрод представляет собой платиновую пластину, покрытую тонким слоем рыхлой пористой платины (пористой- для увеличения поверхности электрода) и опущенную в водный раствор серной кислоты. Через раствор серной кислоты пропускают водород. Часть поглощенного платина водорода переходит в атомное состояние, поэтому в поверхностном слое платины устанавливается равновесие H2 ↔ 2H, а на границы платины и раствора серной кислоты – равновесие, т.е суммарно: H2(Г) ↔ 2H+ + 2e ; E0 =0,00 В.
Найденные таким образом восстановительные молекулы позволяют характеризовать окислительную способность окислителей и восстановительную способность восстановителей.
За пару окислительной способности окислителя, принят его стандартный восстановитель потенциала по отношению к стандартному водородному электроду. Положительный знак потенциала для определенной полуреакций говорит о том что в нее входит окислитель более сильный, чем водородный ион, а отрицательный – что в нее входит восстановитель более сильный, чем водород.
Пример.
Восстановительные потенциалы не являются неизменными. Они зависят от соотношения концентраций (точнее активностей) окислительной и восстановительной форм элемента, а также от температуры, природы растворителя, pH среды и пр.
Зависимость электродного потенциала от концентрации окислительной и восстановительной форм и температуры выражает Ур-ние Нернета:
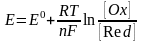 Для
стандартного условия Нернета принимает
вид:
Для
стандартного условия Нернета принимает
вид:
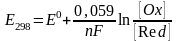 ;
;
В тех случаях, когда ионы водорода или гидроксида принимают участие в поуреакций, ее потенциал увеличивается с подкислением (уменьшением pH) уменьшается с подщелачиванием (увеличение pH). Если атом H+ или OH- не входят в уравнение полуреакции, то потенциал не зависит от pH.
Пример.
В общем случае: реакция должна самопроизвольно пойти в том направлении, для которого разность потенциалов (ЭДС) при данных условиях положительна и наибольшая. Окислителем в реакции будет окислитель с большим потенциалом, а восстановителем – восстановитель с меньшим потенциалом.
Пример.
Итак практика показывает, что при отсутствии кинетических ограничений:
1)
ре-ция идет до конца (т.е. практически
необратима), если
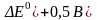
2)
ре-ция не идет совсем (зато до конца
идет обратимая реакция), если
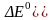
3)
направление реакции можно изменить,
если
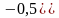
4)
если данные окислитель и восстановитель
могут участвовать в нескольких переходах
– будет существовать тот переход, для
которого
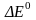 максимально.
максимально.
9.4.электрохимические процессы.
Переход электронов от восстановителя к окислителю является непременным атрибутом окислительно-восстановительных ре-ций. Поэтому при пространственном разделении процесса окисления восстановителя и процесса восстановления окислителя , электрический ток (направление движения электронов) может либо возникать в качестве продукта реакции, либо использоваться как реагент.
Область химии, которая устанавливает закономерности взаимодействия и взаимосвязи химических и электрических явлений, носит название электрохимии.
Процессы взаимного превращения химической и электрической формы энергии называются электрохимическими процессами.
Электрхим. Процессы можно разделить на две основные группы:
1) процессы превращения химической энергии в электрическую ( в гальванических элементах);
2) Процессы превращения электрической энергии в химическую (электролиз). Простейшая электрическая система состоит из двух электродов, находящихся в контакте с ионным проводником. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрической системы.
К общим закономерностям электрохимических процессов относятся законы Фрадея (1833-1834), термодинамика и кинетика электрохимических процессов. С учетом современной термодинамики законы Фарадея можно сформулировать так:
1)
Кол-во вещества, испытавшего
электрохимические превращения на
электроде, прямо проницательно количеству
прошедшего электричества
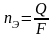
Где nЭ – кол-во эквивалентов вещ-ва, моль;
Q – кол-во электричества; Q=I*t; I-сила тока.
F - постоянная Фарадея; F=96,485 Кл/моль
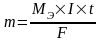
2) Масс прореагировавших на электродах веществ при постоянном кол-ве электричества относятся друг к другу как полярных масса их эквивалентов.
Процессы окисления в электрохимии получили названия анодных процессов, а электроды, на которых идут процессы окисления, называться анодами.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами.
Химические источники электрического тока. Все химические источники тока используют процессы с уменьшением энергии Гиббса системы следовательно ЭДС. Теоритически для получения электрической энергии можно применить любую окислительно-восстановительную реакцию, в ходе которой оказывается возможным протекания процессов:
1) ре-ция окисления анода (или окисления восстановителя на аноде);
2) ре-ция восстановления ионов электролита на катоде;
3) движение электронов во всей цепи от анода к катоду;
4) движение ионов в растворе: анионов к аноу, катионов к катоду.
Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Гальванические элементы могут быть поучены не только из двух разных электродов, но и из двух одинаковых. Однако в этом случае, они должны быть получены в растворе с различными активностью иона. При этом электрод, помещенный в раствор, в котором активность иона меньше, выполняет функцию анода, а электрод, помещенный в раствор с более высокой активностью иона, выполняет функцию катода. Такие гальванические элементы получили название концентрационные.
Любой гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, которую он может отдать во внешнюю цепь, а также сохраняемостью ЭДС элемента определяется термодинамическими функциями протекающих в нем процессов. Напряжение элемента U меньше ЭДС из-за поляризации электродов и оптических потерь:
U= - I(r1-r2) - 1 , где r1 и r2 – сопротивление проводников в гальваническом элементе;
1 – поляризация элемента, равная сумме катодной и анодной поляризации.
Изменение потенциала электрода при прохождении тока называется поляризацией: =Ei-EP, где - поляризация; Ei- потенциал электрода при прохождении тока; EP – равновесный потенциал.
Поляризация возрастает с увеличением плотности тока,. Кроме того, при увеличений плотности тока растет омическое падение, напряжения. Таким образом, при увеличений плотности тока напряжение элемента падет. По мере работ элемента (разряда) уменьшается концентрация исходных реагентов и увеличивается концентрация продуктов реакции, по этому ЭДС элемента уменьшится. Кроме того, возрастает поляризация элемента. Поэтому при разряде элемента напряжение его постепенно снижается.
В настоящее время к первичным хим. Источникам тока относятся первичные (гальванические) элементы, теряющие работоспособность после разряда; вторичными элементы (аккумуляторы) которые после разрядки можно многократно заряжать снова, а также топливные элементы, в которых на нерасходуемых электродах идет реакция между окислителем и восстановителем, поступающем извне.
Примеры… 1-ого – батарейки, 2-ого аккумуляторы .
Существует еще один вид самопроизвольного процесса, идущий за счет образования микрогальваиопер??? (микрогальванических элементов) и который вместе с тем, строго говоря нельзя отнести к электрохим.
Этот процесс – электрохимическая коррозия.
Коррозией называется разрушение металлов под воздействием внешней среды. Принято выделить химическую коррозию и электрохимическую. Химическая коррозия – процессы взаимодействия металла с окружающей средой протекающие по механизму гетерогенной ре-ции.
Электрохимическая коррозия является результатом протекания нескольких сопряженных ре-ции в средах, имеющих ионную проводимость. Причем общая ре-ция вследствие существовании ионов в электролите и свободных электронов в металле может разделиться на две в значительной мере самостоятельных процесса: 1) анодный процесс – окисление металла; 2) катодный процесс – восстановления окислителя.
Окислителями при коррозии ? молкулы кислорода О2, хлора, иона H+ и др. наиболее частыо при коррозий наблюдается восстановление растворенного в электричестве кислорода: пример.
Главной причиной коррозии металла чаще всего является энергетическая неоднородность поверхности металла, вследствие чего появляются анодные и катодные участки металла, которые чередуются и имеют очень маленькие размеры, т.е. речь идет о возникновении микроанодов и микрокатодов а следовательно, о возникновений короткозамкнутых коррозионных микроэлементов. Причиной энергетически неоднородности металла и сплава могут быть неоднородности сплава по химическому и фазовому составам, наличие примесей в металле,. Анодные участки обычно характеризуются меньшим электродным потенциалом, и именно на них будут проявляться материальные потери... Катодные участки обычно характеризуються большим потенциалом в данной среде; на них существенных потерь метала не будет. Если потенциал металла больше потенциала кислородного электрода, то коррозия металла невозможна. Если потенциал металла больше потенциала водородного электрода, но меньше потенциала кислородного электрода, то коррозия металла возможна, как с поглощением кислорода, так и с выделением водорода.
Электролиз, в отличие от всех рассмотренного выше процессов не является самопроизвольным процессов.
Электролиз – совокупность процессов, происходящих при прохождении электрического тока через электрохимическую схему, состоящего из двух электродов и расплава или раствора электролита.
Для осуществления электролиза к отрицательному потоку внешнего источника тока присоединяют катод, а к положительному катоду –анод, и погружают их в электролит. При прохождении тока через электролит катионы под действием электрического поля движутся к катоду, а анионы – к положительному электроду – аноду.
При рассмотрении электролиза водных растворов необходимо помнить, что кроме ионов электролита во всяком водном растворе есть также ионы H+ и OH- - продукты диссоциации воды. Таким образом у катода могут разрежаться катионы электролита, так и катионы водорода. У анода могут разряжаться как анионы электролита, так и гидроксид-иона. Кроме того, молекулы воды также могут подвергаться электролитичекому окислению или восстановлению.
Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии.
Рассмотрим послеледовательность разряда ионов при электролизе водных растворов для наиболее простых случаев.
Последовательность катодных процессов: Так как на катоде идет реакция восстановления, т.е. прием электронов, то в первую очередь должны реагировать наиболее сильные окислители. На катоде прежде всего протекает ре-ция с наиболее положительным потенциалом.
Для катодного восстановления при электролизе водного раствора электролита все окислители можно разделить на три группы:
А) ионы металлов, потенциал которых существенно более отрицателен, чем потенциал водородного электрода. В водных растворах разряд этих ионов на катоде практически не происходит, т.к. на катоде выделяется водород.
Б) окислители, потенциал которых более положителен, чем потенциал водородного электрода. К ним относятся ионы Cu, Ag, Au, платина новых металлов, а также кислород и др. При наличии этих веществ в Ра створе или у электрода они разряжаются в первую очередь, и разряд ионов H не происходит.
В) ионы, потенциал которых относительно мало отличается от потенциалов водородного электрода. К ним относятся ионы Sn, Pb, Ni, Co. И других металлов находящихся в ряду стандартных потенциалов между алюминием и водородом. В этом случае могут идти одновременно оба процесса и разряд ионов металлов и разряд ионов с выделением водорода.
Последовательность анодных процессов: На аноде протекают ре-ции окисления восстановителей, т.е. отдача электронов восстановителем, поэтому в первую очередь на аноде должны реагировать наиболее сильные восстановители – вещества имеющие наиболее отрицательный потенциал.
На аноде при электролизе водных растворов может протекать несколько процессов:
А) окисление металла(«растворение» активного анода)
Б) окисление OH с выделением кислорода
В) окисление других веществ, присутствующих в растворе или около анода.
Если анод активный(металл в ряду стандартных электронных потенциалов до Ag), То идет его растворение.
Если анод инертный, то идет окисление ионов в следующем порядке ( в это ряду активность к окислению на аноде убывает) I, Br, Cl, S, JY, So4, No3, ClO4.
При электролизе водных растворов веществ, содержащих бескислородне ионы (за исключением фоторид-ионов), на аноде происходит их разряжение. При электролизе водных растворов веществ, содержащих кислородсодержащие ионы, на аноде разряжаются гидроксид-ионы или молекулы воды.
Тема 11Краткий обзор хим-х s- и p- элементов Вещ-ва состоящие из атомов одного и того же хим-го элемента,называют простыми...Мол-лы простых вещ-в могут быть одно-, двух,и многоатомными. Аллотропная модификация-способность элементов к образованию 2-х или нескольких простых вещ-в.Аллотропия м.б. обусловлена или различным числом атомов данного элемента в мол-ле вещ-ва,пр:кислород О2 и озон О3, или различной кристаллич-й структурой образующихся модификаций,пр:олово серое и белое. Полиморфизм-способность вещ-ва при определенных температурах(давлениях) образовывать в твердом состоянии различные типы кристалл. Структур.
……………………………….
Свойства р-элементов 3 группы К р-элементам 3 группы относятся:бор, алюминий, галлий Ga,индий и талий.Электронная конфигурация атомов ns2np1. На свойствах р-элементов 3 группы сказывается d-сжатие.Так от Al к Ga атомный радиус несколько уменьшается, а первй ионизационный потенциал возрастет. Бор. В соответствии с электронной структурой атома(1s(2)2s(2)2p(1)) бор может быть одновалентным (один неспаренный электрон на энергетическом 2p-подуровне) однако для бора хар-ны соединения в кот-х он 3-х валентен. Свободная 2р-орбиталь в возбужденном атоме бора обуславливает акцепторные свойства многих его соединений, в кот-х 3 ковалентные связи образованы по обменному ковалентному механизму(пр:BBr3).Эти соединения склонны к присоединению частиц с электронно-донорными свойствами,т.е. к образованию еще одной ковалентной связи по донорно-акцепторному механизму.Пр:BBr3+Br(степень-)=[Ввг4](степень-).2 изотопа бора: В(10-верхняя степень, 5–нижняя).Способность бора поглащать нейтроны обуславливает его применение в ядерной энергетике:из борсодержащих материалов делают регулирующие стержни ядерных реакторов.Кристаллы бора черного цвета,они тугоплавки(темп.плавления. 2300◦С),диамагнитны,обладают полупроводниковыми свойствами.Электрическая проводимость бора,как и других металлов мала и не сколько не возрастает при повышении температуры.Непосредственно с водородом бор не взаимодействует, а с металлами образует бориды.Гидриды бора(бораны)оч ядовиты и имеют весьма неприятный запах. Бориды s-металлов хим-и активны и часто используются для поулчения смеси боранов при обработке кислотами. Большинство боридов d- и f-металлов жаростойки,очень тверды, химически устойчивы.Их широко используют непосредственно в виде сплавов для изготовления деталей реактивных двигателей,лопаток гаховых турбин.Некоторые бориды применяют для изготовлеия катодов электронных приборов.Алюминий... Электронная конфигурация атома алюминия выражается формулой 1s(2)2s(2)2p(6)3s(2)3p(1).На внешнем электронном слое атома есть один неспаренный электрон: …… ……….Поэтому алюминий может проявлять валентность, равную единице.Однако эта валентность для алюминия не характерна.Во всех устойчивых соединениях степень окисл-я алюминия равна +3.Валентность равная 3,отвечает возбужденному состоянию атома Al …………………. По своей распространенности алюминий занимает 4 место среди всех элементов(после О,Н,Si) и явл-я самым распространеннымв природе металлом.Основная масса алюминия сосредоточена в алюмосиликатах:полевых шпатах,слюдах и тд.Алюминий-серебристо-белый легкий и чрезвычайно пластичный металл, обладающий высокой теплопроводностью и электрической проводимостью.Алюминий хим-и активен, с хлором и бромом он реагирует при комнатной температ-ре, а с иодом-при нагревании или в присутствии воды как катализатора.При 800◦С алюминй взаимод-ет с азотом, а при2000◦-с углеродом.Алюминий проявляет высокое хим-е средство к кислороду.На воздухе алюминий покрывается оч прочной тончайшей оксидной пленкой.Галлий,индий и таллий в виде простых вещ-в-легкоплавкие серебристо-белые металлы.Электронная структура предвнешнего уровня атомов: (n-1)s(2)(n-1)p(6)(n-1)d(10). Степень окисления галлия и индия в устойчивых соединениях равна +3.Для таллия более характерна степень окисл-я +1.Соединения таллия, в кот-х степень ок-я металла равна +3 явл-я сильным окислителем.Галлий имеет широкий температурный интервал существования жид состояния.Низкая температура плавления (около30), высокая темпер-ра кипения(2205)позволяют применять жидкий галлий для изгтовления манометров.Индий равномерно отражает световые волны всех длин и поэтому используется в точном приборостроении для изготовления зеркал.Таллий также вводиться в некоторые сплавы,главным образом это сплавы с оловом и свинцом. Свойства р-элементов 4 группы. К р-элементам 4 группы периодической системы относятся углерод,кремний,Ge германий,олово и свинец.Электронная конфигурация:.. ns(2)np(2).Радиус атома при переходе от углерода к свинцу увеличивается, а энергия ионизации уменьшается.в соответ-и с электронной конфигурацией атомов во внешнем электронном слое есть 2 неспаренных электрона: …………………………….Поэтому они могут проявлять валентность равную 2.При возбуждении атомов один s-электрон переходит на р-энергетический подуровень…………….. и рассматриваемые элементы могут проявлять валентность4(степень окисл-я +4 более хар-на для углерода,кремния и германия). В ряду С-Si-Ge-Sn-Pb усиливаются металлические свойства. Германий внешне похож на металл,хар-я малой электр-й проводимостью.Свинец, оловы-металлы.Углерод и кремнийВ соответствии с электронной структурой атомов углерод и кремний могут быть двухвалентными (2 неспаренных электрона в энерг подуровне р).Гораздо более характерны соединения в которых углерод и кремний 4-х валентны (возбужденное состояние атомов) … . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Углерод встречается в виде 3-х модификаций-алмаз,графит и карбин.Каждая из этих модификаций отвечает определенному типу гибридизации электронных орбиталей в атомах углерода. При sp(3)-гибридизации орбиталей образуется кристаллический полимер углерода с атомной координационной кубической решеткой-алмаз.Вследствие sp(3)-гибридизации электронных орбиталей каждый атом углерода в алмазе образует равноценные прочные сигма-связи с 4-мя соседними атомами углерода.Такая структура полимера объясняет очень высокую твердость алмаза,отсутсвие у него электронной проводимости и крайне низкую энтропию по сравнению с другими модификациями углерода. При sp(2)-гибридизации орбиталей образуется кристаллический полимер углерода с гексагональной слоистой структурой-графит. sp-гибридизация электронных орбиталей в атоме углерода приводит к возникновению прямолинейных цепочек,в кот-х каждый атом углерода способен к образованию двух сигма и двух Пи –связей.В образовании сигма-связей участвуют гибридные sp-орбитали,а Пи-связи-негибридизованные р-орбитали.Кристаллический полимер описанной структуры,называемый карбином,был получен советскими учеными Коршаком,Сладковым.Карбин-полупроводник. Кремний в отличие от углерода встречается в виде одной устойчивой модификации,так как для кремния хар-на лишь полна sp(3) гибридизация электронных орбиталейАлмазоподобная модификация кремния тугоплавка,имеет высокую твердость и напоминаетпо внешнему виду темно-серый металл.При комнатной температуре кремний явл-я полупроводником.На внешнем электронном слое атома кремния есть вакантные 3d-орбитали (Si…3s(2)3p(2)3d(0)), что отличает структуру внешнего слоя атома Si от атома углерода (С.. 2s(2)2p(2))………………………………………………
Кароч
Д э р ь м о !
