
- •1. Кинематическое описание движения. Перемещение, скорость.
- •2. Ускорение при криволинейном движении: нормальное и тангенциальное ускорение. Плоское вращение. Угловая скорость, ускорение.
- •4. Степени свободы и обобщенные координаты. Число степеней свободы абсолютно твердого тела.
- •5. Основная задача динамики. Понятие состояния в механике. Законы Ньютона.
- •6. Импульс, закон сохранения импульса.
- •7. Момент импульса. Закон сохранения момента импульса.
- •8. Момент силы. Основное уравнение динамики вращательного движения.
- •9. Силы в природе. Силы сухого и вязкого трения.
- •10. Упругая сила, закон Гука.
- •11.Работа силы. Кинетическая энергия.
- •12. Закон сохранения энергии
- •13. Консервативные и неконсервативные силы в механике. Потенциальная энергия.
- •15. Момент инерции тела и его физический смысл. Примеры вычисления момента инерции твердых тел. Теорема Штейнера.
- •16. Основное уравнение молекулярно - кинетической теории идеального газа.
- •17.Средняя кинетическая энергия поступательного движения молекулы. Молекулярно - кинетический смысл температуры.
- •18. Внутренняя энергия идеального газа.
- •21. Кпд идеальной тепловой машины. Цикл Карно. Понятие термодинамической температуры.
- •22.Второе начало термодинамики.
- •23. Уравнение Ван-дер-Вальса и его анализ.
- •25. Твердые тела. Аморфные и кристаллические тела. Дефекты кристаллов.
- •26. Уравнение гармонического колебания и его основные параметры.
- •29. Приведенная длина и центр качания физического маятника.
- •30. Действие периодической силы на затухающий гармонический осциллятор. Резонанс.
- •31. Уравнение плоской гармонической волны и ее основные параметры: длина волны, волновое число, фазовая скорость волны. Продольные и поперечные волны.
- •32. Волновое уравнение. Фазовая скорость волны в твердых телах и жидкостях.
16. Основное уравнение молекулярно - кинетической теории идеального газа.
МКТ—раздел физики, изучающий свойства объектов на основе их молекулярного строения. Молекула— мельчайшая частица вещества, определяющая его химические свойства Атомы—основная часть молекулы, их набор(не деление) ограничен
Основные положения МКТ а) вещество состоит из молекул. Доказательство: делимость тел, растворимость веществ, молекулы определяются электронным микроскопом. б) молекулы находятся в непрерывном хаотическом тепловом движении. Доказательство: давление газов, брауновское движение(хаотическое движение частиц в жидкости), диффузия(проникновение молекул одного вещества между молекулами другого вещества). в) молекулы взаимодействуют друг с другом. Доказательство: существование трёх агрегатных состояний вещества(газ. Жидкость, твёрдое тело), фазовые переходы между этими состояниями; упругие свойства твёрдых тел; поверхностное натяжений жидкостей;
Вывод основного уравнения МКТ
Давление газа на стенки сосуда определяется за счёт ударов молекул.
Предположим, что все молекулы имеют одинаковую массу m0 и движутся с одинаковой по модулю скоростью υ. Все удары молекул абсолютно упругие (предположим) Рассмотрим стенку
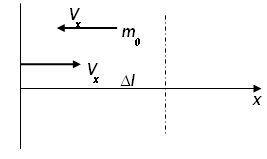
1 молекула передаёт стенке импульс: ∆p=m0Vx-m0(-Vx)=2m0Vx
За Δt о стенку ударяет N1 молекул, тогда импульс за Δt
∆pобщ.=N1∆p1=2m0VxN1
Давление
![]()
Концентрация
n
![]() [м-3]
[м-3]
![]() —полное
число молекул ,
—полное
число молекул ,
![]() число
ударов, т.к. половина молекул летит к
стенке, а вторая половина от стенку
число
ударов, т.к. половина молекул летит к
стенке, а вторая половина от стенку
![]()
![]() ,
∆l—
расстояние от стены, которое успевают
преодолеть молекулы за ∆t,
чтобы удариться об неё
,
∆l—
расстояние от стены, которое успевают
преодолеть молекулы за ∆t,
чтобы удариться об неё
∆l=Vx ∆t
![]()
![]()
Т.к. пространство имеет три измерения, то введём среднеквадратичную скорость.
Средняя скорость
![]()
Из этого следует все направления движения молекул равновероятны
Среднеквадратичная скорость:

Т.к. направления равновероятны, то средние значения равны:
![]()
Следовательно:
![]()
![]() —
основное
уравнение МКТ газа
—
основное
уравнение МКТ газа
17.Средняя кинетическая энергия поступательного движения молекулы. Молекулярно - кинетический смысл температуры.
![]()
. Молекулярно - кинетический смысл температуры. Определения температуры. В термодинамике температура определяется степень нагретости тела. Для того. Чтобы измерить температуру прибор(термометр) приводят в контакт с системой и ожидают наступление состояния термодинамического равновесия т.е. состояния когда прибор приобретает ту же температуру, что и определённая система.
В
молекулярной физике температура
определяется как мера средне кинетической
энергии молекул. В соответствии с теорией
Гиббса в состоянии термодинамического
равновесия на каждую степень свободы
приходится в среднем
![]() энергии, т.е.
энергии, т.е.
![]()
Е1— энергия 1 свободы одной молекулы
К— постоянная Больцмана
K=1.38۠*10-23 дж/н
Т— абсолютная температура, измеряется в К
Т=t+273 0C
Энергия молекулы(кинетическая)
![]()
i— число степеней свободы;
i=3 для поступательных степеней свободы.
Если молекула двухатомная, то i=5.
Для многоатомных i=6;
Расчёт проводят без учёта колебательных степеней свободы, т.к. эти степени свободы включаются только при высоких температурах, далёких от 273 К
На каждую колебательную степень свободы приходится kT энергии. Тогда поступательного движения
![]()
![]()
![]()
